Частинки речовин, забруднених повітрям, не регулюють печінковий цикл Кребса, метаболізм глюкози та ліпідів у мишей
Предмети
Авторська виправлення до цієї статті було опубліковано 16 березня 2020 року
Ця стаття оновлена
Анотація
Вступ
Вплив твердих частинок навколишнього повітря з дрібними (РМ2,5) та надтонкими (ПМ 1. Встановлено, що РМ2,5 переважно походить від стаціонарних джерел горіння, пов’язаних з дорожнім рухом, викликають реакції запального стресу, пов’язані з хронічною обструктивною хворобою легень (ХОЗЛ), астма та серцево-судинні захворювання 2,3,4.Недавні дослідження підкреслили важливість впливу забруднення повітря для посилення ризику метаболічних захворювань, таких як діабет 2 типу (T2D) 5 та метаболічних відхилень 6,7,8., головним фактором серцево-судинних захворювань 9 та сприйнятливості до T2D, може бути важливим, але недооціненим посередником довгострокового ризику у відповідь на вплив забруднення повітря. Епідеміологічні дослідження продемонстрували зв'язок між експозицією та резистентністю до інсуліну (IR) та T2D 10. Крім того, дослідження контрольованого опромінення виявили стереотипну реакцію на забруднення повітря, таку як надмірний печінковий глюконеогенез, голодування та постпрандіальне лікування гіперглікемія, порушення рівня ліпопротеїдів тригліцеридів, стеатоз печінки та запалення 11. Насправді ми, як і інші дослідники, продемонстрували важливу роль забруднення повітря у неалкогольному стеатогепатиті та жировій дисфункції печінки (NAFLD) 12,13,14 .
У цьому дослідженні ми вивчали метаболічні ефекти у відповідь на субхронічний (4 місяці) вплив РМ2,5 шляхом відстеження 13 глюкози С6 у печінці миші, використовуючи аналіз стабільної ізотопної метаболоміки (SIRM). Особливий інтерес представляв вивчення цих ефектів у субхронічний момент часу, на відміну від хронічного впливу, до встановленого фенотипу інсулінорезистентності 15. SIRM - це визнаний підхід, який дозволяє аналізувати аналіз метаболічної мережі на основі моделей маркування атомів-індукторів численних метаболітів 16. Наші результати показують, що лікування PM2,5 зменшує гліколіз і цикл Кребса, але посилює окислювальну гілку пентозофосфатного шляху (OxPPP), а також дані, що свідчать про посилений синтез жирних кислот. Ці метаболічні зміни подібні до тих, що спостерігаються при ІЧ та T2D; отже, може бути відповідальним за шкідливі наслідки для здоров'я, пов'язані з експозицією ПМ2,5 та розвитком метаболічних розладів.
Результати
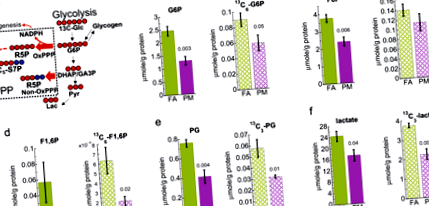
Зниження печінкового гліколізу у мишей, що зазнали впливу РМ2,5
Цікаво відзначити, що рівні як 13 С-глікогену, так і немеченого глікогену в печінці значно знижувались у мишей, що зазнали впливу РМ2,5, на основі аналізу ЯМР, як показано на рис. 2а, b та додатковій фіг. 5. Виснаження 13 С-глікоген, разом зі зниженим гліколізом, вказує на ослаблений синтез глікогену і, таким чином, зменшення відкладення глікогену в печінці.
1 H ЯМР-аналіз показує, що 13 C (a) і 12 С (b) глікоген знижується в печінці мишей, що зазнали впливу PM2,5 (PM), порівняно з контролем фільтрованого повітря (FA). Смужки помилок представляють стандартну помилку. Студент т-тестовий аналіз неспарених даних з однаковою дисперсією (n = 5) і в результаті стор-відображаються значення.
Експозиція PM2,5 збільшує окислювальну гілку пентозофосфатного шляху
Далі ми дослідили включення 13 C з 13 C-глюкози в PPP. Аналіз IC-FTMS продемонстрував незначне збільшення рівнів 13 С міченого рибоза-5-фосфату (R5P) і 13 С5-седогептулоза-7-фосфату (S7P) разом із підвищенням загального і 13 С міченого фосфорибозилпірофосфату (PRPP) у мишей, що зазнали впливу PM2,5, як показано на рис. 3a, b, d. Подібно до того, як PRPP є донором рибозилу синтезу нуклеотидів, ми спостерігали значне збільшення 13 C5-ATP (рис. 3c) у печінці, що зазнала впливу PM2.5, що, імовірно, являє собою 13 C5-рибозу в ATP 18. Разом ці результати підтримують збільшений приплив вуглецю від глюкози до АТФ через ППС. Більше того, ми помітили виснаження немеченого (12 С) АТФ у печінках мишей, що зазнали впливу РМ2,5 (рис. 3в), що може бути наслідком зниженого рівня гліколізу та порушеного циклу Кребса (див. Нижче).
Метаболіти пентозофосфатного шляху (PPP), кількісно визначені за допомогою IC-FTMS. Показано середнє значення суми всіх ізотопологів 13 С та 12 С (суцільні смужки) та суми всіх ізотологів 13 С або конкретних 13 Сn ізотополог, як зазначено в тексті (текстуровані смуги). PM, PM2,5 піддається; FA, фільтрований контроль повітря. R5P, рибоза-5-фосфат; PRPP, фосфорибозилпірофосфат; S7P, седогептулоза-7-фосфат. Смужки помилок представляють стандартну помилку. Студент т-тестовий аналіз неспарених даних з однаковою дисперсією (n = 4) і стор-показані значення вважаються значущими за допомогою процедури Бенджаміні-Хохберга (FDR = 0,1).
PPP складається з двох плечей, неOxPPP (рис. 1а) та окисного (OxPPP), який виробляє R5P та NADPH. Значне підвищення рівня 13 C5-S7P та загального рівня НАДФН у РМ2,5 проти печінки мишей, що зазнали впливу ФА (рис. 3d, е; пор. Рис. 1, схема), узгоджується із посиленням OxPPP, імовірно, у відповідь на АФК. Ми також виміряли включення 13 C з глюкози в антиоксидант глутатіон (GSH) за допомогою IC-FTMS і виявили, що як загальний, так і 13 C, мічений GSH, були зменшені (рис. 3f) у мишей, що зазнали впливу PM2.5, незважаючи на накопичення NADPH. Це свідчить про порушену здатність синтезу GSH, що веде до неадекватного підтримання окисно-відновного гомеостазу.
Порушення регуляції печінкового циклу Кребса у мишей, що зазнали впливу PM2.5
Раніше ми демонстрували помітні відхилення в структурі мітохондрій у відповідь на вплив PM2,5 15. Таким чином, ми дослідили печінку мишей, опромінених РМ2,5 та ФА, для проміжних продуктів циклу Кребса та включення 13 C із 13 C6-глюкози (рис. 4а). Вступ 13 вуглеводнів, одержуваних глюкозою C6, у цикл Кребса через ацетил-КоА призводить до мічення цитратом 13 С2 (m + 2). 13 C2-цитрату значно знизився у печінці, що зазнала впливу PM2.5, на основі аналізу IC-FTMS та GC-MS, як показано на рис. 4b та додатковому рис. 2b, відповідно. Ми також спостерігали зниження маркування 13 C2 проміжних речовин циклу Кребса нижче за течією цитрату, включаючи сукцинат, фумарат та малат (рис. 4в – е). Ми виміряли рівні 13 С2-аспартату як сурогатного метаболіту для оксалоацетату (ОАА), оскільки ОАА є надзвичайно лабільним і важко виміряти безпосередньо. 13 С2-аспартату було значно знижено у печінці, що зазнала впливу РМ2,5 (рис. 4f). Крім того, аналіз IC-FTMS 13 проміжних сполук C3 (m + 3) (додаткова фіг. 3) свідчить про зменшення надходження 13 C3-пірувату в цикл Кребса через карбоксилювання пірувату 19. Незважаючи на зменшення 13 метаболітів циклу Кребса, одержуваних C6-глюкозою, загальні немічені проміжні продукти циклу Кребса були незмінними, за винятком малату та аспартату, які зменшились у РМ2,5 у печінці.
Посилений печінковий ліпогенез у мишей, що зазнали впливу РМ2,5
Однією з ознак ІЧ та T2D є посилене перетворення глюкози в ліпіди 20. Цитрат, отриманий з циклу Кребса, є попередником синтезу жирних кислот. Цитрат експортується з мітохондрій мітохондріальним цитратним носієм (CIC) у цитоплазму, де він лізується до ОАА та ацетил-КоА ферментом АТФ цитратна ліаза (ACLY, див. Рис. 4а). Потім Acetyl-CoA бере участь у de novo синтез жирних кислот з кінцевим продуктом пальмітату 21. Отже, ми дослідили включення глюкози, отриманої 13 С, у пальмітат за допомогою ГХ-МС. Незважаючи на загальне зниження рівня гліколізу та синтезу цитратів, ми виявили збільшення загального збагачення 13 С у пальмітат (рис. 5а). На додачу, de novo Синтез жирних кислот, що відображається збагаченням 13 мічених ацетилом одиниць (отриманих з глюкози 13 С) у пальмітат, суттєво збільшений у печінці, що зазнала впливу РМ2,5 (рис. 5б).
Збільшення пальмітату в печінці мишей, які піддаються хронічному впливу PM2,5. Аналіз GC-MS вказує, що загальний пальмітат (a) і de novo синтез (b) збільшується у групі, що зазнала впливу PM2,5 (PM), порівняно з фільтрованим повітрям (FA). Смужки помилок представляють стандартне відхилення. Студент т-тестовий аналіз неспарених даних з однаковою дисперсією (n = 5).
Обговорення
Численні епідеміологічні дослідження та дослідження контрольованого опромінення як на людях, так і на моделях тварин показали, що вплив РМ2,5 індукує метаболічний синдром 22. Справді, ми та інші раніше демонстрували очевидний ІЧ-фенотип у мишей, які піддавались хронічному впливу протягом 10 місяців 15 та субхронічно протягом 10–17 тижнів. Однак остання була на мишах, які додатково отримували дієту з високим вмістом жиру, спільний вплив нікелю або певний генетичний фон, що суттєво посилило фенотип 11,23,24. І навпаки, при субхронічному впливі протягом 3 місяців або менше в експериментальних умовах, подібних до цього дослідження (час голодування та дієта), ІЧ-фенотип не був очевидним без змін маси тіла та профілю толерантності до глюкози 24,25. Отже, ІЧ-фенотип у нашій тваринній моделі був результатом хронічного опромінення як окремого, так і субхронічного впливу ПМ2,5 у супроводі іншого екологічного або біологічного стресового фактору.
Раніше ми продемонстрували збільшення експресії PEPCK, PGC1a та дефектів печінкового сигнального шляху інсулін-AKT-FoxO1, що призводить до явної гіперглікемії та ІР у відповідь на вдихання РМ2,5 11,26. Це дослідження намагалося визначити, чи аномалії метаболічних шляхів у печінці передують розвитку явного ІР та Т2D, вивчаючи зміни метаболітів проміжного метаболізму з печінки мишей, що зазнали впливу РМ2,5 до розвитку ІЧ та Т2Д (додатковий рис. 4). Таким чином, ми провели підхід до виявлення ізотопів із стабільністю 13 ° C, щоб визначити, як вплив PM2.5 змінює використання глюкози в печінці до розвитку ІЧ та T2D. Ми показали, що вплив РМ2,5 призводить до змін у печінковому метаболізмі, пов'язаних з T2D та ІЧ, ще до виявлення доказів їх прояву. Попередні дослідження в серцевих тканинах мишей, які зазнали гострого ТЧ2,5, показали знижений гліколіз 27. На узгодження, ми спостерігали виснаження 13 С-мічених та загальних (12 С + 13 С) гліколітичних продуктів, включаючи лактат, із печінки мишей, що зазнали впливу РМ2,5. Наші дані свідчать про те, що вплив PM2,5 призводить до зниження печінкової гліколітичної активності, отриманої від глюкозних та неглюкозних попередників, таких як глікоген.
Проте, незважаючи на знижений рівень попередника 13 C-цитрату, включення 13 C у жирні кислоти було посилено. Це свідчить про те, що 13 С-цитрат виснажився частково через його посилене використання в de novo синтез жирних кислот. Наші результати щодо синтезу жирних кислот узгоджуються із раніше повідомленим системним дисбалансом ліпідного гомеостазу після впливу PM10 43, NAFLD 44 та збільшенням ліпідів крові після хронічного впливу PM2,5 36. Дійсно, на пізній стадії прогресування до NASH або T2D, дихання мітохондрій, синтез АТФ та швидкість окислення ліпідів у печінці порушується 45,46, що може погіршити передачу сигналів інсуліну та посилити запалення 47,48. Як ці зміни відбуваються, невідомо, проте, ми представили докази того, що метаболічний ефект впливу PM2,5 порушує окислення глюкози, компенсоване використанням альтернативних видів палива. Відповідно до наших результатів, зареєстрованими ефектами гострого впливу РМ2,5 є зниження АТФ в кардіоміоцитах, зменшення накопичення фумарату в печінці та легенях 27,33,34,49. Однак ми визнали, що наша оцінка обмежена метаболізмом печінки в один момент часу, цього недостатньо, щоб описати без однозначності кінетику та спрямованість метаболічних реакцій.
Миші, що зазнали впливу PM2.5, не виявили відмінностей щодо мишей, що зазнали відфільтрованого повітря, щодо зміни ваги або толерантності до глюкози в цей ранній момент часу (додаткова фіг. 4). Тому ми стверджуємо, щоб показати, що метаболічні зміни передують появі ІР/діабету у мишей, що зазнали впливу РМ2,5. Дійсно, раніше опубліковані результати показали окисно-відновний дисбаланс у нирках мишей, хронічно опромінених РМ2,5, та подібного метаболічного фенотипу після гострого впливу в серцеву тканину та клітини печінки, як це повідомляється тут для печінки 27,61,62. Ми визнаємо, що обмеження нашого дослідження полягає в тому, що молекулярні основи метаболічної дисрегуляції неможливо визначити, що є предметом майбутніх досліджень. Однак наші результати дозволяють зрозуміти механізм; ранні реакції на ослаблений гліколіз, цикл Кребса та синтез GSH, а також посилений ліпогенез викликають дисбаланс відновлювальної здатності печінки, що призводить до порушення окислювально-відновного гомеостазу в печінці мишей, що зазнали впливу PM2,5. в свою чергу може призвести до запалення, посилення фіброзу та ліпоідного стеатозу в печінці через збільшення АФК та подальший розвиток ІР та T2D 12,63,64,65,66 .
Матеріали і методи
Тварини
Семитижневих самців мишей C57BL/6J купували у лабораторіях Джексона (Бар-Харбор, штат Мексика) і врівноважували протягом 2 тижнів до впливу. Усі миші були розміщені в клітках із нормальним чау-харчуванням при температурі 21 ° C протягом 12 годин. світло/12-год. темний цикл із вільним доступом до води та їжі. Протоколи та використання тварин були затверджені Комітетом з догляду та використання тварин (IACUC) при Університеті штату Меріленд (номер протоколу 1113011) та Університеті Джона Хопкінса (номер протоколу M013H134), Балтімор. Результати всіх експериментів відповідали рекомендаціям та рекомендаціям IACUC, включаючи всі методології та процедури, що стосуються експериментів на мишах у цьому дослідженні.
Навколишній протокол інгаляцій для всього тіла
Мишей C57BL/6J піддавали впливу фільтрованого повітря (FA) або концентрованого навколишнього середовища PM2,5 у мобільному причепі, розташованому в кампусі Університету штату Меріленд, Балтимор. Концентрований РМ2,5 отримували за допомогою універсальної системи збагачення концентрації аерозолю (VACES), як описано раніше 67. Мишей піддавали дії концентрованих частинок PM2,5 протягом 6 годин на день, 5 днів на тиждень протягом загальних 16 тижнів. Контрольну групу (миші, що зазнали впливу FA) в експерименті піддавали ідентичному протоколу, при цьому всі частинки РМ2,5 видаляли за допомогою високоефективного фільтру твердих частинок і повітря, розміщеного у впускному клапані. Середні концентрації РМ2,5 протягом періоду впливу становили 8,7 ± 2,6 мкг/м 3 в навколишньому повітрі та 62,5 ± 21,3 мкг/м 3 у концентрованій камері ПМ. Середні рівні ПМ2,5 (± SD) у поточному дослідженні (62,5 ± 21,3 мкг/м 3) були подібними в межах стандартного відхилення до нашого попереднього звіту (69,6 ± 48,4 мкг/м 3) субхронічного 3-місячного опромінення та співіснування з нікелем (Ni) 24. Хімічний склад суміші ПМ2,5 у цьому дослідженні не є недопустимим, однак суміш, розташована поблизу ділянки, була охарактеризована протягом двох років 68 .
Протокол внутрішньочеревного тесту на толерантність до глюкози
За тиждень до кінця періоду впливу ми провели раніше повідомлену процедуру внутрішньочеревного тесту на толерантність до глюкози (IPGTT) 15. Тест на толерантність до глюкози вимагав, щоб миші голодували протягом 12 годин (включаючи мишей, яким ми зробили ін’єкцію 13 г-глюкози), що призводить до нормального вживання глюкози в печінці 69. Мишей Бріфлі зважували, а потім внутрішньочеревно вводили глюкозу (2 мг/кг маси тіла). Зразки крові відбирали через хвостову вену та вимірювали концентрації глюкози до та через 30, 60, 90 та 120 хв після ін'єкції на елітному глюкометрі (Bayer, Леверкузен, Німеччина). Додаткова фіг. 5 повідомляє про ваги тіла, графік IPGTT та площу під кривою, розраховану за допомогою програмного забезпечення GraphPad із стандартною похибкою (n = 10).
13 Введення глюкози C6 та збирання тканин
На наступний день остаточного впливу мишам внутрішньочеревно вводили 13 C6-глюкози (Кембриджські лабораторії ізотопів) відповідно до протоколу, описаного Fan та ін. із модифікацією 70. 80 мкл (20 мг) 13 C6-глюкози в PBS вводили через 15 хв. інтервали три рази, щоб миші голодували протягом 12 годин. Реєстрували час ін’єкції та збирали кров до та після ін’єкції. Тканини печінки збирали через 45 хв. після першої ін'єкції (15 хв. після останньої ін'єкції) та негайно замороженої (протягом 5 хв. після розтину) у рідині N2.
Підготовка зразка
Ядерний магнітний резонанс (ЯМР)
Іонна хроматографія-мас-спектрометрія з перетворенням Фур'є (IC-FTMS)
Наявність даних
Дані, що підтверджують результати цього дослідження, доступні за запитом кожному, хто має суспільний інтерес. Будь ласка, надішліть електронного листа відповідному автору, де ви чітко вказали свою приналежність.
- Амінокислоти з розгалуженими ланцюгами посилюють порушення печінкової глюкози та метаболізму ліпідів, пов’язані з ожирінням
- Вуглеводи в харчуванні риб впливають на ріст, метаболізм глюкози та печінкові ферменти - HEMRE
- Асоціації між метаболічними профілями амінокислот, ліпідів та глюкози при дитячому ожирінні BMC
- Нокдаун CGI-58 у мишей викликає стеатоз печінки, але запобігає ожирінню, викликаному дієтою, та глюкозі
- Накопичення PNPLA3 у краплях ліпідів є основою асоційованого стеатозу печінки PNAS