Асоціації між метаболічними профілями амінокислот, ліпідів та глюкози при ожирінні серед дітей
Анотація
Передумови
Як повідомляється, профілі амінокислот без плазми корелюють із ожирінням та метаболізмом глюкози, і їх вивчали як потенційно корисні біомаркери захворювань, пов’язаних із способом життя, що впливають на обмін речовин у дорослому віці. Однак знань про ці стосунки бракує дітям, незважаючи на зростаючу проблему громадського здоров'я, спричинену дитячим ожирінням.
Метою цього дослідження було оцінити, чи можуть профілі амінокислот без плазми служити корисними біомаркерами захворювань, пов’язаних із способом життя, у дітей із ожирінням.
Методи
У цьому ретроспективному дослідженні використовувались медичні записи 26 пацієнтів (15 чоловіків, 11 жінок) у віці 9 або 10 років із середнім або важким ожирінням та гіперліпідемією у період з квітня 2015 року по березень 2017 року. Ступінь ожиріння 30% і більше визначали як середній або важкий. Рівні амінокислот порівнювали між ожирілими дітьми з порушенням толерантності до глюкози та без нього за допомогою t-тесту або U-тесту Манна-Уїтні. Крім того, вплив таких факторів, як товщина середовища інтими, холестерин ліпопротеїдів низької щільності, холестерин ліпопротеїдів високої щільності, амінокислоти та оцінка моделі гомеостазу - резистентність до інсуліну (HOMA-IR) аналізували попарно, використовуючи кореляцію Пірсона або ранг Спірмена.
Результати
HOMA-IR позитивно корелював з валіном, лейцином (Leu), ізолейцином, фенілаланіном, триптофаном, метіоніном, треоніном, лізином, аланіном, тирозином, глутаматом (Glu), проліном, аргініном, орнітином, загальними вільними амінокислотами (усі P
Передумови
Профілі амінокислот (АА) використовувались як біомаркер ожиріння та СД. Раніше ми повідомляли, що плазмові концентрації валіну (Val), лейцину (Leu) та ізолейцину (Ile), а також загальні амінокислоти з розгалуженим ланцюгом (BCAA), аланін (Ala), цитрулін (Cit) та пролін ( Pro), були значно вищими у діабетичних мишей, ніж у звичайних мишей [5]. Ван та співавт. [6] повідомив про 12-річне подальше дослідження, яке показало, що рівні BCAA, тирозину (Tyr) та фенілаланіну (Phe) у плазмі можуть бути провісниками майбутнього розвитку діабету у недіабетних суб'єктів. Інші дослідження повідомляли про значну асоціацію між плазмовими рівнями певних АА та індексом маси тіла (ІМТ) [7], АА та регуляцією глюкози [8]. У дослідженні японського ожиріння Такашина та співавт. [9] повідомляв про специфічні асоціації між певними АА, включаючи Val, Leu, Ala та Cit, тип/ступінь ожиріння та показники регуляції глюкози/інсуліну у дорослих японців із нормальним метаболізмом глюкози.
У цьому дослідженні ми проаналізували взаємозв'язок амінокислот крові та метаболічних станів ожиріння, щоб оцінити, чи можуть профілі амінокислот без плазми стати корисними біомаркерами захворювань, пов'язаних із способом життя, у дітей із ожирінням. Більше того, ми обговорили метаболічну роль амінокислот у дітей із ожирінням. Це дослідження включало клінічне лабораторне обстеження та вимірювання товщини внутрішньої середовища внутрішньої сонної артерії як маркера метаболічного стану.
Методи
Вивчати дизайн
Ми ретроспективно вивчили медичну документацію 26 пацієнтів (чоловіки: 15, жінки: 11), віком 9 або 10 років, які були представлені у відділенні педіатрії Університетської лікарні Кумамото із середнім та важким ожирінням (визначається як ступінь ожиріння ≥30 %) на першому та другому (через 6 місяців) скринінгах, проведених у місті Кумамото у період з квітня 2014 р. по березень 2016 р. Ступінь ожиріння розраховували за формулою: ([реальна вага тіла – стандартна вага тіла залежно від віку] ÷ стандарт вага × 100), як визначено Японським товариством дитячої ендокринології [10].
Клінічна оцінка
Клінічна інформація, включаючи вік, стать, симптоми, сучасний стан, історію хвороби, вживання ліків та сімейну історію, реєструвалась у стандартизованій формі даних обстежуваним медичним персоналом під час відвідувань пацієнтів. Ступінь ожиріння, індекс маси тіла (ІМТ), артеріальний тиск, сечова кислота (UA), функція печінки [аланінамінотрансфераза (ALT), аспартатамінотрансфераза (AST), лактатдегідрогеназа (LDH) та γ-глутамілтрансфераза (γ- GTP)], толерантність до глюкози [рівень глюкози в крові натще, інсулін, C-пептид та оцінка моделі гомеостазу - резистентність до інсуліну (HOMA - IR)] та рівень ліпідів у крові [загальний холестерин (T-CHO), холестерин ліпопротеїдів низької щільності ( Оцінювали LDL-CHO), холестерин ліпопротеїдів високої щільності (HDL-CHO) та тригліцериди (TG)]. Зразки крові дітей з ожирінням збирали після голодування протягом 12 год.
Визначення рівня амінокислот та вимірювання товщини інтими середовища
Амінокислоти плазми аналізували за допомогою мас-спектрометра рідинного хроматографа (SRL, Inc., Токіо, Японія). IMT внутрішньої лівої та правої сонних артерій вимірювали за допомогою ультразвукового апарату Aplio XG (Toshiba Medical System Corporation, Точігі, Японія) та переглядали двома техніками. ІМТ вимірювали в трьох точках обох внутрішніх сонних артерій і усереднювали (Додатковий файл 1).
Аналіз якості даних
Два дослідники, які не брали участі у медичному діагнозі, ультразвуковому дослідженні, аналізі крові чи оцінці медичної карти, провели дані та статистичний аналіз у цьому дослідженні.
Статистичний аналіз
Ми порівняли рівень амінокислот у дітей із ожирінням із порушенням толерантності до глюкози та без нього за допомогою t-тесту або U-тесту Манна – Уїтні. Фактори IMT, LDL- і HDL-CHO (співвідношення LDL/HDL), амінокислоти, HOMA-IR та UA аналізували попарно, використовуючи кореляцію Пірсона або кореляцію рангу Спірмена в IBM SPSS Statistics ver. 25. HOMA-IR та UA були залежними змінними для прогнозування значень амінокислот у крові, такими як Val, Leu та Ile, які є незалежними змінними. Співвідношення IMT та LDL/HDL не були залежними змінними для значень амінокислот у крові. Двостороннє значення ймовірності P
Результати
Клінічні спостереження
У цьому дослідженні ми оцінили 15 чоловіків (вік: 122,2 ± 4,2 місяця) та 11 жінок (вік: 122,9 ± 4,1 місяця) з ожирінням. Їх висота, вага та ІМТ становили 140,4 ± 6,4 та 140,0 ± 4,2 см, 46,6 ± 7,6 та 45,8 ± 6,9 кг та 23,5 ± 2,5 та 23,3 ± 2,4, відповідно (Додатковий файл 1).
У дев'ятнадцяти відсотків (5/26) дітей із ожирінням у цьому дослідженні розвинулось просте ожиріння без відхилень у даних крові, у 58% (15/26) - гіперхолестеринемія (LDL-CHO ≥ 140 мг/дл), 19% (5/26) розвинулася гіпертригліцеридемія (TG ≥ 120 мг/дл), у 8% (2/26) розвинулася гіпоHDLemia (HDL-CHO 30 МО/л). Жодне з дітей не виявило значних атеросклеротичних уражень ні в одній із своїх внутрішніх сонних артерій. Середнє значення IMT становило 0,54 ± 0,06 мм (ліворуч: 0,55 ± 0,07 мм; праворуч: 0,54 ± 0,07 мм).
Кореляції, що стосуються рівня ліпідів
Рівні T-CHO та LDL-CHO негативно корелювали з ІМТ, HOMA-IR, рівнем інсуліну в крові та γ-GTP (табл. 1). Рівні ЛПВЩ негативно корелювали з IMT (N = 26; P = 0,039), а співвідношення ЛПНЩ/ЛПВЩ позитивно корелювали з IMT (N = 26; P = 0,023) (таблиця 1). Ми також спостерігали негативну кореляцію між співвідношенням ЛПНЩ/ЛПВЩ та рівнем Tyr у крові. Додатковий файл 1 містить деталі порівняння лабораторних метаболічних даних між ожирілими дітьми із співвідношенням ЛПНЩ/ЛПВЩ ≤ 2,0 та співвідношенням ЛПНЩ/ЛПВЩ> 2,0. Не було суттєвих зв'язків між співвідношенням ЛПНЩ/ЛПВЩ та співвідношенням HOMA-IR або ЛПНЩ/ЛПВЩ та амінокислотами (таблиці 1 та 2, додатковий файл 1). Однак співвідношення ЛПНЩ/ЛПВЩ позитивно корелювало з IMT (Додатковий файл 1).
Кореляції, що включають резистентність до інсуліну
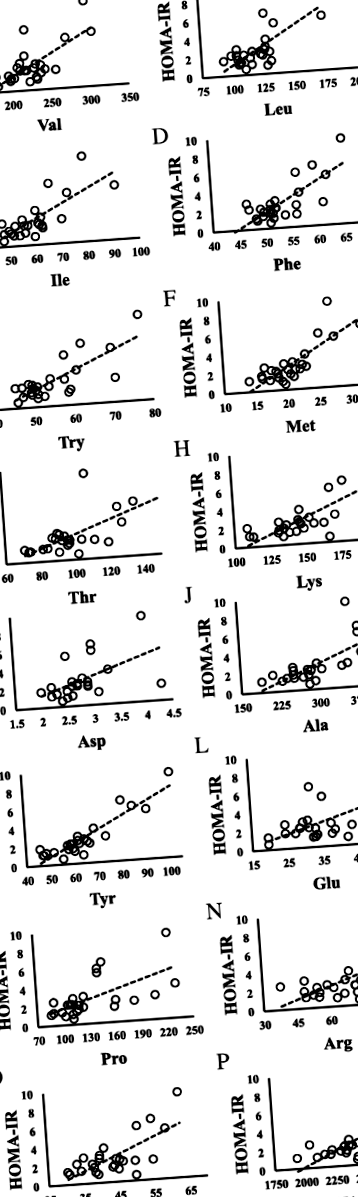
На рисунку 1 показані діаграми розсіювання, що демонструють кореляцію між рівнями HOMA-IR та амінокислотами. HOMA-IR позитивно корелював з Val, Leu, Ile, Phe, триптофаном (Trp), метіоніном (Met), треоніном (Thr), лізином (Lys), Ala, Tyr, глутаматом (Glu), Pro, аргініном (Arg), орнітин (Orn) та загальні вільні амінокислоти (TFAA) (усі P Рис. 1
Взаємозв'язок між HOMA-IR та амінокислотами у дітей із порушеннями толерантності до глюкози (HOMA-IR ≥2,5). a HOMA-IR проти Valine; N = 9, y = 0,0434x - 5,9926, Р. 2 = 0,5007, P = 0,033. b HOMA-IR проти лейцину; N = 9, y = 0,0776x - 5,6865, Р. 2 = 0,5482, P = 0,023. c HOMA-IR проти фенілаланіну; N = 9, y = 0,2707x - 10,711, Р. 2 = 0,4843, P = 0,037. d HOMA-IR проти триптофану; N = 9, y = 0,1725x - 6,0928, Р. 2 = 0,4479, P = 0,049. e HOMA-IR проти метіоніну; N = 9, y = 0,3807x - 4,4448, Р. 2 = 0,5995, P = 0,014. f HOMA-IR проти лізину; N = 9, y = 0,0787x - 8,4333, Р. 2 = 0,6733, P = 0,007. g HOMA-IR проти тирозину; N = 9, y = 0,151x - 6,9265, Р. 2 = 0,843, P = 0,000. h HOMA-IR проти аргініну; N = 9, y = 0,0899x - 1,7275, Р. 2 = 0,4625, P = 0,044. i HOMA-IR проти орнітину; N = 9, y = 0,2148x - 5,5718, Р. 2 = 0,8164, P = 0,001. j HOMA-IR проти загальних амінокислот; N = 9, y = 0,0056x - 10,198, Р. 2 = 0,4655, P = 0,043
Дані метаболізму у дітей із ожирінням із HOMA-IR ≤1,6, 1,6 Таблиця 3 Значення аналізів крові у дітей із та без порушення толерантності до глюкози
У дітей із ожирінням із зниженим рівнем HOMA-IR після 6 місяців безмедикаментозного втручання, таких як харчування та вправи, рівень Val, Leu, Ile, Asp, Ala, Tyr, Glu та Pro знизився, але Gly та Ser збільшено (додатковий файл 1). Навпаки, у дітей із ожирінням із підвищеним HOMA-IR після втручання всі ці амінокислоти мали тенденцію до збільшення (Додатковий файл 1).
Співвідношення за участю UA
Цікаво, що UA позитивно корелював з Leu (P = 0,005) та Glu (P = 0,019) і негативно корелює із серином (Ser), гліцином (Gly) та аспарагіном (Asn) (P = 0,007, P = 0,003, і P = 0,013 відповідно) (табл. 2). На рисунку 3 показані діаграми розсіювання, що зображують ці кореляції. Жодні амінокислоти не корелювали з IMT (Таблиця 2).
Взаємозв’язки між UA та амінокислотами у всіх дітей. a UA проти лейцину; N = 26, y = 0,032x + 1,1692, Р. 2 = 0,2925, P = 0,005. b UA проти глутамату; N = 26, y = 0,048x + 3,3752, Р. 2 = 0,2183, P = 0,019. c UA проти серину; N = 26, y = - 0,0307x + 8,4566, Р. 2 = 0,2769, P = 0,007. d UA проти гліцину; N = 26, y = - 0,0238x + 9,0036, Р. 2 = 0,328, P = 0,003. e UA проти аспарагіну; N = 26, y = - 0,1028x + 8,826, Р. 2 = 0,2375, P = 0,013
Обговорення
У таблиці 5 узагальнено зв’язок між амінокислотами крові та HOMA-IR, UA, LDL/HDL та IMT. Ожиріння часто переходить з раннього дитинства на шкільний вік, і воно поширюється на зрілий вік приблизно в 50% випадків. Є деякі повідомлення про те, що ожиріння, гіперліпідемія та гіперглікемія у дорослих суттєво корелюють з ІМТ та є факторами ризику серйозно підвищеного ІМТ [11, 12]. Ця кореляція спостерігалась і у дітей [13, 14]. Хоча артеріосклероз не поширений у дітей із ожирінням, їх ІМТ, як правило, вищий, ніж у дітей, які не страждають ожирінням [14, 15]. У цьому дослідженні ми виявили, що IMT корелював негативно з HDL-CHO та позитивно із співвідношенням LDL/HDL, хоча позитивної кореляції з LDL-CHO не було. Ці результати свідчать про те, що ожиріння зумовлює артеріосклеротичні зміни навіть у дитячому віці. Факторами ризику атеросклерозу є гіпертонія, гіперглікемія та гіперліпідемія; однак у небагатьох дітей із ожирінням розвивається гіпертонія. Гіперліпідемія та гіперглікемія вважаються найважливішими факторами ризику розвитку атеросклерозу. У нашій дитячій групі із ожирінням резистентність до глюкози та інсуліну в крові суттєво не впливала на ІМТ, проте метаболічний параметр ліпідів суттєво корелював з ІМТ.
Наявність у дитячому віці більшої кількості факторів ризику розвитку захворювань, пов’язаних із способом життя, пов’язано з більшим ІМТ у дорослих [16, 17]. Райтакарі та ін. [16] повідомляв, що низка факторів ризику розвитку атеросклерозу, виміряних у підлітків від 12 до 18 років, включаючи високий рівень ХС ЛПНЩ, ІМТ та систолічний артеріальний тиск, безпосередньо пов’язані з ІМТ сонної артерії у дорослих. Наявність цих факторів ризику у немовлят та шкільного віку також вплинуло на ІМТ у дорослих. Тому ми повинні розглядати лікування дітей із ожирінням як групу захворювання, а не просто як групу з факторами ризику майбутньої хвороби, пов’язаними із способом життя.
Підвищений рівень амінокислот, таких як BCAA, Ala, Glu, Asp та Tyr, які відносяться до діабету II типу, раніше спостерігався у дітей із ожирінням з HOMA-IR ≥ 2,5 [7]. Ми показали позитивні кореляційні зв'язки між HOMA-IR та кількома амінокислотами, включаючи TFAA, у дітей із порушеннями толерантності до глюкози (HOMA-IR ≥2,5). У цих дітей TFAA також суттєво корелював з вмістом глюкози та інсуліну в крові. Коли розвивається гіпер-харчування та розвивається порушення толерантності до глюкози, накопичуються як глюкоза, так і амінокислоти. Такі клітини, як гепатоцити та клітини скелетних м’язів, насичуються, і це вважається причиною гіпераміноацидемії.
Також були задокументовані відповідні зв'язки між рівнем амінокислот у плазмі крові та кількома іншими факторами. Інсулін, гормон росту, глюкагон та IGF-1 відіграють важливу роль у регуляції енергетичного обміну в живому тілі [18,19,20], і, як було продемонстровано в цьому дослідженні, інсулін впливає на рівень амінокислот у плазмі. Деякі звіти продемонстрували взаємозв'язок між ІМТ та амінокислотами [21, 22]. Однак у нашому дослідженні амінокислоти крові не мали суттєвої кореляції з IMT. Це явище можна пояснити зміною метаболізму амінокислот та чутливості до інсуліну у дітей із середнім ожирінням, оскільки IMT асоціювався з ЛПНЩ/ЛПВЩ, але не з рівнем інсуліну в крові або HOMA-IR.
Продемонстровано зв'язок між ВСАА та метаболічним синдромом, ожирінням, діабетом ІІ типу та/або резистентністю до інсуліну [7, 23, 24], а ВСАА є маркером кардіометаболічного незалежно від категорії ІМТ [25]. Підвищений вміст BCAA та ліпідів у плазмі крові може призвести до розвитку β-клітинної дисфункції, що може прискорити перехід від ожиріння, стійкого до інсуліну стану, до метаболічного синдрому та діабету II типу [24]. Позефський та ін. [26] припустив, що порушення активності інсуліну та зменшення використання амінокислот у м’язах підвищують рівень BCAA у плазмі крові внаслідок зменшення засвоєння BCAA у м’язах при захворюваннях, пов’язаних із способом життя. Більше того, Ньюгард [24] міркував, що збільшення вмісту BCAA в циркулюючій крові у осіб із ожирінням та резистентними до інсуліну частково є наслідком зниження катаболізму АА у їх жировій тканині. Вважається, що легко використовувані субстрати глюкози та ліпідів усувають необхідність катаболізму АА в жировій тканині шляхом зниження регуляції катаболічних ферментів BCAA шляхом придушення сигналізації про активацію пероксисом проліфератором-γ в таких метаболічних адаптаціях.
Іншою особливо важливою амінокислотою є Ala. Würtz et al. [27] повідомляв, що субстрати глюконеогенезу, включаючи Ala, зростають у дорослих із порушенням толерантності до глюкози. Більше того, Shimizu et al. [28] повідомляв, що виснаження плазми Ala сприяє збільшенню значень фактора росту 21 фібробластів у плазмі та посиленню зв'язку печінки та жиру, що призводить до активації ліполітичних генів у жировій тканині.
Амінокислоти є не тільки основними поживними речовинами, що служать джерелом енергії для людського організму, але вони також беруть участь у багатьох біохімічних процесах, включаючи біосинтез пуринів та вироблення UA. В останні роки виявлено, що багато факторів, включаючи ІМТ, споживання алкоголю, гіперліпідемію та діабет, сприяють підвищенню рівня UA в крові [29]. Наше дослідження показало, що у дітей із ожирінням на УА може впливати метаболізм амінокислот, а не гіперглікемія та гіперінсулінемія. Ми виявили зниження рівня Gly та Ser з підвищеним рівнем UA в крові. Раніше у дорослих пацієнтів із безсимптомною гіперурикемією або подагрою було виявлено зниження рівня глікемія та Ser в крові порівняно зі здоровими дорослими контролями [30]. У тому ж дослідженні було виявлено підвищення рівня Ala, Val, Ile та Orn у дорослих пацієнтів з безсимптомною гіперурикемією, але в нашому дослідженні ці амінокислоти не корелювали з UA. Здається, Gly та Ser пов'язані з процесом метаболізму підвищення рівня UA в крові [31]. Хоча Ser не має жодного відомого відповідного зв'язку із синтезом UA, Gly необхідний для синтезу de novo пурину [32], який є біосинтетичним попередником UA. Більше Gly можна споживати для біосинтезу пурину у дітей із ожирінням при гіперінсулінемії.
Це дослідження має ряд помітних обмежень. В основному обсяг нашої вибірки був відносно невеликим, зокрема щодо порівняння між дітьми з порушеною толерантністю до глюкози та без неї. Це обмежило статистичну силу робити тверді висновки. Нарешті, ми не оцінювали вплив факторів харчування та способу життя, або генетичних факторів, включаючи сімейну історію ожиріння, на амінокислотні структури.
Останніми роками необхідна профілактика ожиріння у дітей, оскільки поширеність надмірної ваги та ожиріння у дітей віком від 5 років і менше зростає у всьому світі [33]. В Японії обстеження фізичного та психічного розвитку проводили маленьким дітям у віці 1,5 та 3 років. Geserick et al. повідомлялося, що більшість дітей, які страждали ожирінням у віці від 2 до 6 років, страждали ожирінням у підлітковому віці [34]. Надалі нам потрібно проводити скринінг та втручання на предмет ожиріння у віці 3 та 6 років до їх вступу до дитячого садка та початкової школи відповідно. Це повинно включати оцінку їх метаболічного стану. Також було б бажано вивчати учнів молодших класів із ожирінням. Аналіз метаболічних профілів, включаючи амінокислоти у ожиріних дітей та підлітків різних вікових груп, може виявити додаткові проблеми та засоби, що стосуються ожиріння дітей.
Висновки
Наші дані підтверджують потенціал амінокислотних профілів як корисного маркера для раннього втручання у дитяче ожиріння. Важливо, що ці профілі відображають порушення толерантності до глюкози та гіперурикемію на ранній стадії ожиріння. Більше того, стан незбалансованих або підвищених амінокислот, пов'язаних із ожирінням, таких як BCAA в крові, може посилити ожиріння та чутливість до інсуліну. Тому наші результати також підтверджують думку, що дієта з хорошим харчовим балансом та ЛФК, що нормалізують баланс амінокислот у крові, важливі для лікування ожиріння.
Наявність даних та матеріалів
Набори даних, використані та/або проаналізовані під час поточного дослідження, доступні у відповідного автора за обґрунтованим запитом.
- Амінокислоти з розгалуженими ланцюгами посилюють порушення печінкової глюкози та метаболізму ліпідів, пов’язані з ожирінням
- Пов’язки між рівнем амінокислот з розгалуженим ланцюгом, ожирінням та кардіометаболічними ускладненнями
- Сприятливий вплив журавлини на профілактику ожиріння та пов'язаних з цим ускладнень Метаболічний
- Сприятливий вплив імбиру Zingiber officinale Roscoe на ожиріння та метаболічний синдром огляд
- Кесарів розтин, тривалі пологи впливають на дитячі кишкові бактерії, ризик ожиріння у дітей та