Церебральне запалення сприяє енцефалопатії та набряку мозку при гострій печінковій недостатності: захисний ефект міноцикліну
Дослідницький відділ неврології, лікарня Сент-Люк (C.H.U.M.), Монреальський університет, Монреаль, Квебек, Канада
Дослідницький відділ неврології, лікарня Сент-Люк (C.H.U.M.), Монреальський університет, Монреаль, Квебек, Канада
Дослідницький відділ неврології, лікарня Сент-Люк (C.H.U.M.), Монреальський університет, Монреаль, Квебек, Канада
Дослідницький відділ неврології, лікарня Сент-Люк (C.H.U.M.), Монреальський університет, Монреаль, Квебек, Канада
Дослідницький відділ неврології, лікарня Сент-Люк (C.H.U.M.), Монреальський університет, Монреаль, Квебек, Канада
Дослідницький відділ неврології, лікарня Сент-Люк (C.H.U.M.), Монреальський університет, Монреаль, Квебек, Канада
Анотація
Скорочення
Гостра печінкова недостатність (АЛФ) внаслідок вірусної інфекції або токсичної травми печінки є загрозою для життя. Рівень смертності надзвичайно високий, і смерть виникає переважно від грижі мозку через внутрішньочерепну гіпертензію, спричинену набряком мозку. З'являється все більше доказів того, що запалення відіграє значну роль у патогенезі набряків мозку при АЛФ. Наприклад, наявність системного запалення пов’язане з більш швидким прогресуванням енцефалопатії та набряку мозку у хворих на АЛФ (Роландо та ін. 2000). Системне запалення при ALF призводить до підвищення рівня циркулінів прозапальних цитокінів, включаючи фактор некрозу пухлини альфа (TNF-α) та інтерлейкіни (IL-1β, IL-6) (Nagaki та ін. 2000 р .; Джалан та ін. 2004). Більше того, дослідження артеріо-венозних різниць у пацієнтів з АЛС з неконтрольованою внутрішньочерепною гіпертензією свідчать про чистий витік мозку TNF-α, Il-1β та IL-6, що узгоджується із збільшенням продукції цих цитокінів у мозку (Jalan та ін. 2003; Райт та ін. 2007). Однак переконливих доказів збільшення вироблення цитокінів у мозку при АЛФ бракує.
Метою цього дослідження було оцінити механізми запалення мозку при АЛФ. Зокрема, мікрогліальну активацію та експресію прозапальних цитокінів вимірювали як функцію енцефалопатії та тяжкості набряку мозку, використовуючи добре охарактеризовану модель тварини ALF, печінкову деваскуляризовану щура (Bélanger and Butterworth 2005). У другій серії досліджень було показано, що сприятливий ефект міноцикліну, напівсинтетичного тетрацикліну, обмежує активацію мікроглії в широкому діапазоні нейродегенеративних станів (Стірлінг та ін. 2005), було досліджено. Вплив міноцикліну на прогресування енцефалопатії та набряк мозку у печінкових деваскуляризованих щурів вивчали як функцію мікрогліальної активації та експресії прозапальних цитокінів. Активування мікроглії вимірювали за допомогою вестерн-блот (OX ‐ 6) та імуногістохімії CD11b/c (OX ‐ 42).
Матеріали і методи
Деваскуляризація печінки та лікування
Дорослих самців щурів Sprague ‐ Dawley (200–250 г), придбаних у Чарльз-Рівер (Сент-Констант, Квебек, Канада), регулярно тестували на наявність загальних патогенних мікроорганізмів і не мали інфекції на початку операції. Тваринам знеболювали ізофлуран, а також проводили кінцевий портальний анастомоз відповідно до рекомендацій Lee та Fisher (1961). Коротко, щурам зробили лапаротомію, нижню порожнисту вену та ворітну вену виділили та затиснули за допомогою затискача для анастомозу (Roboz Instruments Inc, Вашингтон, округ Колумбія, США) та видалили еліптичну частину, що в 1,5 рази більше діаметра ворітної вени. Ворітну вену перев’язали та розрізали, а анастомоз з боку в бік зробили під розсікаючим мікроскопом. Загальний час операції склав Таблицю 1. Вплив міноцикліну на прогресування енцефалопатії
| Час до втрати правильних рефлексів (год) | 9,73 ± 0,23 | 13,09 ± 0,47 * |
| Час до втрати рогівкових рефлексів (год) | 12,97 ± 0,36 | 15,84 ± 0,39 * |
- Час до втрати правильних рефлексів та втрати рогівкових рефлексів у щурів з АЛФ, які отримували міноциклін (ALF-mino), порівняно з контролем ALF, обробленим фізіологічним розчином (ALF-фізіологічний розчин), виражене в годинах (год). Дані представляють середнє значення ± SEM від n = 10 тварин на групу лікування; суттєві зміни порівняно із сольовою групою ALF, позначеною *стор
Вимірювання води в мозку
Кількість води в мозку визначали методом вологої/сухої ваги. Половину мозку зважували до і після 48 год інкубації в духовці 120 ° C. Вміст води у зразках мозку виражається як відсоток вмісту води згідно з наступним рівнянням:% води = (маса вологи - маса сухого)/маса води × 100.
Ланцюгова реакція полімерази з зворотною транскрипцією в реальному часі (QRT ‐ PCR)
Видалення ліквору та імуноферментний аналіз
Вестерн-блот-аналіз
Імуногістохімія
Статистичний аналіз
Усі дані виражаються як середнє значення ± SEM, а статистичний аналіз проводився із використанням непарного студента т‐Тест (дві групові порівняння) або односторонній дисперсійний аналіз (anova) з подальшим результатом Tukey's post hoc аналіз (множинне порівняння). Ймовірність стор
Результати
Деваскуляризація печінки викликає енцефалопатію та набряк мозку
Після HAL у щурів розвинулась прогресуюча енцефалопатія, починаючи з млявості (очевидно через 6 год після HAL), прогресуючої до втрати правильних та рогівкових рефлексів та коми (табл. 1). Підроблені щури демонстрували нормальну поведінку та неврологічні рефлекси протягом усього періоду експериментів. Вміст води в мозку не суттєво відрізнявся між підробленими щурами та щурами ALF через 6 год після HAL (ALF ‐ 6 год проти підставного: 78,23 ± 0,14% проти 78,09 ± 0,07%), але був значно підвищений у щурів ALF на стадії коми. (ALF-кома проти фіктивного: 80,78 ± 0,10% проти 78,09 ± 0,07%, стор
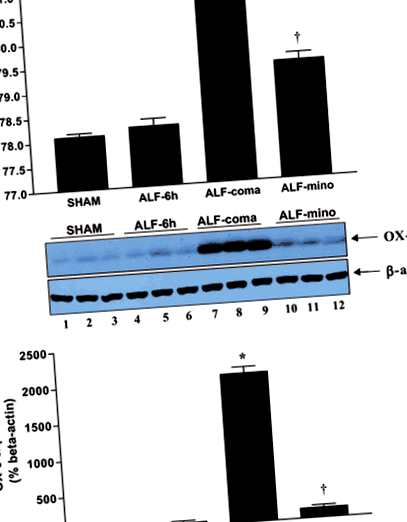
Вестерн-блот-аналіз експресії OX-6 у щурів ALF виявляє, що пригнічення активації мікроглії шляхом лікування міноцикліном корелює з послабленням набряку мозку. (a) Відсоток вмісту води в мозку в корі головного мозку від штучного контролю (підставного), щурів ALF 6 годин після HAL (ALF ‐ 6 год), щурів ALF на стадії коми в енцефалопатії (ALF-кома) та у щурів, які отримували ALF з міноцикліном (ALF ‐ mino); (b) Експресія білка OX-6 у корі головного мозку з підроблених контролів (доріжки 1–3), щурів ALF 6 год після HAL (доріжки 4–6), щурів ALF на стадії коми при енцефалопатії (доріжки 7–9) і у щурів ALF, оброблених міноцикліном (доріжки 10–12); (c) Гістограма представлення експресії OX ‐ 6 у різних групах лікування. Дані представляють середнє значення ± SEM від n = 10 тварин на групу лікування. Значні відмінності, позначені *стор anova с post hoc Тест Тукі).
Активація мікроглії відбувається на стадії коми при енцефалопатії і корелює з початком набряку мозку
Фіксовані формальдегідом плаваючі мозкові кортикальні ділянки щурів ALF, пофарбовані CD11b/c (OX ‐ 42) (рис. 2а), демонструють активацію мікроглії на коматозній стадії енцефалопатії (ALF ‐ COMA) порівняно з підробленим контролем (SHAM). Порівнянне збільшення кількості OX-42-позитивних клітин спостерігалося також у таламусі та гіпокампі (рис. 2b та табл. 2). Вестерн-блот-аналіз основного комплексу гістосумісності класу II антигену OX ‐ 6 у різні моменти часу під час прогресування АЛФ виявляє, що активація мікроглії корелює з початком набряку мозку та важкою (стадія коми) енцефалопатією (АЛФ-кома) (рис. 1b та c).
Активація мікроглії в мозку щурів з ALF внаслідок деваскуляризації печінки. Репрезентативні мікрофотографії, що демонструють вплив ALF на (a) CD11b/c (OX ‐ 42) імунореактивність у корі головного мозку підроблених контролерів (SHAM) та щурів ALF на коматозній стадії енцефлопатії (ALF-COMA) (збільшення: 200 ×) та (b) фарбування OX-42 у корі головного мозку, гіпокампі та таламусі від щурів ALF на стадії коми в енцефалопатії (збільшення: 50 ×). Зверніть увагу на загальний регіональний розподіл імунозабарвлення OX ‐ 42.
| Фіктивне управління | 28,5 ± 4,5 | 61,6 ± 4,0 | 41,0 ± 3,0 |
| ALF ‐ 6 год | 64,1 ± 3,7 * | 97,3 ± 5,7 * | 79,9 ± 4,0 * |
| АЛФ-кома | 147,3 ± 7,6 * | 163,1 ± 6,4 * | 138,8 ± 7,2 * |
| ALF ‐ міно | 44,3 ± 2,8 ** | 69,4 ± 4,4 ** | 60,4 ± 2,2 ** |
- OX-42-позитивні клітини (на × 100 оптичних полів) в областях мозку підробленого контролю, ALF-щури 6 год після HAL (ALF-6 h), ALF щури на стадії коми в енцефалопатії (ALF-кома) та у щурів ALF, які отримували міноциклін (ALF ‐ mino). Дані представляють середнє значення ± SEM 10 вимірювань на тварину (n = 6); значні відмінності, позначені *стор anova з пост-спеціальним тестом Тукі).
Лікування міноцикліном покращує неврологічний статус АЛФ щурів, запобігає набряку мозку та послаблює активацію мікроглії.
У групі ALF, обробленої фізіологічним розчином, щури поступово втрачали правильні рефлекси (стадія прекоми) через 9,7 ± 0,2 год після HAL та втрачали рефлекси рогівки (стадія коми) через 13,0 ± 0,4 год після HAL. Для порівняння, лікування міноцикліном суттєво (стор
Лікування міноцикліном послаблює регуляцію експресії IL-1β, IL-6 та TNF-α в мозку щурів ALF
Рівні білків IL-1β, IL-6 та TNF-α у лікворі були підвищені у 2,3, 3,0 та 2,1 рази відповідно (стор
Міноциклін послаблює експресію IL-1β, IL-6 та TNF-α мозку у щурів ALF. Рівні білків IL-1β, IL-6 та TNF-α визначали у лікворі ліквору контрольованих підставним контролем (підставних), щурів ALF 6 год після HAL (ALF-6 год), на стадії коми при енцефалопатії (ALF-кома). ) та щурів ALF, оброблених міноцикліном (ALF ‐ mino). Дані представляють середнє значення ± SEM від n = 10 тварин у кожній групі. Значні відмінності, позначені *стор † стор anova с post hoc Тест Тукі).
Міноциклін послаблює експресію гена IL-1β, IL-6 та гена TNF-α у щурів ALF. МРНК цитокінів визначали в корі головного мозку підставлених контрольованих (підставних), АЛФ щурів 6 год після HAL (ALF ‐ 6 год), на стадії коми енцефалопатії (ALF-кома) та щурів ALF, які отримували міноциклін (ALF ‐ mino ). Дані представляють середнє значення ± SEM від n = 10 тварин у кожній групі. Значні відмінності, позначені *стор anova с post hoc Тест Тукі).
Лікування міноцикліном підставлених контрольних тварин не мало значного впливу на неврологічний статус, вміст води в мозку або рівень цитокінів у лікворі (рис. S1).
Обговорення
Печінкова енцефалопатія при ГНЧ характеризується як когнітивними порушеннями, так і порушеннями сну, які можуть потенційно бути наслідком підвищення цитокінів мозку. Наприклад, надмірна експресія TNF-α та IL-1β у мозку призводить до поганої роботи в когнітивних завданнях (Fiore та ін. 1996) та порушення регуляції сну (Krueger та ін. 1998). Що ще важливіше в контексті ALF, попередні дослідження показують, що набряк мозку суттєво корелює з наявністю прозапальних цитокінів, таких як TNF-α та IL-1β (Allan and Rothwell 2001; Petty and Lo 2002), і тимчасовим набряком головного мозку в результаті внутрішньомозкового введення IL-1β нормальним щурам (Holmin та Mathiesen 2000).
Як і очікувалося від його протизапальних властивостей (Yrjänheikki та ін. 1999; Тікка та ін. 2001; Ван та ін. 2005), результати цього дослідження демонструють, що лікування міноцикліном зменшує активацію мікроглії та призводить до значного зниження експресії IL-1β, IL-6 та TNF-α в мозку щурів ALF. Більше того, ці ефекти міноцикліну супроводжувались значним зменшенням вмісту води в мозку, посилюючи уявлення про те, що активація мікроглії та накопичення в мозку запальних цитокінів причетні до патогенезу набряку мозку при ГНН. Ці висновки узгоджуються з попередніми повідомленнями про те, що лікування міноцикліном ефективно обмежує набряк мозку, який супроводжує внутрішньомозкові крововиливи (Wasserman and Schlichter 2007). Більше того, набряк мозку, що виникає внаслідок експериментальної гіпоксії/ішемії, значно зменшується у тварин із дефіцитом рецепторів IL-1 (Лазовіч та ін. 2005). Однак результати цього дослідження показують, що майже повна нормалізація мРНК і білка IL-1β після лікування міноцикліном призвела до значного, але неповного пригнічення набряку мозку у тварин з АЛФ, що свідчить про те, що інші цитокіни або інші патофізіологічні механізми також можуть бути причетними.
Висновки, що свідчать про підвищені цитокіни мозку, як правило, відображають збільшення їх місцевого синтезу мікрогліями або ендотеліальними клітинами цереброваскулярного кровообігу. Однак деякі цитокіни можуть транспортуватися через навколошлуночкові органи, у яких відсутній гематоенцефалічний бар'єр (Maness та ін. 1998). Крім того, також пропонується вагусний або симпатичний аферентний сигнал про цитокіни, хоча важливість цього останнього шляху ставиться під сумнів (Licinio та Wong 1997). Рівень циркуляції TNF-α та IL-1β значно підвищується при ALF (Jalan та ін. 2002) і, хоча невропатологічні дослідження не виявляють значних змін гематоенцефалічного бар'єру при АЛФ (Като та ін. 1992), можливість потрапляння цитокінів через навколошлуночкові органи залишається можливою. Альтернативні (або додаткові) механізми можуть включати накопичення в мозку аміаку та лактату при ALF. Концентрація аміаку в мозку (Swain та ін. 1992b) та лактату корелюють з тяжкістю енцефалопатії (Therrien та ін. 1991; Цвінгманн та ін. 2003) та зміни ЕЕГ (Deutz та ін. 1988) в експериментальній ALF та патофізіологічно значущих концентраціях аміаку (Атанасов та ін. 1995) та лактату (Andersson та ін. 2005) було показано, що вони спричиняють вивільнення TNF-α та IL-1β із культивованих мікрогліальних клітин.
Результати мікрогліальної активації та збільшення прозапальних цитокінів мозку можуть мати важливі наслідки для поточної та майбутньої терапії АЛФ. Альбуміновий діаліз покращує неврологічний статус у хворих на АЛФ та видаляє циркулюючі цитокіни (Di Campli та ін. 2005) та легке переохолодження, як показано, що знижує внутрішньочерепний тиск у хворих на АЛФ (Jalan та ін. 1999) нещодавно було показано зниження концентрації TNF-α та IL-1β у мозку в експериментальній ALF (Jiang та ін. 2005). Доведено, що міноциклін є ефективним при лікуванні розсіяного склерозу в клінічних випробуваннях (Metz та ін. 2004). Однак тривале використання міноцикліну може призвести до пошкодження печінки (Лоуренсон та ін. 2000), властивість, яка може обмежити його використання при ALF. Експериментальні терапевтичні дослідження з іншими протизапальними засобами, здатними обмежувати мікрогліальну активацію та вироблення мозку прозапальних цитокінів при АЛФ, є виправданими.
Подяка
Це дослідження було підтримане грантом Канадських інститутів досліджень охорони здоров’я. WJ отримує стипендію на дослідження від Канадської асоціації з вивчення печінки.
Рисунок S1. Вплив міноцикліну на вміст води в мозку та прозапальні цитокіни в лікворі ліквідних контролерів.
Зверніть увагу: Wiley ‐ Blackwell не несе відповідальності за зміст або функціональність допоміжних матеріалів, наданих авторами. Будь-які запити (крім відсутніх матеріалів) слід направляти до відповідного автора статті.
| JNC_5981_sm_Fig S1.ppt37 КБ | Підтримуючий інформаційний пункт |
Зверніть увагу: Видавець не несе відповідальності за зміст або функціональність будь-якої допоміжної інформації, наданої авторами. Будь-які запити (крім відсутнього вмісту) слід направляти до відповідного автора статті.
- Базедоксифен захищає церебральну ауторегуляцію після черепно-мозкової травми та послаблює
- Гостра тенторна субдуральна гематома, спричинена розривом задньої мозкової артерії після неповнолітньої
- Вправа на рак мозку; Щоденник дієтичного щоденника про їжу та втрату ваги (6x9), 3-місячне відстеження їжі
- Мозкова організація мови після раннього одностороннього ураження ПЕТ дослідження - ScienceDirect
- Втрата ваги мозком Девід Заппасоді - оздоровча сила