Біоактивні пептиди
Біоактивні пептиди, як правило, становлять 3–20 амінокислотних залишків у довжину, і, хоча відомо, що як тваринні, так і рослинні білки містять потенційні біоактивні послідовності, більшість досліджень на сьогоднішній день включали білки молока.
Пов’язані терміни:
- Бета-казеїн
- Йогурт
- Кисломолочне
- Поживна цінність
- Функціональне харчування
- Кефір
- Лактоферин
- Казеїн
- Молочний білок
Завантажити у форматі PDF
Про цю сторінку
Том 2
Летиція Мора,. Фідель Толдра, в Енциклопедії харчової хімії, 2019
Вступ
Біоактивні пептиди отримують з харчових білків і надають позитивний ефект на людину завдяки своїм властивостям, що зміцнюють здоров’я. Біоактивні пептиди можуть надавати декілька сприятливих ефектів, таких як запобігання захворюванням або модуляція фізіологічних систем, коли вони всмоктуються в організмі людини. Існує широкий діапазон функцій, залежно від послідовності біоактивних пептидів, так що вони можуть брати участь у роботі шлунково-кишкової системи, такі як пептиди проти ожиріння та ситості, серцево-судинна система, така як антигіпертензивні, антитромботичні, антиоксидантні та гіпохолестеринемічні пептиди, імунна система, така як антимікробні, цитомодулюючі та імуномодулюючі пептиди, та нервова система, така як опіоїдні пептиди.
Біоактивні пептиди зазвичай містять від 3 до 20 амінокислотних залишків і залишаються неактивними, поки послідовності містяться в материнському білку. Вони активні після вивільнення ферментативним гідролізом пептидазами під час переробки їжі та/або під час шлунково-кишкового травлення. Для позитивного впливу на здоров’я біоактивні пептиди повинні проходити шлунково-кишковий бар’єр та переживати деградацію ферментів.
За останні роки про численні біоактивні пептиди повідомляється, що вони є природним чином або утворюються з харчових білків різного походження, таких як молоко, яйця, соя, риба та м’ясо. У цьому сенсі найбільш ретельно вивченою біоактивністю протягом останнього десятиліття була антигіпертензивна активність шляхом вимірювання інгібуючої активності ангіотензин-перетворюючого ферменту (АПФ). Причина цього інтересу полягає головним чином у тому, що високий кров'яний тиск є одним з основних незалежних факторів ризику серцево-судинних захворювань та основною причиною смерті в розвинених країнах. Пептиди з цим типом активності загалом називаються біоактивними пептидами, хоча інші дії, такі як антиоксидант, антимікробна, опіоїдна, антитромботична, протидіабетична тощо ... також вписуються в загальний термін біоактивний пептид.
Біоактивні пептиди
12.4 Вплив термічної обробки на активність біоактивних пептидів
Біоактивні пептиди, що утворюються природним шляхом під час переробки харчових продуктів, можуть потрапляти безпосередньо у сировину або після термічної обробки (пастеризація, стерилізація, варіння тощо). Коли застосовується така термічна обробка, вона може впливати на сам пептид або його біоактивність, що обумовлює необхідність вивчення стабільності біоактивних пептидів у типових умовах термічної обробки. Помірні термічні процедури (60–80 ° C) індукують розгортання білків і можуть покращити доступність ендопептидаз (Bax et al., 2012; Soladoye, Juárez, Aalhus, Shand, & Estévez, 2015). Коли термічна обробка більш інтенсивна (> 100 ° C), білки менш доступні для пептидаз, оскільки вони зазнають незворотного розгортання, агрегації, дисульфідних взаємозв’язків, фрагментації білка та хімічних модифікацій (Davis & Williams, 1998; Soladoye et al., 2015).
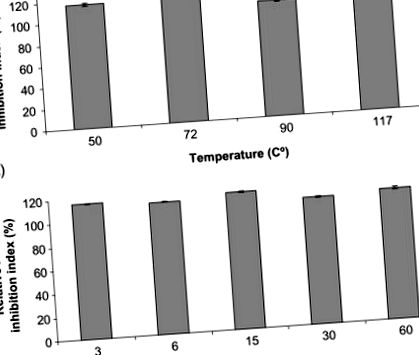
Нещодавно була досліджена стабільність біоактивних пептидних екстрактів проти різних термічних обробок. У дослідженні пептиди з високою активністю, що інгібують АПФ, були виділені з іспанської сушеної шинки та піддані різним термічним обробкам, досить звичним для харчової промисловості (Escudero, Mora, & Toldrá, 2014). Автори досліджували вплив нагрівання протягом певного часу (50 ° C, 72 ° C, 90 ° C та 117 ° C протягом 6 хв) та часу для даної температури (3, 6, 15, 30 та 60 хв при 117 ° С). Як показано на рис. 12.3, досліджувані біоактивні пептиди залишалися активними у всіх випадках, що свідчить про хорошу стійкість проти нагрівання.
Рис. 12.3. Стійкість іспанських сухих отверджених шинкою інгібуючих АПФ пептидів після: (A) 6 хв інкубації при різних температурах та (B) 117 ° C інкубації в різний час.
Відтворено від Escudero, E., Mora, L., & Toldrá, F. (2014) Стабільність пептидів інгібуючої АПФ шинки проти термічної обробки та перетравлення in vitro. Харчова хімія 161, 305–311 з дозволу Elsevier.
Інші дослідження показали подібні висновки, такі як пептиди, що інгібують АПФ, із соку для варіння тунця, які залишалися стабільними в широкому діапазоні температур (20-100 ° C протягом 2 год), не змінюючи складу внаслідок обробок (Hwang, 2010), а також сої білок після обробок при 20 ° C, 40 ° C, 60 ° C, 80 ° C і 100 ° C протягом 2 годин (Wu & Ding, 2002). Досліджували відварювання та смаження яєць (у вигляді білків, жовтків та цілих яєць) з подальшим моделюванням шлунково-кишкового травлення. Смажені яєчні дайджести мали вищу інгібуючу активність АПФ, і повідомлялося про сім пептидів, переважно трипептидів (Majumder & Wu, 2009).
Вплив пастеризації вивчали у дозрілому овечому сирі (Pisanu et al., 2015). Пастеризація сиру призвела до певних змін у ідентичності та кількості пептидів. Протеоліз мав нижчу інтенсивність у пастеризованих молочних сирах, зберігаючи кращу однорідність. Вплив молока на тепло може вплинути на доступність білків до ферментативного розщеплення, зменшуючи його сприйнятливість до протеолізу. Це навіть може бути збільшено за рахунок інактивації теплом або корінних бактерій, або протеолітичних ферментів. Насправді катепсин D досить чутливий до пастеризації, залишаючись лише близько 8% активності (Hayes et al., 2001). Зазначена біоактивність також була вищою у сирів, виготовлених із сирого молока.
Приготування зістареного м’яса яловичини (при 70 ° C протягом 45 хв.) Мало впливало на пептидний профіль (Mora et al., 2017). Однак перетравлювання приготовленого м'яса in vitro призвело до збільшення АПФ-інгібуючої та антиоксидантної активності. Це може бути пов’язано з вивільненням менших біоактивних пептидів шлунково-кишковими ферментами. (Мора та ін., 2017). Однак змодельоване шлунково-кишкове травлення in vitro вареної курячої грудки, нагрітої при 70 ° C протягом 0,5 год, виявляло вищу активність інгібуючого АПФ, ніж більш інтенсивна термічна обробка, як 121 ° C протягом 1 години (Sangsawad, Roytrakul, & Yongsawatdigul, 2017).
Як повідомляється, антиоксидантні пептиди кальмарів мають сильну термостійкість, зберігаючи> 94% активності при нагріванні до 100 ° C. Така активність зберігалася в кислих умовах, але була втрачена при підвищенні рН (Hu et al., 2017). Повідомлялося, що пептид SNAAC має хорошу стабільність після нагрівання при різних температурах (50 ° C, 72 ° C та 90 ° C) протягом 10 хв та у присутності до 8% NaCl, але його антиоксидантна активність сильно знижується, коли піддається впливу 100 ° C порівняно з контролем при 37 ° C (Gallego, Mora, Reig, & Toldrá, 2018).
Кулінарія впливає на вміст карнозину та асерину, які є гістидилдипептидами з антиоксидантною активністю та буферною дією (Jayasena et al., 2015). Про такі втрати повідомляють кулінарні соки, оскільки карнозин та ансерин досить розчинні (Peiretti et al., 2011; Purchas, Rutherfurd, Pearce, Vather, & Wilkinson, 2004). Винятком є приготування в мікрохвильовій печі, оскільки вміст гістидилдипептиду залишався досить високим (Peiretti et al., 2011). Розчинні сполуки, такі як біоактивні пептиди та амінокислоти, втрачаються в кулінарному соку креветок та устриць (Cambero et al., 1998; Kim et al., 2000).
Нутрицевтичні властивості молочних біоактивних пептидів
Висновок
Біоактивні пептиди викликали великий науковий інтерес завдяки своїм цілеспрямованим біофункціональним властивостям. Сучасна література показала біоактивні пептиди, отримані з білків бичачого молока, що їх поживні універсальні багатофункціональні властивості, добре встановлені різними методами, володіють неабиякою біологічною активністю та зміцнюють здоров’я властивостями. Загалом, здається, що біоактивні пептиди, отримані з молочного білка, можуть бути використані як перорально ефективний здоровий компонент і потенційно можуть бути використані у виробництві функціональних продуктів харчування, що мають зміцнювальні для здоров'я властивості. Однак, здається, слід провести подальші дослідження в цій галузі для оцінки ефектів, що сприяють здоров'ю, in vivo та біодоступності біоактивних пептидів, що походять від молочного білка, у людей та для з'ясування їх молекулярних механізмів дії.
Фортифікація в напоях
3.6.3 Укріплення біоактивних пептидів
Біоактивні пептиди можуть бути отримані в результаті протеолізу різних білків ферментами, а також виробляються під час кишкового перетравлення поживних речовин, працюючи як перспективний фізіологічний регулятор метаболізму. Останнім часом велика увага приділяється вивченню біоактивної ролі біоактивних пептидів як антиоксидантного, гіпотензивного, гіпохолестеринемічного, протизапального та імуномодулюючого ефектів (Umayaparvathi et al., 2014; Hernández-Ledesma et al., 2014). Деякі харчові білки, головним чином молочні казеїни, можуть діяти як попередник біоактивних пептидів із різними фізіологічними перевагами (Özer та Kirmaci, 2010). Прикладом комерційного напою з додаванням біоактивних пептидів є Evolus від Valio Ltd. (Фінляндія). Біологічно активні пептиди, синтезовані L. helveticus з молочного казеїну, надають на нього основну сприятливу дію і можуть додаватися до напоїв (Prado et al., 2008).
Біоактивні пептиди у ферментованих продуктах
Анотація
Біоактивні пептиди - це фрагменти білка з низькою молекулярною масою із залишків 2–20 амінокислот, які виявляють сприятливі фізіологічні ефекти in vivo. Вироблення біоактивних пептидів під час виробництва ферментованих продуктів харчування добре задокументовано. Ці пептиди вивільняються з білків-попередників під час процесів бродіння або дозрівання ендогенними або мікробними ферментами, отриманими з початкових або незірних культур. Виробництво біоактивних пептидів у ферментованих харчових продуктах представляє великий інтерес, оскільки вони демонструють кілька цікавих біоактивностей, пов’язаних із зміцненням здоров’я, таких як гіпотензивна, опіоїдна, антиоксидантна, імуномодулююча, муциностимулююча, інсуліноміметична та антиостеопоротична. Підвищення виходу біоактивних пептидів у ферментованих продуктах харчування може бути досягнуто за допомогою декількох підходів, включаючи відбір високопротеолітичних мікроорганізмів, відповідне поєднання спільних культур, оптимізацію умов обробки та додавання компонентів середовища. У цій главі розглядаються останні дослідження, що підтверджують потенційну користь біоактивних пептидів для здоров’я у ферментованих продуктах для серцево-судинної, нервової, шлунково-кишкової та імунної систем, а також на кістках та жировій тканині.
Морська лікувальна їжа
Вступ
Фітохімічні властивості, що сприяють здоров’ю, сорго та пшоно
Kwaku G. Duodu, Joseph M. Awika, in Sorghum and Millets (Second Edition), 2019
5 Хімія біоактивних пептидів у сорго та пшоні
Морська лікувальна їжа
II Розробка антигіпертензивних пептидів, отриманих з морської риби
Морська переробка білкових побічних продуктів: джерело біофункціональних харчових інгредієнтів
А.С.Невес,. Р.Дж. FitzGerald, у Білкові побічні продукти, 2016
4 Біодоступність
BAP можуть виділятися з харчових білків під час шлунково-кишкового травлення та ферментації, ферментативного гідролізу та під час обробки їжі. Дослідницькі зусилля у галузі BAP зросли за останні кілька років. Кілька досліджень повідомляють, що риба та молюски мають потенціал як джерело BAP для виробництва біофункціональної їжі (Harnedy & FitzGerald 2013a). Однак необхідно провести більше досліджень, щоб визначити, чи підтримують BAP з джерел риби та молюсків (таблиці 4.1 та 4.2) свою діяльність, коли вони піддаються різним технологіям обробки харчових продуктів.
Однак існує кілька стратегій, які можна використовувати для поліпшення біодоступності морських BAP. Серед них модифікація N- і С-терміналів; структурна модифікація, включаючи алкілування та глікозилювання; також показано, що інкапсуляція покращує біодоступність пептидів. Більше того, пептиди, що містять високий відсоток амінокислот Pro та Hyp, здаються більш стійкими до гідролізу шлунково-кишковими ферментами (FitzGerald and Meisel, 2000). Деякі з цих підходів вже використовувались для поліпшення біодоступності BAP з риби та молюсків. Наприклад, було показано, що інкапсуляція пептидів тунця в ліпосоми є ефективною для збереження їхньої гіпотензивної здатності у спонтанно гіпертонічних щурів (Hwang et al., 2010).
- Бігуаніди - огляд тем ScienceDirect
- Похідна бігуаніду - огляд тем ScienceDirect
- Штучні дієти - огляд тем ScienceDirect
- Постійна асоціація - огляд тем ScienceDirect
- CD-1 Mouse - огляд тем ScienceDirect