Постійна асоціація
Пов’язані терміни:
- Антиген
- Антитіла
- Білок
- рН
- Постійна дисоціації
- Вуглекислий газ
- Ліганд
Завантажити у форматі PDF
Про цю сторінку
Загальні принципи ендокринології
Крива титрування
Наведений вище аналіз Скатчарда використовував константу асоціації, K, як один із дескрипторів реакції зв'язування. Як зазначалось вище, константа асоціації має одиниці виміру M −1. Константа дисоціації, Kd, є оберненою до константи асоціації з одиницями М. Для випадку єдиного набору невзаємодіючих сайтів з однаковим K запишемо:
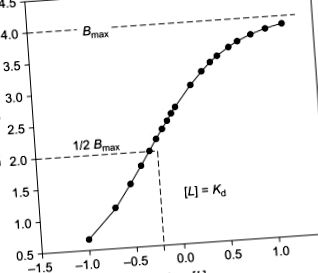
крива титрування є графіком B проти log [L]. Це аналогічно лужному титруванню кислоти, при якому кількість доданого сильного лугу (NaOH) відкладається в залежності від рН. Крива має S-подібну форму. Його максимальний нахил виникає, коли [L] = Kd. Щоб побачити це, ми диференціюємо рівняння (9.1.A1.17) щодо log [L]:
де ν - частка насичення, визначена рівнянням (9.1.A1.7), діапазон якого обмежений значеннями від 0 до 1,0. З цього відношення видно нахил кривої титрування, який дорівнює нулю, коли ν = 0 і коли ν = 1,0, і має максимум, коли ν = 0,5. Максимальний нахил відбувається в точці перегину в S-подібній кривій. Точку перегину при ν = 0,5 можна отримати, встановивши другу похідну B проти log [L] рівною нулю. Коли ν = 0,5, з визначення ν, [L] = 1/K = Kd; це точка, в якій концентрація вільного ліганду дорівнює константі дисоціації для сайтів. Приклад кривої титрування наведено на малюнку 9.1.A1.2 .
Малюнок 9.1.A1.2. Крива прив'язки титрування з Bmax = 4 і Kd = 0,5.
Корисність кривої титрування полягає в тому, що вона дозволяє представити всі дані зв'язування в одному графіку, і це візуально дозволяє судити про важливий момент: чи включають дані зв'язування значення B як вище, так і нижче 0,5 Bmax? Це важливий контроль якості при визначенні, чи відповідають дані прив'язки завданням характеристики Kd та Bmax. Якщо точка перегину не визначена чітко, як можна на кривій титрування передбачити, де зв'язування вирівняється до Bmax? І Kd, і Bmax найкраще визначати, коли є дані B, [L], взяті вище і нижче ν = 0,5. (Див. І. М. Клоц, Кількість рецепторних місць на графіках Скечарда: факти та фантазії. Наука 217: 1247–1249, 1982).
Що таке фармакологія?
1.13 Похідні: конформаційний відбір як механізм ефективності
Розглянемо систему, що містить дві конформації рецепторів Ri та Ra, які співіснують у системі згідно з алостеричною константою, позначеною L:
Припустимо, що ліганд A пов'язується з Ri константою рівноваги асоціації K a, а Ra константою рівноваги асоціації αKa. Коефіцієнт α позначає диференціальну спорідненість агоніста до Ra (тобто α = 10 позначає 10-кратну більшу спорідненість ліганду до стану Ra). Вплив α на здатність ліганду змінювати рівновагу між Ri та Ra можна обчислити, досліджуючи кількість видів Ra (як Ra, так і ARa), присутніх у системі за відсутності ліганду та у присутності ліганду . Вираз рівноваги для ([Ra] + [ARa])/[Rtot], де [Rtot] - загальна концентрація рецептора, задана рівнянням збереження [Rtot] = [Ri] + [ARi] + [Ra] + [ARa ], є
де L - алостерична константа, [A] - концентрація ліганду, KA - константа рівноваги дисоціації комплексу агоніст – рецептор (KA = 1/Ka), α - диференціальна спорідненість ліганду до стану Ra. Видно, що за відсутності агоніста ([A] = 0), ρ0 = L/(1 + L) та при наявності максимальної концентрації ліганду (насичуючи рецептори; [A] → ∞), ρ∞ = (α (1 + L))/(1 + αL). Вплив ліганду на зміну частки стану Ra визначається відношенням ρ/ρ0. Цей коефіцієнт задано формулою
Рівняння (1.9) вказує на те, що якщо ліганд має однакову спорідненість до станів Ri та Ra (α = 1), то ρ∞/ρ0 буде дорівнювати одиниці, і ніякої зміни частки Ra не буде результатом максимального зв'язування ліганду. Однак, якщо α> 1, то наявність конформаційно-селективного ліганду призведе до того, що співвідношення ρ∞/ρ0 буде> 1, а стан Ra збагатиться наявністю ліганду.
Метагеномічне розуміння мікробіому людини
Асоційована людиною мікрофлора
Рисунок 9.2. Складна взаємодія мікробіому кишечника людини та геному людини у здоров’ї людини.
- Бігуаніди - огляд тем ScienceDirect
- Похідна бігуаніду - огляд тем ScienceDirect
- Штучні дієти - огляд тем ScienceDirect
- Біоактивні пептиди - огляд тем ScienceDirect
- CD-1 Mouse - огляд тем ScienceDirect