Перехресні розмови між Bcr-abl та тіоредоксинною системою при хронічному мієлоїдному лейкозі: наслідки для лікування ХМЛ
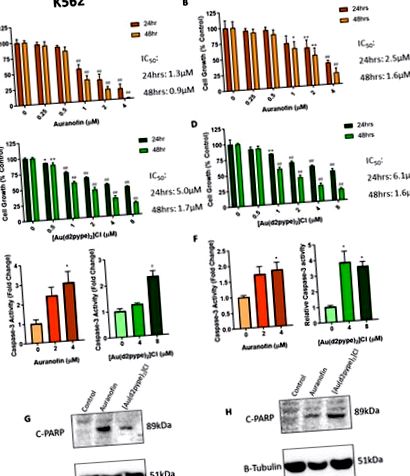
Інгібітори TrxR зменшують ріст клітин та викликають апоптоз у клітинах ХМЛ. A-D: Клітини K562 та KU812 обробляли ауранофіном (A, B) та [Au (d2pype) 2] Cl (C, D) відповідно протягом 24 та 48 годин. Потім клітинний ріст вимірювали за допомогою аналізу проліферації МТТ. E, F: K562 та KU812 відповідно обробляли ауранофіном або [Au (d2pype) 2] Cl протягом 24 год, потім вимірювали активність каспази-3, використовуючи флуорогенний аналіз на основі Ac-DEVD-AMC. G, H: Обидві клітинні лінії обробляли 4 мкМ або Auranofin, або [Au (d2pype) 2] Cl протягом 24 годин. Вестерн-блотинг проводили з використанням антитіла, специфічного до розщепленого 89kDa PARP-1 (C-PARP). Β-Тубулін використовували як контроль навантаження. Результати МТТ аналізували за допомогою двосторонньої ANOVA за допомогою спеціального тесту Даннета. Активність каспази-3 аналізували за допомогою множинних Т-тестів. Статистичні тести порівнювали дані з оброблених та необроблених клітин. * = p p p p N = 3. Значення відображаються як середнє значення ± SEM.
Інгібітори TrxR знижують активність TrxR та індукують більш високі рівні АФК. A, B: Клітини ХМЛ K562 та KU812 відповідно обробляли або ауранофіном, або [Au (d2pype) 2] Cl протягом 24 годин. Потім активність TrxR вимірювали за допомогою колориметричного аналізу на основі DTNB, і активність визначали щодо загального білка. Клітини C, D: K562 та KU812 CML відповідно обробляли або ауранофіном, або [Au (d2pype) 2] Cl протягом 24 годин. Потім рівні АФК вимірювали за допомогою флуорогенного аналізу H2DCFDA. Результати були зроблені щодо загальної кількості клітин. E - H: Обидві клітинні лінії обробляли ауранофіном або [Au (d2pype) 2] Cl та з BSO або без нього протягом 24 годин, після цього проводили аналіз проліферації МТТ. Результати аналізували за допомогою множинних Т-тестів. На фігурах A - D статистичні тести порівнювали результати необроблених та оброблених клітин. На рисунках E – H статистичні тести порівнювали клітини, оброблені з BSO або без. * = p p p p N = 3. Значення відображаються як середнє значення ± SEM.
Інгібітори TrxR зменшують експресію мРНК та білка шляху Bcr-abl. A, B: Клітини ХМЛ K562 та KU812 обробляли відповідно 4 мкМ або ауранофіну, або [Au (d2pype) 2] Cl протягом 24 годин. Потім RT-qPCR використовували для вимірювання рівнів експресії мРНК bcr-abl та MYC. RPL32 використовували як нормалізатор C, D: клітини CML K562 та KU812 обробляли відповідно 4 мкМ або ауранофіну, або [Au (d2pype) 2] Cl протягом 24 годин. Потім вестерн-блот використовували для вимірювання рівня білка bcr-abl та MYC. E, F: Клітини ХМЛ K562 та KU812 обробляли відповідно 4 мкМ ауранофіну або 8 мкМ [Au (d2pype) 2] Cl у клітинах K562 та 4 мкМ інгібіторів у клітинах KU812 протягом 24 год. Потім вестерн-блот використовували для вимірювання рівнів p-AKT1 та AKT1. Вінкулін та Β-тубулін використовувались як засоби контролю завантаження вестерн-блот. Результати RT-qPCR аналізували за допомогою численних Т-тестів. Статистичні тести порівнювали результати оброблених та необроблених клітин. * = p p p p N = 3. Значення відображаються як середнє значення ± SEM.
Нокдаун TrxR1 зменшує мРНК Bcr-abl та c-myc та експресію білка. Клітини K562 трансфікували за допомогою TrxR1 специфічної siРНК та контрольованого сиРНК. В: Потім вимірювали життєздатність клітин через 24 год. B: RT-qPCR проводили через 24 години після трансфекції для вимірювання рівнів експресії мРНК TrxR1, bcr-abl та MYC. RPL32 використовували як нормалізатор С: вестерн-блоттінг проводили через 48 год після трансфекції і використовували для вимірювання рівня білка TrxR1, bcr-abl та MYC. Tub-тубулін використовували як контроль навантаження вестерн-блот. Показаний представник 3 ляп. Результати RT-qPCR та життєздатності клітин аналізували за допомогою численних T-тестів. Статистичні тести порівнювали результати збитих клітин TrxR1 та контрольованого скрембованого siRNA. * = p p p N = 3. Значення відображаються як середнє значення ± SEM.
Резистентні до іматинібу клітини ХМЛ мають регульовану мРНК та експресію білка системи Trx. A, B: Рівні експресії мРНК Nrf2, Trx1, TrxR1 та TXNIP вимірювали за допомогою RT-qPCR у чутливих та стійких клітинах КМЛ K562 та KU812 відповідно, при цьому чутливі клітини використовувались як контроль. RPL32 використовували як нормалізатор. C, D: Рівні білка Trx1 вимірювали у чутливих та стійких клітинах КМЛ K562 та KU812 відповідно. В-тубулін використовували як контроль навантаження. E, F: Аналіз бази даних рівня експресії мРНК Trx1 та TXNIP відповідно порівнювали із зразками пацієнтів із ХМЛ, які продемонстрували відповідь на іматиніб та тих, хто цього не зробив (GSE2535). Результати RT-qPCR аналізували за допомогою двосторонніх ANOVA за допомогою пост-хост-тесту Даннета. Результати аналізу бази даних аналізували за допомогою непарного Т-тесту. Статистичні тести порівнювали результати між чутливими та стійкими клітинними лініями. * = p p p p N = 3 для RT-qPCR та вестерн-блот, N = 16 для біоінформатики. Значення відображаються як середнє значення ± SEM.
Резистентні до іматинібу клітини ХМЛ сприйнятливі до інгібіторів TrxR. A - F: Чутливі та стійкі клітини K562 та KU812 обробляли або іматинібом (A, B), ауранофіном (C, D) або [Au (d2pype) 2] Cl (E, F) протягом 48 годин. Після всіх цих часів лікування проводили аналізи проліферації МТТ. G, H: Аналізи активності каспази-3 проводили на чутливих та стійких клітинах K562 та KU812 після 24 год обробки іматинібом, ауранофіном або [Au (d2pype) 2] Cl. I, J: Аналізи активності TrxR проводили на чутливих та стійких клітинах K562 та KU812 після 24 год обробки або ауранофіном, або [Au (d2pype) 2] Cl. Результати аналізували за допомогою двосторонньої ANOVA за допомогою спеціального тесту Даннета. Статистичні тести порівнювали результати між чутливими та стійкими клітинними лініями. * = p p p p N = 3. Значення відображаються як середнє значення ± SEM.
Анотація
Інгібітори TrxR зменшують ріст клітин та викликають апоптоз у клітинах ХМЛ. A-D: Клітини K562 та KU812 обробляли ауранофіном (A, B) та [Au (d2pype) 2] Cl (C, D) відповідно протягом 24 та 48 годин. Потім клітинний ріст вимірювали за допомогою аналізу проліферації МТТ. E, F: K562 та KU812 відповідно обробляли ауранофіном або [Au (d2pype) 2] Cl протягом 24 год, потім вимірювали активність каспази-3, використовуючи флуорогенний аналіз на основі Ac-DEVD-AMC. G, H: Обидві клітинні лінії обробляли 4 мкМ або Auranofin, або [Au (d2pype) 2] Cl протягом 24 годин. Вестерн-блотинг проводили з використанням антитіла, специфічного до розщепленого 89kDa PARP-1 (C-PARP). Β-Тубулін використовували як контроль навантаження. Результати МТТ аналізували за допомогою двосторонньої ANOVA за допомогою спеціального тесту Даннета. Активність каспази-3 аналізували за допомогою множинних Т-тестів. Статистичні тести порівнювали дані з оброблених та необроблених клітин. * = p p p p N = 3. Значення відображаються як середнє значення ± SEM.
Інгібітори TrxR знижують активність TrxR та індукують більш високі рівні АФК. A, B: Клітини ХМЛ K562 та KU812 відповідно обробляли або ауранофіном, або [Au (d2pype) 2] Cl протягом 24 годин. Потім активність TrxR вимірювали за допомогою колориметричного аналізу на основі DTNB, і активність визначали щодо загального білка. Клітини C, D: K562 та KU812 CML відповідно обробляли або ауранофіном, або [Au (d2pype) 2] Cl протягом 24 годин. Потім рівні АФК вимірювали за допомогою флуорогенного аналізу H2DCFDA. Результати були зроблені щодо загальної кількості клітин. E - H: Обидві клітинні лінії обробляли ауранофіном або [Au (d2pype) 2] Cl та з BSO або без нього протягом 24 годин, після цього проводили аналіз проліферації МТТ. Результати аналізували за допомогою множинних Т-тестів. На фігурах A - D статистичні тести порівнювали результати необроблених та оброблених клітин. На рисунках E – H статистичні тести порівнювали клітини, оброблені з BSO або без нього. * = p p p p N = 3. Значення відображаються як середнє значення ± SEM.
Інгібітори TrxR зменшують експресію мРНК та білка шляху Bcr-abl. A, B: Клітини ХМЛ K562 та KU812 обробляли відповідно 4 мкМ або ауранофіну, або [Au (d2pype) 2] Cl протягом 24 годин. Потім RT-qPCR використовували для вимірювання рівнів експресії мРНК bcr-abl та MYC. RPL32 використовували як нормалізатор C, D: клітини CML K562 та KU812 обробляли відповідно 4 мкМ або ауранофіну, або [Au (d2pype) 2] Cl протягом 24 годин. Потім вестерн-блот використовували для вимірювання рівня білка bcr-abl та MYC. E, F: Клітини ХМЛ K562 та KU812 обробляли відповідно 4 мкМ ауранофіну або 8 мкМ [Au (d2pype) 2] Cl у клітинах K562 та 4 мкМ інгібіторів у клітинах KU812 протягом 24 год. Потім вестерн-блот використовували для вимірювання рівнів p-AKT1 та AKT1. Вінкулін та Β-тубулін використовувались як засоби контролю завантаження вестерн-блот. Результати RT-qPCR аналізували за допомогою численних Т-тестів. Статистичні тести порівнювали результати оброблених та необроблених клітин. * = p p p p N = 3. Значення відображаються як середнє значення ± SEM.
Нокдаун TrxR1 зменшує мРНК Bcr-abl та c-myc та експресію білка. Клітини K562 трансфікували за допомогою TrxR1 специфічної siРНК та контрольованого сиРНК. В: Потім вимірювали життєздатність клітин через 24 год. B: RT-qPCR проводили через 24 години після трансфекції для вимірювання рівнів експресії мРНК TrxR1, bcr-abl та MYC. RPL32 використовували як нормалізатор С: вестерн-блоттінг проводили через 48 год після трансфекції і використовували для вимірювання рівня білка TrxR1, bcr-abl та MYC. Tub-тубулін використовували як контроль навантаження вестерн-блот. Показаний представник 3 ляп. Результати RT-qPCR та життєздатності клітин аналізували за допомогою численних T-тестів. Статистичні тести порівнювали результати збитих клітин TrxR1 та контрольованого скрембованого siRNA. * = p p p N = 3. Значення відображаються як середнє значення ± SEM.
Резистентні до іматинібу клітини ХМЛ мають регульовану мРНК та експресію білка системи Trx. A, B: Рівні експресії мРНК Nrf2, Trx1, TrxR1 та TXNIP вимірювали за допомогою RT-qPCR у чутливих та стійких клітинах КМЛ K562 та KU812 відповідно, при цьому чутливі клітини використовувались як контроль. RPL32 використовували як нормалізатор. C, D: Рівні білка Trx1 вимірювали у чутливих та стійких клітинах КМЛ K562 та KU812 відповідно. В-тубулін використовували як контроль навантаження. E, F: Аналіз бази даних рівня експресії мРНК Trx1 та TXNIP відповідно порівнювали із зразками пацієнтів із ХМЛ, які продемонстрували відповідь на іматиніб та тих, хто цього не зробив (GSE2535). Результати RT-qPCR аналізували за допомогою двосторонніх ANOVA за допомогою пост-хост-тесту Даннета. Результати аналізу бази даних аналізували за допомогою непарного Т-тесту. Статистичні тести порівнювали результати між чутливими та стійкими клітинними лініями. * = p p p p N = 3 для RT-qPCR та вестерн-блот, N = 16 для біоінформатики. Значення відображаються як середнє значення ± SEM.
Резистентні до іматинібу клітини ХМЛ сприйнятливі до інгібіторів TrxR. A - F: Чутливі та стійкі клітини K562 та KU812 обробляли або іматинібом (A, B), ауранофіном (C, D) або [Au (d2pype) 2] Cl (E, F) протягом 48 годин. Після всіх цих часів лікування проводили аналізи проліферації МТТ. G, H: Аналізи активності каспази-3 проводили на чутливих та стійких клітинах K562 та KU812 після 24 год обробки іматинібом, ауранофіном або [Au (d2pype) 2] Cl. I, J: Аналізи активності TrxR проводили на чутливих та стійких клітинах K562 та KU812 після 24 год обробки або ауранофіном, або [Au (d2pype) 2] Cl. Результати аналізували за допомогою двосторонньої ANOVA за допомогою спеціального тесту Даннета. Статистичні тести порівнювали результати між чутливими та стійкими клітинними лініями. * = p p p p N = 3. Значення відображаються як середнє значення ± SEM.
- Поліпшення якості повнотекстової дині з агрономією (дикі сітки) (Cucumis melo L
- Безкоштовні повнотекстові арономічні воскові генетичні ортологи в пшениці × тинопірум амфідиплоїди HTML
- Напої Безкоштовний повнотекстовий вплив крутого часу на вміст поліфенолу та антиоксидантну здатність
- Прикладні науки Безкоштовне повнотекстове порівняння фізико-хімічних, функціональних та харчових
- Агрономія Безкоштовний повнотекстовий насіння олії Біохімічний склад культивованого Cucurbita L