Бактеріальні ферменти та стійкість до антибіотиків
А. М. Єгоров
Хімічний факультет, М.В. Московський державний університет імені Ломоносова, Ленінські гори, 1, корп. 3, Москва, 119991, Росія
М. М. Уляшова
Хімічний факультет, М.В. Московський державний університет імені Ломоносова, Ленінські гори, 1, корп. 3, Москва, 119991, Росія
М. Ю. Рубцова
Хімічний факультет, М.В. Московський державний університет імені Ломоносова, Ленінські гори, 1, корп. 3, Москва, 119991, Росія
Анотація
Стійкість мікроорганізмів до антибіотиків розвивається більше 2 мільярдів років і широко поширюється серед різних представників мікробіологічного світу. Бактеріальні ферменти відіграють ключову роль у виникненні резистентності. Класифікація цих ферментів базується на їх участі в різних біохімічних механізмах: модифікація ферментів, які діють як антибіотичні мішені, ферментативна модифікація внутрішньоклітинних мішеней, ферментативна трансформація антибіотиків та здійснення реакцій клітинного метаболізму. Основні механізми розвитку резистентності пов'язані з еволюцією надродин бактеріальних ферментів внаслідок мінливості генів, що їх кодують. Колекція всіх генів стійкості до антибіотиків відома як резистом. Десятки тисяч ферментів та їх мутантів, що реалізують різні механізми резистентності, утворюють нову спільноту, яка називається "ферментом". Аналіз структури та функціональних характеристик ферментів, які є мішенями для різних класів антибіотиків, дозволить нам розробити нові стратегії подолання резистентності.
ВСТУП
Стійкість до збудників інфекційних захворювань антибіотиками є глобальною проблемою в біології та медицині [1, 2]. Сучасні протимікробні препарати (ВМД) представляють найбільшу групу фармацевтичних препаратів, що включає 16 класів природних та синтетичних сполук (рис. 1).
Основні класи антимікробних препаратів, їх мішені та їх вплив на основні процеси життєдіяльності бактеріальної клітини
Синтез антибіотиків існує в природі більше 2 мільярдів років. Протягом усього цього часу бактерії виробляли механізми стійкості до їх токсичної дії. Резистентність може відбуватися як адаптивний процес, не пов'язаний зі структурою антибіотика, або розвиватися в результаті відбору стійких штамів мікроорганізмів під впливом антибіотиків. Антропогенні фактори, пов’язані із застосуванням антибіотиків у медицині та, особливо, у сільському господарстві з середини 20 століття, призвели до значної еволюції механізмів стійкості; час, необхідний для формування стійкості до нових препаратів, значно скоротився [3, 4].
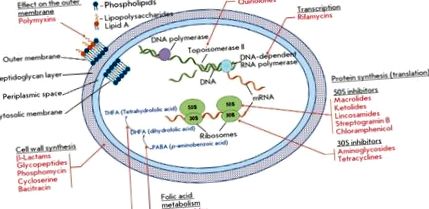
Роль бактеріальних ферментів у розвитку стійкості досить різнобічна і включає кілька ключових механізмів (рис. 2) [5]. Ферменти, що беруть участь у біосинтезі клітинної стінки, а також синтез нуклеїнових кислот і метаболітів, служать безпосередньою мішенню для антибіотиків. Механізм стійкості пов'язаний зі структурними змінами цих ферментів. Інший механізм пов'язаний з ферментативною модифікацією структурних елементів, на які впливають антибіотики: наприклад, модифікація рибосом метилтрансферазами. Велика група ферментів модифікує або руйнує структуру антибіотиків, інактивуючи їх. Ферменти, що каталізують метаболічні процеси та модифікують ВМД у формі проліків, також беруть участь у розвитку резистентності.
Класи ферментів, що беруть участь у різних механізмах стійкості до протимікробних препаратів
Бактеріальні ферменти, що визначають резистентність, зазвичай належать до великих надродин; багато з них походять від ферментів, які спочатку мали інші функції [6]. Гени, відповідальні за синтез цих ферментів, та їх мутаційну мінливість часто локалізуються на мобільних генетичних елементах, забезпечуючи тим самим швидке поширення стійкості між мікроорганізмами.
У цьому огляді представлені дані про функціональні особливості основних класів та груп бактеріальних ферментів, що беруть участь у реалізації механізмів стійкості бактерій до ВМД.
БАКТЕРІАЛЬНІ ЕНЗИМИ ЯК ЦЕЛІ ВМД
Білки, що зв’язують пеніцилін
С-кінцеві домени всіх PBP є мішенями для β-лактамних антибіотиків, які складають більше половини всіх застосовуваних зараз ВМД [10]. Ці антибіотики містять β-лактамне кільце, структурний аналог D-Ala-D-Ala дипептиду, і, отже, діють як конкурентні інгібітори PBP. Взаємодія між карбонільною групою в β-лактамному кільці та гідроксильною групою серину в активному центрі PBP призводить до неактивної ацильованої форми ферменту. Незворотне інгібування порушує синтез клітинної стінки бактерій [9, 10].
Основні причини, чому грампозитивні бактерії розвивають стійкість до β-лактамних антибіотиків, включають мутації природних PBP, їх гіперпродукцію та синтез нових PBP, нечутливих до інгібування β-лактамами [11]. На сьогодні поширення штамів золотистого стафілокока, стійких до метициліну та інших напівсинтетичних пеніцилінів та цефалоспоринів, становить загрозу [12]. Стійкість визначається експресією п'ятого ферменту, PBP2a (на додаток до чотирьох природних PBP), який має низьку спорідненість до β-лактамних антибіотиків і проявляє лише транспептидазну активність. На малюнку 4 показано механізм стійкості: без антибіотика обидва домени високомолекулярного PBP беруть участь у біосинтезі пептидоглікану (A); лише домен глікозилтрансферази залишається активним у високомолекулярному PBP у присутності антибіотика, тоді як домен транспептидази ацильований і не утворює зшивок. Саме придбаний низькомолекулярний PBP2a (B) виявляє транспептидазну активність у стійкому штамі. В результаті життєздатність клітин відновлюється.
Роль білків, що зв’язують пеніцилін, у стійкості грампозитивних бактерій до β-лактамних антибіотиків. А - чутливий штам, В - стійкий штам
Ферменти PBP2a кодуються генами mecA [13] або mecC [14]. Гени mecA та mecC разом з генами, що регулюють їх експресію (mecI, mecR1 та mecR2), є компонентами мобільного генетичного елемента хромосоми стафілококової касети mec [15].
Білки, що належать до сімейства PBP, відіграють вирішальну роль у формуванні клітинної стінки бактерій і є попередниками стійкості, спричиненої продукцією β-лактамаз (див. Розділ “β-лактамази”).
Топоізомерази II типу: ДНК-гіраза та топоізомераза IV
До топоізомераз типу II належать ДНК-гіраза та топоізомераза IV, які каталізують зміни просторової конфігурації молекули ДНК під час реплікації, транскрипції та поділу клітин [16, 17]. ДНК-гіраза та топоізомераза IV є гетеротетрамерними ферментами: ДНК-гіраза складається з двох субодиниць GyrA (97 кДа) та двох субодиниць GyrB (90 кДа); топоізомераза IV складається з двох субодиниць ParC (84 кДа) та двох субодиниць ParE (70 кДа). Субодиниці GyrA та ParC утворюють каталітичні домени, що беруть участь у формуванні комплексів з молекулою ДНК для її розриву/лігування; субодиниці GyrB та ParE проявляють активність АТФази для подачі енергії в процес.
ДНК-гіраза та топоізомераза IV служать мішенями для хінолонів та їх похідних, фторхінолонів. Утворення комплексу топоізомерази ДНК-типу II є необхідною умовою інгібування (рис. 5). Місце зв’язування антибіотика з ферментом у потрійному комплексі відоме як кинолон-зв’язуюча кишеня [17, 18].
Схематична структура потрійного комплексу між топоізомеразами II типу, ДНК та хінолонами. (Gyr A, Gyr B - субодиниці гірази, Par C, Par E - субодиниці топоізомерази IV)
Антибіотик нековалентно зв’язується з активним центром ферменту, тому рух ферменту та реплікаційна виделка вздовж молекули ДНК зупиняються [19]. Утворення третинного комплексу хінолону-топоізомерази типу II-ДНК зупиняє не лише реплікацію, але й транскрипцію, оскільки рух РНК-полімерази вздовж матриці ДНК пригнічується [20]. У ньому утворюються розриви в дволанцюжковій молекулі ДНК, що також визначає бактерицидну дію хінолонів [21]. Хінолони не впливають на топоізомерази ссавців II типу, оскільки вони суттєво відрізняються від бактеріальних топоізомераз.
Мутації амінокислот в області QRDR субодиниць GyrA та ParC топоізомераз типу II з кишкової палички, які відповідають за стійкість до хінолонів. Колір вказує положення мутацій, поєднання яких викликає синергетичний ефект
ДНК-залежна РНК-полімераза
Бактерицидна дія рифаміцинів (рифампінін, рифабутин) полягає у пригніченні ДНК-залежної РНК-полімерази [23]. Цей фермент складається з п’яти субодиниць: двох α- (молекулярна маса кожної субодиниці становить 35 кДа), β- (155 кДа), β’- (165 кДа) та σ-субодиниць (70 кДа). Чотири субодиниці ββ’αα утворюють так званий апофермент, який проявляє каталітичну активність і виконує всі основні стадії транскрипції. Ініціювання транскрипції та розпізнавання промоторів бактеріального гена вимагають утворення голоферменту, що відбувається, коли регуляторна σ-субодиниця зв’язується з апоферментом [24].
Рифаміцини вибірково зв'язуються з β-субодиницею ферменту поблизу головного каналу та інгібують подовження похідного ланцюга РНК. Виникнення резистентності до рифаміцинів у більшості випадків пов’язане з мутаціями відносно невеликого фрагмента гена rpoB (кодони 507–533), що кодує β-субодиницю РНК-полімерази. Мутації амінокислотних залишків у положеннях 513, 516, 526 та 531 (рис. 7) характеризуються найвищим ступенем поліморфізму [25].
Мутації амінокислот у фрагменті RpoB β-субодиниці РНК-полімерази, які відповідають за стійкість до рифаміцинів
Ферменти, що каталізують біосинтез міколевих кислот
Термін «міколеві кислоти» є загальною назвою для групи довголанцюгових розгалужених жирних кислот, компонентів клітинної стінки мікобактерій. Деякі протитуберкульозні препарати, похідні ізонікотинової кислоти (ізоніазид, етіонамід та протіонамід), пригнічують синтез міколевих кислот [25, 26]. Ці препарати орієнтовані на білок-редуктазу еноїл-ацильного носія (відому як InhA), яка є компонентом синтази жирних кислот FAS-II. Він каталізує відновлення D2-ненасичених жирних кислот до насичених, використовуючи кофактор NADPH як донор водню [27]. Порушений синтез міколевих кислот пригнічує синтез клітинної стінки мікобактерій.
Стійкість до цих препаратів обумовлена мутаціями гена inhA, які впливають або на промоторну область оперона mabA – inhA, і викликають гіперпродукцію ферменту, або на послідовність, що кодує фермент, зменшуючи тим самим його спорідненість до комплексу між ізонікотиновим кислотний радикал і НАД + [28, 29].
БАКТЕРІАЛЬНІ ФЕРМЕНТИ, МОДИФІКУЮЧІ ЦІЛЬОВІ ЦІЛІ AMD
рРНК метилтрансферази
Бактеріальні рибосоми виступають мішенями для багатьох ВМД [30]. Невелика субодиниця 30S складається з 16S рРНК та 21 білка. Аміноглікозиди зв'язуються з субодиницею 30S, отримуючи водневі зв'язки з азотистими основами кількох нуклеотидів 16S рРНК, що перешкоджає правильному зв'язуванню аміноацил-тРНК з антикодоном і призводить до помилок синтезу білка та подальшої загибелі клітин (рис. 8А). Деякі аміноглікозиди можуть безпосередньо пригнічувати ініціювання або блокувати подовження поліпептидного ланцюга [30, 31].
Зв'язування аміноглікозидів (А) та антибіотиків групи MKLS (В) з рибосомою та їх вплив на синтез білка
Одним із механізмів стійкості до аміноглікозидів є метилювання А-ділянки 16S рРНК бактеріальними 16S рРНК метилтрансферазами, що призводить до втрати здатності зв’язуватися з рибосомою антибіотиками [32, 33]. S-аденозил-L-метіонін (SAM) дарує метильну групу для цих ферментів. Описано одинадцять різних 16S рРНК-метилтрансфераз, які можна розділити на дві групи за типом модифікованого нуклеотиду в А-ділянці. Ферменти, класифіковані в першій групі (ArmA, RmtA, RmtB, RmtC, RmtD1, RmtD2, RmtE, RmtF, RmtG і RmtH), каталізують метилювання 16S рРНК в положенні N7 нуклеотиду G1405 і роблять бактерії стійкими лише до 4,6-dis-disub аміноглікозиди. До другої групи відноситься метилтрансфераза NmpA, яка метилює нуклеотид А1408 у позиції N1 та надає стійкість до всіх відомих аміноглікозидів, за винятком стрептоміцину та спектиноміцину [31, 32].
Гени, що кодують ці ферменти, в основному локалізуються в кон'югатних плазмідах та/або пов'язані з транспозонами; вони часто пов'язані з іншими генами стійкості до антибіотиків [34]. Найбільш поширеними є ферменти RmtB та ArmA. Виробники RmtB були виділені не тільки з клінічних зразків патогенних мікроорганізмів людини, але і з домашніх тварин, що вказує на те, що детермінанти стійкості можуть передаватися від тварин до людей [33].
Макроліди, кетоліди, лінкозаміди та стрептограмін В (група MKLS відповідно до назви його компонентів) націлені на велику субодиницю 50S рибосоми, що містить 5S та 23S рРНК та 33 білки рибосом. Незважаючи на відмінності в їх структурі, ці антибіотики мають спільний сайт зв'язування з субодиницею 50S в безпосередній близькості від центру пептидилтрансферази. Тим часом вони закривають рибосомний тунель, структурний елемент, розташований у великій рибосомній субодиниці. Ця взаємодія призводить до дисоціації пептидил-тРНК з рибосоми, що призводить до порушення транслокації та припинення синтезу білка (рис. 8Б).
В даний час проводиться активний пошук ефективних інгібіторів рРНК метилтрансферази. Інгібітори SAM-зв'язуючого центру ферментів, що імітують молекулу - донор метильної групи, були запропоновані в якості інгібіторів рРНК метилтрансферази, але виявились неселективними [37]. Також були запропоновані сполуки, що інгібують як SAM-зв'язуючі, так і субстратно-зв'язуючі центри ферментів [38].
Ферменти, що беруть участь у модифікації пептидоглікану в клітинній стінці бактерій
Фосфоетаноламінтрансферази
Поліміксини (колістин) націлені на ліпополісахариди зовнішньої мембрани грамнегативних бактерій. Основною складовою цих AMD є позитивно заряджений циклічний поліпептид, механізм дії якого подібний до механізму дії катіонних миючих засобів. Взаємодія між молекулами поліміксину та негативно зарядженими фосфатними групами ліпополісахаридів нейтралізує мембранний заряд і змінює проникність мембрани для внутрішньо- та позаклітинних компонентів. Основний механізм стійкості до поліміксинів пов'язаний із закриттям каналу проникнення антибіотика в клітину. Цей канал закритий шляхом модифікації ліпіду А (компонента ліпополісахаридів) фосфоетаноламіном, який каталізується фосфоетаноламінтрансферазою (рис. 9) [44]. Ген, що кодує цей фермент, має хромосомну локалізацію. Ген mcr-1 нещодавно був виявлений на плазмідах [45]. Розвиток цього типу стійкості пов’язаний з мутаціями генів фосфоетаноламінтрансферази [46].
Схема модифікації ліпіду А, компонента ліпополісахаридів зовнішньої клітинної мембрани, фосфоетаноламінтрансферазою
- Протиінфекційні препарати та ліки - Антибіотичні таблетки, орієнтовані на 100% на експорт з Мумбаї
- 10 вправ на діапазон опору для сильніших ніг поза Інтернетом
- 4 фактори, що блокують метаболізм, пов’язані із стійкістю до втрати жиру - Фітнес-центр Pinnacle
- 5 вправ на коло опору для тренування для всього тіла
- 10 вправ діапазону опору для побудови сили всього тіла