Атерогенна дієта зменшує експресію гена FXR у печінці та спричиняє важкий стеатоз печінки та накопичення холестерину в печінці
Анотація
Призначення
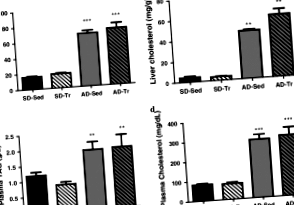
Метою цього дослідження було визначити вплив атерогенної дієти (АД; 40% ліпідів, 1,25% холестерину, ккал) на тригліцериди (TAG) та накопичення холестерину в печінці та на експресію генів печінкових рецепторів X (LXR) та фарнезоїдів. X-рецептор (FXR) та їх цільові гени та спостерігати, чи впливає на ці реакції тренування на витривалість.
Методи
Щури Sprague – Dawley (n = 32) були розділені на дві групи і випадковим чином призначені для АД або стандартної дієти (СД) протягом 7 тижнів. Половина щурів у кожній групі була призначена на програму фізичних вправ протягом 5 днів на тиждень.
Результати
Результатом нашої ери стало велике (P
Це попередній перегляд вмісту передплати, увійдіть, щоб перевірити доступ.
Параметри доступу
Придбайте одну статтю
Миттєвий доступ до повної статті PDF.
Розрахунок податку буде завершено під час оформлення замовлення.
Підпишіться на журнал
Негайний онлайн-доступ до всіх випусків з 2019 року. Підписка буде автоматично поновлюватися щороку.
Розрахунок податку буде завершено під час оформлення замовлення.
Список літератури
Comhair TM, Garcia Caraballo SC, Dejong CH, Lamers WH, Kohler SE (2011) Харчовий холестерин, жіноча стать та дефіцит жирних кислот n-3 є більш важливими факторами розвитку неалкогольної жирової хвороби печінки, ніж індекс насичення жиру. Нутр Метаб (Лондон) 8: 4
Treguier M, Briand F, Boubacar A, Andre A, Magot T, Nguyen P, Krempf M, Sulpice T, Ouguerram K (2011) Індукована дієтою дисліпідемія погіршує зворотний транспорт холестерину у хом'яків. Eur J Clin Invest 41 (9): 921–928
Wang YM, Zhang B, Xue Y, Li ZJ, Wang JF, Xue CH, Yanagita T (2010) Механізм дієтичного впливу холестерину на метаболізм ліпідів у щурів. Здоров'я ліпідів Dis 9: 4
Subramanian S, Goodspeed L, Wang S, Kim J, Zeng L, Ioannou GN, Haigh WG, Yeh MM, Kowdley KV, O'Brien KD et al (2011) Харчовий холестерин посилює стеатоз печінки та запалення у мишей з дефіцитом рецепторів ЛПНЩ із ожирінням. . J Lipid Res 52 (9): 1626–1635
Bhathena J, Kulamarva A, Martoni C, Malgorzata A, Malhotra UM, Paul A, Prakash S (2011) Індукована дієтою метаболічна хом'ячка модель неалкогольної жирової хвороби печінки. Diabetes Metab Syndr Obes 4: 195–203
Wojcicka G, Jamroz-Wisniewska A, Horoszewicz K, Beltowski J (2007) Рецептори печінки X (LXR). Частина I: будова, функції, регуляція активності та роль у ліпідному обміні. Postepy Hig Med Dosw (Інтернет) 61: 736–759
Редінгер Р. Н. (2003) Ядерні рецептори при катаболізмі холестерину: молекулярна біологія ентерогепатичної циркуляції жовчних солей та її роль у гомеостазі холестерину. J Lab Clin Med 142 (1): 7–20
Яновскі Б.А., Віллі П.Д., Деві Т.Р., Фальк Дж.Р., Мангельсдорф Ді-джей (1996). Сигнальний шлях оксистеролу, опосередкований ядерним рецептором LXR альфа. Nature 383 (6602): 728–731
Cipriani S, Mencarelli A, Palladino G, Fiorucci S (2010) Активація FXR скасовує резистентність до інсуліну та аномалії ліпідів та захищає від стеатозу печінки у щурів із ожирінням Цукер (фа/фа). J Lipid Res 51 (4): 771–784
Kong B, Luyendyk JP, Tawfik O, Guo GL (2009) Дефіцит рецептора фарнезоїду X індукує неалкогольний стеатогепатит у мишей, що вибивали рецептори ліпопротеїнів низької щільності, що харчувалися дієтою з високим вмістом жиру. J Pharmacol Exp Ther 328 (1): 116–122
Yang ZX, Shen W, Sun H (2010) Вплив ядерних рецепторів FXR на регуляцію ліпідного обміну печінки у пацієнтів з неалкогольною жировою хворобою печінки. Hepatol Int 4 (4): 741–748
Correa Antunez MI, Moran Penco JM, Amaya Lozano JL, Leal Macho A, Macia Botejara E, Saenz Santamaria J (2010) Зміни у складі жиру та гістоморфологія печінки після часткових резекцій кишечника. Nutr Hosp 25 (6): 999–1005
Йошида М (2011) Нова роль NPC1L1 у регуляції печінкового метаболізму: потенційний внесок езетимібу у лікування НАЖХП/НАСГ. Curr Vasc Pharmacol 9 (1): 121–123
Zhu Y, Li F, Guo GL (2011) Тканинна специфічна функція рецептора фарнезоїду X у печінці та кишечнику. Pharmacol Res 63 (4): 259–265
Frith J, Newton JL (2010) Хвороби печінки у жінок старшого віку. Maturitas 65 (3): 210–214
Gauthier MS, Couturier K, Latour JG, Lavoie JM (2003) Паралельні фізичні вправи запобігають індукованому дієтою макровезикулярний стеатоз печінки. J Appl Physiol 94 (6): 2127–2134
Meissner M, Havea R, Boverhof R, Kema I, Groen AK, Kuipers F (2010) Вправи посилюють обмін холестерином у всьому тілі у мишей. Med Sci Sports Exerc 42 (8): 1460–1468
Голлік П.Д. (1963) Хронічний вплив фізичних вправ на рівень холестерину печінки нормальних та гіперхолестеринемічних щурів. Am J Physiol 205: 453–456
Folch J, Lees M, Sloane Stanley GH (1957) Простий метод виділення та очищення загальних ліпідів з тканин тварин. J Biol Chem 226 (1): 497–509
Xu G, Pan LX, Li H, Forman BM, Erickson SK, Shefer S, Bollineni J, Batta AK, Christie J, Wang TH et al (2002) Регуляція рецептора фарнезоїду X (FXR) потоком жовчних кислот у кроликів. J Biol Chem 277 (52): 50491–50496
Fujino T, Murakami K, Ozawa I, Minegishi Y, Kashimura R, Akita T, Saitou S, Atsumi T, Sato T, Ando K et al (2009). -активований протеїнкіназозалежний шлях. FEBS J 276 (5): 1319–1332
Shi QY, Lin YG, Zhou X, Lin YQ, Yan S (2010) Експресія FXR-мРНК, PPAR альфа-мРНК та метаболізм жовчних кислот генів при внутрішньопечінковому холестазі вагітних щурів. Zhonghua Gan Zang Bing Za Zhi 18 (12): 927–930
Zhong XY, Yu JH, Zhang WG, Wang ZD, Dong Q, Tai S, Cui YF, Li H (2012) MicroRNA-421 функціонує як онкогенна мікроРНК при раку жовчних шляхів завдяки регулюванню експресії рецептора фарнезоїду X. Ген 493 (1): 44–51
Fuchs M (2012) Безалкогольна жирова хвороба печінки: рецептор фарнезоїду х, що активується жовчю, кислотою як нова мета лікування. J Ліпіди 2012: 934396
Watanabe M, Houten SM, Wang L, Moschetta A, Mangelsdorf DJ, Heyman RA, Moore DD, Auwerx J (2004) Жовчні кислоти знижують рівень тригліцеридів через шлях, що включає FXR, SHP та SREBP-1c. J Clin Invest 113 (10): 1408–1418
Zhang Y, Castellani LW, Sinal CJ, Gonzalez FJ, Edwards PA (2004) Активований проліфератором пероксизоми рецептор-гамма-коактиватор 1альфа (PGC-1alpha) регулює метаболізм тригліцеридів шляхом активації ядерного рецептора FXR. Гени Dev 18 (2): 157–169
Chapados NA, Lavoie JM (2010) Навчання фізичним вправам збільшує експресію білка стресу в печінковій ендоплазматичній сітці (er) у інгібованих МТП щурів, що харчуються жиром. Клітинна біохімія Функція 28 (3): 202–210
Kosters A, Frijters RJ, Schaap FG, Vink E, Plosch T, Ottenhoff R, Jirsa M, De Cuyper IM, Kuipers F, Groen AK (2003) Взаємозв'язок між експресією печінки АТФ-зв'язуючих касетних транспортерів G5 і G8 та секрецією біліарного холестерину у мишей. J Гепатол 38 (6): 710–716
Yu L, Gupta S, Xu F, Liverman AD, Moschetta A, Mangelsdorf DJ, Repa JJ, Hobbs HH, Cohen JC (2005) Експресія ABCG5 і ABCG8 необхідна для регулювання секреції жовчного холестерину. J Biol Chem 280 (10): 8742–8747
Lambert G, Amar MJ, Guo G, Brewer HB Jr, Gonzalez FJ, Sinal CJ (2003) Фарнезоїдний X-рецептор є важливим регулятором гомеостазу холестерину. J Biol Chem 278 (4): 2563–2570
Gupta S, Pandak WM, Hylemon PB (2002) LXR alpha є домінуючим регулятором транскрипції CYP7A1. Biochem Biophys Res Commun 293 (1): 338–343
Ando H, Tsuruoka S, Yamamoto H, Takamura T, Kaneko S, Fujimura A (2005) Регуляція експресії мРНК холестерину 7-альфа-гідроксилази у мишей C57BL/6, які харчувались атерогенною дієтою. Атеросклероз 178 (2): 265–269
Pramfalk C, Angelin B, Eriksson M, Parini P (2007) Холестерин регулює експресію гена ACAT2 та активність ферментів у клітинах гепатоми людини. Biochem Biophys Res Commun 364 (2): 402–409
Gadaleta RM, van Mil SW, Oldenburg B, Siersema PD, Klomp LW, van Erpecum KJ (2010) Жовчні кислоти та їх ядерні рецептори FXR: значення для гепатобіліарних та шлунково-кишкових захворювань. Biochim Biophys Acta 1801 (7): 683–692
Alvaro A, Rosales R, Masana L, Vallve JC (2010) Поліненасичені жирні кислоти регулюють in vitro експресію ключового білка всмоктування холестерину в кишечнику NPC1L1: відсутність ефекту мононенасичених або насичених жирних кислот. J Nutr Biochem 21 (6): 518–525
Levy E, Spahis S, Sinnett D, Peretti N, Maupas-Schwalm F, Delvin E, Lambert M, Lavoie MA (2007) Білки кишкового транспорту холестерину: оновлення та не тільки. Curr Opin Lipidol 18 (3): 310–318
Altmann SW, Davis HR Jr, Zhu LJ, Yao X, Hoos LM, Tetzloff G, Iyer SP, Maguire M, Головко A, Zeng M et al (2004) Білок Niemann-Pick C1 Like 1 має вирішальне значення для всмоктування холестерину в кишечнику. Science 303 (5661): 1201–1204
Дурстін Дж. Л., Гранджіан П.В., Девіс П.Г., Фергюсон М.А., Алдерсон Н.Л., ДуБозе К.Д. (2001) Адаптація ліпідів та ліпопротеїдів крові до фізичних вправ: кількісний аналіз. Sports Med 31 (15): 1033–1062
Meissner M, Havea R, Boverhof R, Kema I, Groen AK, Kuipers F (2010) Вправи посилюють обмін холестерином у всьому тілі у мишей. Med Sci Sports Exerc 42 (8): 1460–1468
Wilund KR, Feeney LA, Tomayko EJ, Weiss EP, Hagberg JM (2009) Вплив тренувань на витривалість на маркери всмоктування та синтезу холестерину. Physiol Res 58 (4): 545–552
Meissner M, Lombardo E, Havea R, Tietge UJ, Kuipers F, Groen AK (2011) Добровільний біг на колесі збільшує жовчну кислоту, а також виведення холестерину та зменшує атеросклероз у мишей з гіперхолестеринемією. Атеросклероз 218 (2): 323–329
Готьє М.С., Фав'є Р., Лавуа Дж. М. (2006) Динаміка розвитку неалкогольного стеатозу печінки у відповідь на ожиріння, спричинене дієтою, у щурів. Br J Nutr 95 (2): 273–281
Basciano H, Miller AE, Naples M, Baker C, Kohen R, Xu E, Su Q, Allister EM, Wheeler MB, Adeli K (2009) Метаболічні ефекти харчового холестерину на тваринній моделі інсулінорезистентності та стеатозу печінки. Am J Physiol Endocrinol Metab 297 (2): E462 – E473
Matsuzawa N, Takamura T, Kurita S, Misu H, Ota T, Ando H, Yokoyama M, Honda M, Zen Y, Nakanuma Y et al (2007) Індукований ліпідами окислювальний стрес спричинює стеатогепатит у мишей, які харчуються атерогенною дієтою. Гепатологія 46 (5): 1392–1403
Yiu WF, Kwan PL, Wong CY, Kam TS, Chiu SM, Chan SW, Chan R (2011) Ослаблення жирової печінки та профілактика гіперхолестеринемії екстрактом Curcuma longa шляхом регулювання експресії CYP7A1, LDL-рецептора, HO-1 та HMG-CoA редуктаза. J Food Sci 76 (3): H80 – H89
Koopmans SJ, Dekker R, Ackermans MT, Sauerwein HP, Serlie MJ, van Beusekom HM, van den Heuvel M, van der Giessen WJ (2011) Дієтичні насичені жири/холестерин, але не ненасичений жир або крохмаль, індукують пов'язаний з C-реактивним білком ранній атеросклероз та ектопічне відкладення жиру у діабетичних свиней. Кардіоваск Діабетол 10:64
Zhang Y, Ge X, Heemstra LA, Chen WD, Xu J, Smith JL, Ma H, Kasim N, Edwards PA, Novak CM (2012) Втрата FXR захищає від ожиріння, спричиненого дієтою, і прискорює канцерогенез печінки у мишей ob/ob . Mol Endocrinol 26 (2): 272–280
Prawitt J, Abdelkarim M, Stroeve JH, Popescu I, Duez H, Velagapudi VR, Dumont J, Bouchaert E, van Dijk TH, Lucas A et al (2011) Дефіцит рецепторів Farnesoid X покращує гомеостаз глюкози на мишачих моделях ожиріння. Діабет 60 (7): 1861–1871
Подяка
Цю роботу підтримали гранти Канадського інституту досліджень охорони здоров’я (CIHR; T 0602 145.02) та Ради з природничих та технічних досліджень Канади (NSERC; 7594).
Конфлікт інтересів
Усі автори заявляють, що у них немає конфлікту інтересів.
Інформація про автора
Приналежності
Кафедра кінезіології, Університет Монреаля, C.P. 6128, Сук. center-ville, Монреаль, QC, H3C 3J7, Канада
Ізабель Коте, Емільєн Тудор Нго Шкарпетка та Жан-Марк Лавуа
Департамент харчування, Центр дослідницької роботи CHU Ste-Justine, Монреаль, QC, Канада
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
- Фізіологічно відповідна атерогенна дієта спричиняє сильну дисфункцію ендотелію протягом 4 тижнів
- Дієта з високим вмістом калорій посилює дисфункцію мітохондрій та викликає серйозні пошкодження печінки у Вільсона
- Атерогенна дієта сприяє запаленню печінки, формуванню жирової печінки та атерогенезу в рецепторах ЛПНЩ
- Додайте печінку у свій раціон Зробіть печінкові капсули - кокосова мама
- Вживання чорниці, що входить до гіпокалорійної дієти, знижує вагу, глюкозу, холестерин, тригліцериди