Аналіз економічної ефективності пембролізумабу у порівнянні зі стандартним лікуванням як лікування першої лінії для пацієнтів із запущеною меланомою у Гонконгу
Анотація
Передумови
Показано, що пембролізумаб покращує загальну виживаність (ОС) та виживання без прогресування захворювання (ПФС) у порівнянні з іпілімумабом у пацієнтів із не розвиненою іполімумабом меланомою; однак опублікованих даних про економічну ефективність пембролізумабу немає порівняно зі стандартними методами лікування, які в даний час застосовуються в Гонконзі при запущеній меланомі.
Методи
Модель розподіленого виживання, заснована на даних недавнього рандомізованого дослідження фази 3 (KEYNOTE-006) та мета-аналізу, була використана для визначення часу в PFS, OS та виживання після прогресування пембролізумабу та хіміотерапії, такі як дакарбазин (DTIC), темозоломід (TMZ) та комбінація паклітаксел-карбоплатин (ПК). Поєднання даних клінічних випробувань, опублікованих даних, результатів мета-аналізу та даних реєстру меланоми було використано для екстраполяції кривих PFS та OS. Часовий горизонт базової ситуації для моделі становив 30 років з урахуванням витрат та результатів охорони здоров’я зі швидкістю 5% на рік. Індивідуальні дані щодо рівня корисності пацієнтів та частоти побічних явищ були отримані в результаті остаточного аналізу KEYNOTE-006 (гранична дата: 3 грудня 15) для пембролізумабу. Дані про вартість включали придбання ліків, призначення лікування, лікування побічних явищ та клінічне лікування розвиненої меланоми. Розрахунок ваги пацієнтів серед населення Гонконгу застосовувався для розрахунку витрат на ліки. Аналіз проводився з точки зору платника. Основним результатом став коефіцієнт додаткової економічної ефективності (ICER), виражений як вартість у доларах США (USD) за якісні життєві роки (QALY).
Результати
За базовим сценарієм показник ICER для пембролізумабу як першої лінії лікування запущеної меланоми становив 49 232 доларів США порівняно з DTIC, при цьому значення ICER нижче, ніж поріг економічної ефективності в Гонконзі. Результати порівняння пембролізумабу з TMZ та ПК були подібними до результатів порівняно з DTIC. Аналіз чутливості до вірогідності показав, що 99% змодельованих показників ICER були втричі нижчими за валовий внутрішній продукт (ВВП) на душу населення для Гонконгу (на даний момент 119 274 доларів США // поріг QALY). В аналізі сценарію, що порівнює пембролізумаб та іпілімумаб, оцінюваний ICER становив 8 904 доларів США.
Висновки
Пембролізумаб є економічно вигідним у порівнянні з хіміотерапією (DTIC, TMZ та PC) та високоефективним у порівнянні з іпілімумабом для лікування першої лінії запущеної меланоми у Гонконгу.
Ключові моменти
Хоча існували попередні публікації, присвячені економічній ефективності інгібіторів контрольних пунктів при лікуванні розвинених меланом, більшість цих попередніх звітів стосувались економічної ефективності між різними інгібіторами контрольних точок (наприклад, програмована клітинна смерть-1 (PD-1) проти. антицитотоксичний асоційований з Т-лімфоцитами білок 4 — CTLA-4) або їх застосування в поєднанні. Цитотоксичні хіміотерапії все ще регулярно використовуються як варіанти лікування першої лінії в різних юрисдикціях. Залишається мало даних, що стосуються економічної ефективності інгібітора контрольно-пропускного пункту порівняно з цитотоксичними хіміотерапіями.
Ми провели модель розподіленого виживання на основі даних, отриманих із рандомізованого дослідження фази 3 KEYNOTE-006, у поєднанні з попередніми мета-аналізами, які використовувались для визначення часу в PFS, OS та виживання після прогресування пембролізумабу, а також хіміотерапії.
Поєднання даних клінічних випробувань, опублікованих даних, результатів мережевого мета-аналізу та даних реєстру меланоми було використано для екстраполяції кривих PFS та OS. Дані про витрати, включаючи придбання та лікування лікарських засобів, були отримані з оновленої опублікованої інформації управління лікарні Гонконгу, тоді як використання ресурсів, необхідних для клінічного лікування побічних явищ, було визначено групою клінічних експертів.
Ми дійшли висновку, що в Гонконгу показник ICER для пембролізумабу як першої лінії лікування передової меланоми порівняно з цитотоксичними хіміотерапіями та іпілімумабом становив 49 232 та 8904 долари США відповідно. Аналіз чутливості до вірогідності показав, що 99% змодельованих ICER були нижчими втричі валового внутрішнього продукту (ВВП) на душу населення для Гонконгу (в даний час на рівні 119 274 дол. США/QALY).
Передумови
Незважаючи на те, що вищезазначені висновки стосуються Сполучених Штатів, залишається вирішити, чи справедливі такі висновки і в інших закладах охорони здоров’я, де можуть існувати принципові відмінності у структурі фінансування охорони здоров’я та наявних альтернативних варіантах лікування. Більше того, у попередньому дослідженні не було проведено порівняння зі звичайними цитотоксичними речовинами, які залишаються основою протиракових методів лікування у великій кількості юрисдикцій, включаючи Гонконг.
У базовому випадку ми оцінили економічну ефективність пембролізумабу проти дакарбазину (DTIC) у пацієнтів з розвиненою меланомою в першій лінії. В рамках аналізу чутливості були додатково розглянуті два сценарії, включаючи порівняння економічної ефективності (i) пембролізумабу проти іпілімумабу та (ii) пембролізумабу порівняно з іншими цитотоксичними хіміотерапіями (темозоломід - TMZ та комбінація паклітакселу - карбоплатину - PC) у цій популяції, на основі витрат на охорону здоров'я та наявних методів лікування в системі охорони здоров'я Гонконгу.
Методи
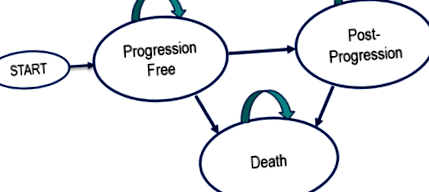
За допомогою Excel була побудована розділена модель виживання з трьома взаємовиключними станами здоров'я: без прогресування, після прогресування та смерті. Пацієнти, модельовані за тими, хто проходив випробування KEYNOTE-006, починають у стані без прогресування (PF). Стан прогресуючого захворювання (PD) виникає після першого прогресування захворювання, визначеного в ході дослідження незалежним рентгенологом та онкологом, використовуючи критерії оцінки відповіді при твердих пухлинах (RECIST), версія 1.1 [3] (рис. 1).
Схема переходу імітаційної моделі
У моделі пембролізумаб дозували по 2 мг/кг кожні 3 тижні (Q3W) і вводили протягом 24 місяців. Ті, хто все ще переживав без прогресування захворювання (ПФС) наприкінці 24 місяців, мали право отримувати до 12 місяців реіндукційного лікування, якщо вони перенесли прогресування захворювання протягом 2-річного періоду спостереження.
Часовий горизонт у базовому аналізі моделі становив 30 років, оскільки він враховує різницю у житті у вигодах для здоров'я та витратах на ці варіанти лікування. Коротший часовий горизонт тестували в аналізі чутливості.
Моделювання PFS та загальної виживаності (ОС) для пембролізумабу (Q3W) базувалося на даних пацієнтів KEYNOTE-006, які отримували пембролізумаб кожні 3 тижні (тобто 277 пацієнтів загалом). Пропорції пацієнтів у кожному стані здоров'я розраховувались на основі фактичних та прогнозованих кривих виживання для PFS та OS. Для кривих PFS протягом перших 13 тижнів використовувались оцінки Каплана – Мейєра з KEYNOTE-006. Тиждень 13 був обраний граничною точкою для проектування довгострокової ПФС, оскільки в кривій Каплана – Мейєра спостерігалася розрив, пов’язана з радіологічним скануванням, керованим протоколом. Після цього модель використовувала параметричні функції вижилих, пристосовані до даних випробувань 13 тижня та пізніше для проекту PFS. Для базового випадку було використано розподіл Вейбулла на основі достовірності статистики придатності та клінічної думки, що більш плоский хвіст краще відображає довгострокові переваги імунотерапії.
Модель припускала, що найкраща підтримуюча допомога (включаючи «відсутність активного лікування») є єдиною наступною терапією, що проводиться після прогресування обох препаратів для лікування. Це припущення було застосовано, оскільки дані випробувань не показали суттєвої різниці в застосуванні наркотиків після прогресування між двома групами, а інші припущення вимагали б спекуляцій щодо ефективності з різних послідовностей та тривалості вживання наркотиків.
Дані про якість життя та несприятливі події були в основному отримані з остаточного аналізу поточного дослідження KEYNOTE-006 [8] та інших опублікованих джерел [9]. Витрати, використані в аналізі, були вилучені з різних опублікованих джерел, про які повідомлялось у 2018 році [10], та описані нижче.
Витрати
Витрати на введення ліків на дозу оцінювались на основі ставок, отриманих з місцевих даних Гонконгу. Модель також включала витрати на планові відвідування онкологічного кабінету, лабораторні обстеження, сканування та інші ресурси, що використовуються в різних станах здоров'я на основі дослідження INTUITION (див. Таблицю 1) [11]. Модель також включала одноразову вартість термінальної допомоги для приблизної вартості медичного обслуговування за останні 6 місяців життя, як оцінювали Wong et al. 2007 [12].
Побічні явища (АЕ) ступеня тяжкості від 3 до 5, які впливали щонайменше на 3% пацієнтів принаймні в одній з груп лікування, були включені в модель для обох груп [8, 9]. Крім того, діарею 2+ ступеня було включено через її економічний вплив. Передбачається, що витрати на ендокринні розлади виникають раз на 6 місяців [13]. Витрати на управління включеним АЕ 3–5 ступеня були взяті із заявлених цін із Постанови лікарняного управління (Глава 113) [14].
Оцінки за корисність
Оцінка корисності базувалася на даних про якість життя, зібраних у дослідженні KEYNOTE-006, з виключенням відсутніх значень. Європейська анкета щодо якості життя п’яти вимірів (EuroQoL EQ-5D) - була введена під час певних візитів до пацієнтів з пембролізумабом та іпілімумабом. Його також вводили під час візитів щодо припинення прийому наркотиків та наступних візитів щодо безпеки на 30-й день. Відповіді на опитувальник EQ-5D були перетворені на показники корисності на основі популяції за допомогою змішаного алгоритму (де бали, що базуються на США, застосовувались до пацієнтів із США, бали на базі Великобританії для пацієнтів у Великобританії та бали на основі ЄС для всіх інших пацієнтів) оскільки специфічний для Гонконгу алгоритм наразі недоступний. Розраховувались середні показники корисності EQ-5D, пов’язані з наступними категоріями часу до смерті: 360 днів або більше, 270–360 днів, 90–270 днів, 30–90 днів і менше 30 днів. Смерть отримала утиліту 0 [2].
Показники корисності, пов’язані з пацієнтами, які зазнали побічних явищ 3–5 ступенів, також порівнювали з оцінками, коли пацієнти не відчували побічних явищ. Різниця між відвідуваннями з побічними явищами 3–5 ступеня та без них була використана для оцінки середньої непрацездатності, пов’язаної з побічними явищами. Для аналізу базового випадку було використано середнє зменшення корисності для АЕ з аналізу об’єднаних даних (тобто 0,15), і тривалість АЕ прийнята за 8 тижнів. Для кожного стану здоров’я для кожного 1-тижневого циклу було призначено певну вагу коригування якості та якості життя для розрахунку кумулятивних витрат та сукупних QALY протягом модельного часового горизонту.
Витрати, пов'язані з АЕ, та зменшення корисності застосовувались окремо до кожного препарату, припускаючи, що події відбулися на початку дослідження. Витрати та QALY дисконтувались із ставкою 5% на рік. Для проведення оцінки економічної ефективності модель була використана для проектування витрат, років життя, QALY та додаткових витрат на QALY, отриманих, пов'язаних з використанням пембролізумабу та порівняльних препаратів у пацієнтів, які не отримували лікування.
Аналіз чутливості
Проведені аналізи чутливості включали: аналіз сценаріїв, детермінований односторонній аналіз чутливості та ймовірнісний аналіз чутливості.
Аналіз чутливості сценарію вивчав вплив альтернативних порівняльних засобів (в даний час не відшкодовується і не використовується як терапія першої лінії в Гонконгу), декількох різних методологій, що використовуються при екстраполяції кривих виживання (PFS та OS), оцінки корисності на основі стану здоров'я на основі прогресії штати (тобто для кожного стану здоров’я до і після прогресування). різні часові горизонти, ставки дисконтування та різні припущення щодо стратегії лікування пембролізумабом.
Аналіз чутливості до сценарію з урахуванням альтернативних порівняльних препаратів, які в даний час не відшкодовуються або не використовуються як лікування першої лінії при запущеній меланомі в Гонконзі, включав порівняння пембролізумабу з препаратом імунотерапії іпілімумабом, а також іншими хіміотерапевтичними препаратами, такими як TMZ та комбінація ПК. Щодо іпілімумабу застосовували подібний підхід до моделювання пембролізумабу, клінічну ефективність та безпеку в основному отримували пацієнти в групі іпілімумабу KEYNOTE-006, а також довгострокові дані про іпілімумаб від Шадендорфа та ін. [4] та дані AJCC. Для інших хіміотерапевтичних препаратів передбачалася така сама клінічна ефективність, як для DTIC, оскільки непряме порівняння лікування було можливим лише для пембролізумабу та DTIC. Виходячи з клінічних думок, очікувалося, що ефективність різних хіміотерапій буде однаковою. Це припущення підтверджується дослідженнями, які показують, що хіміотерапія навряд чи матиме користь від виживання з точки зору пухлинної реакції та покращення часу до прогресування або покращення загальної виживаності в порівнянні з найкращим підтримуючим лікуванням (BSC) у хворих на меланому із передовим станом [15,16,17]. Крім того, немає рандомізованих контрольованих досліджень, які демонстрували б поліпшення виживання при DTIC щодо BSC.
Вказана ціна на іпілімумаб становила 5897,43 дол. США за флакон із 50 мг, і його вводили у дозі 3 мг/кг. На основі розподілу ваги пацієнта за місцевими даними Гонконгу потрібно було в середньому 4,40 флакона по 50 мг. Вказана ціна TMZ становила 0,71 дол. США за мг, а при дозуванні 1000 мг/м 2 (200 мг/м 2 п’ять разів на тиждень) вартість розрахунку на дозу TMZ оцінювалася в 1249,50 дол. США. Паклітаксел та карбоплатин були доступні за роздрібними цінами 0,26 дол. США за мг та 0,07 дол. США за мг відповідно з їх відповідними дозами 175 мг/м 2 та 300 мг/м 2, що давались раз на 3 тижні (середня площа поверхні тіла = 1,75 м 2) . Орієнтовні витрати на ці альтернативні компаратори, розглянуті в аналізі сценаріїв, представлені в таблиці 1.
Детермінований односторонній аналіз чутливості зосереджений на зміні значень параметрів моделі, пов'язаних із порівнянням базового випадку DTIC з пембролізумабом. Значення параметрів змінювались для функцій екстраполяції через розрахункові 95% довірчі інтервали, комунальні послуги були змінені на плюс-мінус 20%, витрати на лікування захворювань на 25%, а витрати на управління АЕ від 50 до 200%, як найкращі здогадки щодо їх потенційного діапазону обмежені доступні кількісні дані.
Крім того, аналіз імовірнісної чутливості (PSA) проводився на основі 1000 наборів одночасних вибірок із заданих розподілів ймовірності входів моделі. Основні розподіли включали бета-розподіл із використанням середньої та стандартної похибки для комунальних послуг на основі клінічного випробування та журнал нормальних розподілів для витрат, використовуючи засоби, що дорівнюють базовому значенню випадку та стандартним помилкам, як повідомляється в літературі, або встановлені консервативно на 20% від базової вартості випадку. Крім того, PSA включав невизначеність у функціональні форми функцій екстраполяції на основі призначення розподілів для ключових параметрів, що характеризують функції екстраполяції. На основі 1000 оцінок додаткових витрат за отриманий QALY, імовірність того, що пембролізумаб та компаратор є економічно ефективними при різних порогових показниках готовності до сплати, відображалася за допомогою кривої прийнятності економічної ефективності.
Результати
Аналіз базового випадку
Детальні результати аналізів базових випадків наведені в таблиці 2 і на рис. 1. Пацієнти, які отримували пембролізумаб, провели в середньому 2,36 року в стані без прогресування захворювання і 5,48 року в стані після прогресування, що призвело до середнього оцінка виживання 7,83 року. У групі DTIC пацієнти провели в середньому 0,61 року в стані здоров'я без прогресування захворювання і 2,13 року в стані PD, середній час виживання - 2,74 року. Отже, пембролізумаб асоціювався із збільшенням середнього виживання 5,09 років.
Що стосується QALY, пембролізумаб асоціювався із середнім (дисконтованим) приростом 2,64 QALY над DTIC. Крім того, модель базового випадку прогнозувала різницю в 95 052 дол. США у загальній середній прямій вартості лікування пембролізумабом на одного пацієнта порівняно з DTIC. Таким чином, ICER для пембролізумабу становив $ 35,993/QALY ($ 18,668 за LY) протягом 30-річного періоду часу (рис. 2).
Модельоване без прогресування і загальне виживання для пембролізумабу та DTIC (час у тижнях)
- Перша допомога пропонує процедури для схуднення My Hudson Valley
- Пронос у кошенят рекомендації щодо догляду та лікування Полювання Риболовля
- Економічна ефективність лікування сімейного ожиріння - PubMed
- FDA затверджує перший біоподібний препарат для лікування дорослих пацієнтів з FDA неходжкинської лімфоми
- FDA схвалила Rybelsus® (семаглутид), першу аналогову терапію GLP-1, доступну в таблетках для