Альгінат кальцію
Пов’язані терміни:
- Хітозан
- Альгінова кислота
- Ферменти
- Полімери
- Іммобілізовані клітини
- Білки
- Дріжджі
- Наночастинки
- Альгінат натрію
Завантажити у форматі PDF
Про цю сторінку
Шкіра
Пов’язка з альгінату кальцію
Пов’язки з альгінату кальцію (наприклад, Curasorb, Kendall Products) є найбільш корисними в сильно ексудативні рани де вони сприяють утворенню грануляційної тканини. Тому після розробки здорового грануляційного шару не слід використовувати альгінатні пов’язки, оскільки вони можуть стимулювати розвиток гордої плоті. Хоча внесок кальцієвої складової недостатньо вивчений, кальцій, як правило, сприяє міграції та реконструкції клітин на етапі відновлення. Альгінат взаємодіє з натрієм, який присутній у ранах, створюючи гель, який забезпечує оптимальне вологе загоювальне середовище. Пов’язки з альгінату кальцію є дуже абсорбуючими, утримуючи приблизно 20 разів більше ваги пов’язки в ексудаті. Вони не прилипають до основної рани, і тому їх видалення не є незручним для пацієнтів.
Лікування поверхневих ран
Пов'язки з альгінату кальцію
Пов'язки з альгінату кальцію використовуються в основному для грануляційної фази відновлення рани. Вони виготовляються з альгінату, похідного морських водоростей. Кальцій у пов’язці взаємодіє з натрієм у рані, забезпечуючи ексудат рани, який стимулює міофібробласти та епітеліальні клітини та пришвидшує гомеостаз рани. 53 Кальцій також модулює проліферацію та міграцію епітеліальних клітин. Альгінатні пов’язки бувають у нетканих прокладках та мотузкових пов’язках. Вони добре підходять до рани, мають відмінні властивості вертикального всмоктування та призначені для помірних та сильно ексудативних ран. Якщо рана має дефект грануляційної тканини і не має помірної кількості ексудату, перед використанням прокладку слід попередньо змочити сольовим розчином. Пов'язку можна міняти кожні 3 - 7 днів, залежно від кількості ексудату.
Покривна система
Крістін Л. Теорет, Тед С. Сташак, у розділі «Надзвичайні ситуації на конях» (четверте видання), 2014
Альгінат кальцію (Каліфорнія)
СА класифікується як волокнистий декстраномер.
Він доступний з різних джерел (Curasorb, 26 C-Stat, 27 Nu-Derm, 28 та Kaltostat 29). •
Виготовлений із солей альгінової кислоти, отриманих із водоростей Phaeophyceae, що містяться в морських водоростях
Може поглинати до 19-30 разів більше своєї ваги в рановій рідині
Сприяє вологому середовищу, сприятливому для загоєння ран
Стверджується, що збільшує епітелізацію та формування грануляційної тканини; цього не виявили в одному дослідженні, проведеному на конях
Активує макрофаги в хронічному руслі рани, що сприяє формуванню грануляційної тканини
Деякі альгінати мають здатність “запускати” цілющий каскад, викликаючи лізис тучних клітин, що призводить до вивільнення гістаміну та 5-гідрокситриптаміну.
Через ці властивості пов'язки з альгінату кальцію вважаються біоактивними.
Помірні до сильно виділяються рани під час переходу від гострого запального процесу до відновлення фаз загоєння
Рани зі значною втратою тканин, такі як травми, пов’язані з глибоким поглинанням
Початкове загоєння в хронічному руслі рани •
Пов’язку слід попередньо змочити перед нанесенням на хронічну суху рану, яка потребує стимуляції для формування грануляційної тканини. Кращою альтернативою є спочатку зняти рану, потім накласти пов’язку, не змочуючи її (рис. 19-23 показує суху рану спинного скакательного суглоба). На альгінатну пов'язку кальцію слід накласти напівоклюзійну неадгезійну прокладку, а потім вторинні та третинні шари бинтів.
Нові уявлення про мембранну науку та технологію: полімерні та біофункціональні мембрани
6.3.1 Затискання в альгінаті
Для іммобілізації в альгінаті кальцію суспензію концентрованих клітин змішували з розчином альгінату натрію (8% мас./Об.) [44] і отримували сферичні кульки, опускаючи суміш у розчин хлориду кальцію 20 г/л через голку 0,5 діаметр мм. Середній діаметр отриманих намистин становив приблизно 2 мм. Гранули суспендували в 0,5% (об./Об.) Розчині глутаральдегіду при перемішуванні протягом 30 хв. Після промивання водою кульки зберігали при 4 ° C до подальшого використання. Ця процедура гарантує отримання м’якого гелю, що важливо для мінімізації опору масообміну в цій системі.
Іммобілізовані клітини
C. Каніфоль,. Ж.-Н. Барботін., Прогрес у біотехнології, 1996
Вплив надмакромолекулярної структури гранул альгінату кальцію
Гранули альгінату кальцію мають змінну надмакромолекулярну структуру в залежності від умов, в яких готують бісерні гелі. Концентрація альгінату та хлориду кальцію є основними параметрами, що впливають на механізм гелеутворення. Інші параметри, такі як в'язкість, час геліфікації та ступінь полімеризації впливають на цей механізм. Експерименти без мікроорганізмів показали, що зміна концентрацій розчинів хлориду кальцію та альгінатів означає суттєві відмінності в діаметрі гранул, вмісті кальцію, кількості стволочків, вазі кульки тощо.
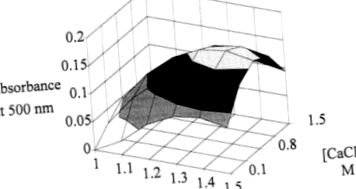
Для зменшення кількості експериментів та вимірювання ефекту зміни концентрації альгінату та хлориду кальцію було реалізовано факторну конструкцію експерименту. Отримана поверхня відгуку дозволяє визначити оптимальну зону виробництва пігменту. Цей максимум досягається за допомогою 1,35% альгінату та 0,9 М хлористого кальцію (Рисунок 4).
Малюнок 4. Еволюція поглинання при 500 нм як функція концентрації альгінату та хлориду кальцію за 96 годин ферментації.
Звичайні та альтернативні технології вилучення полісахаридів водоростей
14.3.7 Перетворення альгінату кальцію в альгінову кислоту
Іммобілізована клітинна ферментація для виробництва хімічних речовин та палива
2.3.1 Захоплення гелем
Основним обмеженням альгінатних кальцієвих бісерних гелів є їх вразливість до хелатоутворюючих речовин, таких як фосфати, лактати, цитрати та ЕДТА, внаслідок декальцифікації та в результаті втрати міцності гелю [39]. Нестабільність кальцинових альгінатних кульки та наслідки вивільнення клітин, що виникають при іммобілізації ниткоподібних грибів, стали фактором, який обмежує тривалу дію бродіння іммобілізованих клітин [53]. Інші іони, такі як алюміній, барій та стронцій, також можуть утворювати міцні гелі з альгінатом [76]; однак їх токсичність може обмежити їх використання при бродінні. Для запобігання розчиненню кульки альгінату кальцію застосовували доповнення ферментаційного середовища кальцієм [77]. Однак кальцій є важливим пусковим механізмом для багатьох метаболічних процесів, і будь-яка зміна його концентрації в середовищі, ймовірно, призведе до зміни клітинного метаболізму.
κ-карагенан - ще один природний полісахарид, який виявився корисним для захоплення клітин. Це гелі у присутності солей лужних металів, амінів або розчинників, а іони калію зазвичай використовують для стабілізації гелю. Процедура іммобілізації подібна до альгінату, і її проводять шляхом додавання теплої суспензії клітин/карагенану по краплях (3–4% мас./Об.) До розчину хлористого калію (0,3 М) при кімнатній температурі або до масляної фази з наступним охолодженням до кімнатної температури та інкубацією в розчині хлористого калію [39]. Розмір гранул може регулюватися робочими умовами процесу гелеутворення, такими як швидкість охолодження. Більш високу механічну стійкість гранул можна отримати, доповнивши полімер смолою рожкового дерева [59, 60, 78] або обробкою, що зміцнює, з використанням Al (NO3) 3 [79]. Подібним чином, інші природні полімери, такі як агар, також використовувались для іммобілізації клітин. Однак механічна міцність агару є дуже слабкою порівняно з альгінатом або карагенаном, і він може піддаватися повільному погіршенню внаслідок синерезису [3]. Нещодавно пектат кальцію вважається кращою альтернативою альгінату кальцію завдяки підвищеній хімічній стійкості його матриці [80, 81].
Полівініловий спирт (ПВА) та ГЕМА також широко використовуються для іммобілізації клітин мікробів і менш токсичні для клітин. Ці синтетичні гелі отримують шляхом опромінювальної полімеризації. N-ізопропілакриламід (N-IPAAM) може бути використаний для зшивання гелю PVA/HEMA для захисту клітин від лізису при 40 ° C [68]. Нещодавно був розроблений новий метод іммобілізації на основі PVA, LentiKats ® [67, 69, 83]. Суспензію клітин змішують з розчином полімеру (рідина LentiKat ®), а гелеутворення проводять контрольованим частковим висушуванням при кімнатній температурі, в результаті чого утворюються частинки у формі кришталика, що містять захоплені клітини. Гідрогель LentiKat ® має хороші механічні властивості, не піддається біологічному розкладанню, а іммобілізовані клітини не схильні до забруднення, оскільки забруднюючі клітини не зможуть потрапити в гідрогель і замінити бажаний біокаталізатор.
Порівняно зі зв'язуванням з носієм, незначна втрата активності клітин є однією з основних позитивних рис техніки захоплення. Однак, оскільки поживні речовини, що використовуються клітинами, а також продукти, що виділяються з клітин, повинні проходити через гелевий матрикс і клітинну стінку, масообмін стає важливим фактором, який слід враховувати. Обмеження поживних речовин призведе до загибелі клітин, і будь-яке збагачення продуктів може спричинити ефекти гальмування та призвести до зниження ефективності процесу. Тому обмеження дифузії зазвичай розглядається як найбільш негативна риса цього методу. Для вирішення та подолання проблем, обумовлених опорами масообміну, іммобілізовані клітинні біореактори повинні забезпечувати хороші характеристики змішування та оптимальний масообмін між газовою, рідкою та твердою фазами.
Іммобілізовані клітини
С. Білецький, Р. Болек, "Прогрес у біотехнології", 1996
Матеріали і методи
Мікроорганізм. Рекомбінантний штам E. coli з геном, що кодує фермент TPL, спочатку був виділений з Citrobacter freundii і трансформований в організм господаря за допомогою плазмідної векторної системи [4] .
Умови культури. Штам кишкової палички культивували протягом 20 год у струшуваних культурах при 37 ° С. Росте середовище містило 1,0% триптону бактону, 0,5% дріжджового екстракту, 0,5% NaCl, 50 мкл/мл ампіциліну.
Аналіз ферментів. Активність тирозин-фенол-ліази вимірювали як швидкість синтезу L-допи в реакційній суміші, що складається з пірокатехолу, пірувату, ацетату аміаку, PLP, Na2SO3, EDTA та борату натрію.
Аналітичні методи. Утворену L-допу оцінювали за допомогою ВЕРХ з використанням колони з зворотною фазою, елюйованої 0,01 М амонієвим ацетатним буфером, рН 3,5 при швидкості потоку 1 мл-хв - 1. L-допу виявляли при його поглинанні при 280 нм. Концентрацію L-допи розраховували за посиланням на калібрувальну криву.
Плазмідна стійкість. Стабільність плазміди у вільних та іммобілізованих рекомбінантних клітинах кишкової палички визначали за методикою Vehmaanperä [5] .
Підготовка іммобілізованих клітин. Клітини рекомбінантної кишкової палички іммобілізували в альгінаті кальцію, ПВА, карагенані та поліакриламіді наступним чином:
Іммобілізація в альгінаті кальцію: Клітини ресуспендували в 0,9% розчині NaCI і змішували зі стерильним 1% альгінатом натрію. Суспензію по краплях пропускали в 4% розчин CaCl2. Намистини (діаметром 1-2 мм) промивали дистильованою водою і зберігали в 0,9% розчині NaCI при 4 ° C до використання.
Іммобілізація в карагенані: Клітини ресуспендували в 4% розчині карагенану (70 мг сухої маси клітин на мл) при 55 ° C. Однорідну суміш шприцом екструдували через голку у 2% розчин KCl при 0 ° C. Намистини (діаметром 3-5 мм) промивали дистильованою водою і зберігали в 0,9% розчині NaCl при 4 ° C до використання.
Іммобілізація в ПВА: Клітини ресуспендували в 12% розчині полівінілового спирту (50 мг сухої маси клітин на мл). Однорідну суміш екструдували шприцом через голку в їстівне масло -20 ° C. Намистини заморожували в олії (-30 ° С). Через 24 год кульки розморожували і процес повторювали 5 разів. Намистини (діаметром 1-2 мм) промивали дистильованою водою і зберігали в 0,9% розчині NaCl при 4 ° C до використання.
Іммобілізація в поліакриламідному гелі: клітини кишкової палички (100 мг сухої маси клітин на мл) ресуспендували у розчині, що складається з: 10% акриламіду, 5% N, N 'метиленбісакриламіду, 0,04% N, N, N, N' тетраметилену діаміду та 0,25% (NH4) 2S2O8. Полімеризація відбувалась при 0 ° C протягом 30 хв. Отриманий гель фракціонували на кульки діаметром приблизно 2 мм. Гранули промивали дистильованою водою і зберігали в 0,9% розчині NaCl при 4 ° C до використання.
Іммобілізовані клітини
Хімічна стійкість - набряк
Основним обмеженням використання альгінату кальцію в якості матриці іммобілізації клітин є його чутливість до хелатних сполук, таких як фосфат, цитрат і лактат, або негелюючих катіонів, таких як іони натрію або магнію. Запропоновано різні способи подолання цього. Найпростіше - утримувати гелеві кульки в середовищі, що містить кілька мілімолів на літр вільного кальцію, і підтримувати співвідношення кальцію натрію менше 25: 1 для альгінату з високим вмістом G та 3: 1 для альгінату з високим вмістом М. Однак альгінатні гелі також можна стабілізувати, замінюючи іони кальцію іншими двовалентними катіонами, що мають більш високу спорідненість до альгінату. Ряд спорідненості для різних двовалентних катіонів: Pb 2 +> Cu 2 +> Cd 2 +> Ba 2 +> Sr 2 +> Ca 2 +> Co 2 +, Ni 2 +, Zn 2 +> Mn 2 + .
Загальним підходом для стабілізації альгінатних гелів є ковалентне зшивання. Застосовувались різні техніки, включаючи пряме зшивання карбоксильних груп або ковалентне щеплення альгінату синтетичними полімерами. Це забезпечує гелі з поліпшеною стабільністю та механічною міцністю, але в більшості випадків умови зчеплення жорсткі для крихких клітин.
Біолістичні та інші неагробактеріальні технології трансформації рослин
Трейсі К. Мацумото, Денніс Гонсалвес, Біотехнологія рослинництва та сільське господарство, 2012
Перенос генів, що опосередковується біоактивними кульками
- Тривожний невроз - огляд тем ScienceDirect
- Антиандроген - огляд тем ScienceDirect
- Бутанол - огляд тем ScienceDirect
- Бетулін - огляд тем ScienceDirect
- Адренергічний рецептор Beta-2 - огляд тем ScienceDirect