АДІПОЦИТ (ПРО) РЕНІН-РЕЦЕПТОР ІНДУКЦІЮЄ ЛІПОДИСТРОФІЮ, СТЕАТОЗ ПЕЧІНКИ І ПІДВИЩАЄ ТРИВАННЯ КРОВІ У МИШЕВ САМИХ
Чіа-Хуа Ву
1 Відділ фармакології та харчових наук Університету Кентуккі, Лексінгтон, штат Кентуккі
Шаян Мохаммадмораді
1 Кафедра фармакології та харчових наук Університету Кентуккі, Лексінгтон, штат Кентуккі
Джоел Томпсон
2 Відділ ендокринології та молекулярної медицини, Університет Кентуккі, Лексінгтон, Кентуккі
Вень Су
3 Кафедра фізіології Університету Кентуккі, Лексингтон, штат Кентуккі
Мін Гун
3 Кафедра фізіології Університету Кентуккі, Лексингтон, штат Кентуккі
Женев'єва Нгуєн
4 Національний інститут сантехніки та медичного дослідження (INSERM) та Коледж Франції, відділ експериментальної медицини, Париж, Франція
Фредеріке Яннікуріс
1 Відділ фармакології та харчових наук Університету Кентуккі, Лексінгтон, штат Кентуккі
Пов’язані дані
Анотація
Гіпертонія є основною причиною серцево-судинних захворювань у всьому світі, і, згідно з NHANES III, поширеність гіпертонії продовжує зростати. 1,2 Ожиріння є важливим фактором ризику гіпертонії. 1 Система ренін-ангіотензину (RAS) визнана надзвичайно важливою для регулювання артеріального тиску та гомеостазу натрію та води. Видалення компонентів RAS, наприклад, ангіотензиногену (AGT) у печінці або жировій тканині, запобігає гіпертонії, пов’язаній з ожирінням. 3,4
Методи та тварини
Усі процедури із залученням тварин проводились згідно з Національним керівництвом інститутів охорони здоров’я щодо догляду та використання лабораторних тварин і були схвалені Інституційним комітетом з догляду та використання тварин при Університеті Кентуккі (номер протоколу IACUC Університету Кентуккі: 2013-1109 ). Самки мишей з сайтами loxP, що фланкують екзон 2 гена PRR (PRR fl/fl), були виведені до трансгенних самців мишей (PRR fl/Y), що експресують Cre рекомбіназу під контролем промотору адипонектину (назва штаму: B6; FVB-Tg ( Adipoq-cre) 1Evdr/JB6; FVB-Tg (Adipoq-cre) 1Evdr/J) 24 (Рисунок 1A). Дієти, вимірювання плазми, гістологія, радіотелеметрія та статистичний аналіз описані в Інтернет-додатку до даних.
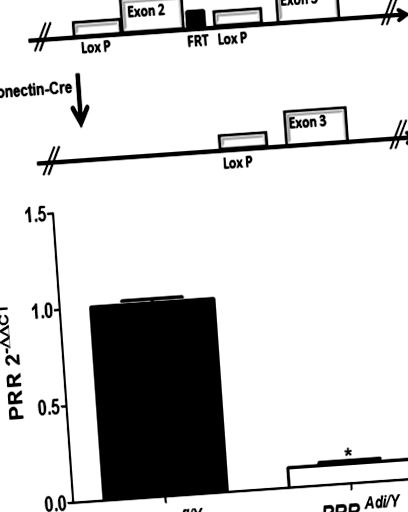
(A) Схематичне зображення алелю PRR, фланкированного loxP, до (a) та після рекомбінації з експресією Cre, керованою адипонектином (b). (B) РНК PRR мРНК достаток диференційованих адипоцитів із підшкірної жирової тканини мишей PRR fl/Y та PRR Adi/Y. Дані є середнім ± SEM для 3-6 мишей. * P fl/Y миші.
Статистичний аналіз
Результати виражаються як середнє значення ± SEM. Всі дані були проаналізовані за допомогою Sigma Plot та Graph Prism. ANOVA (та повторні заходи ANOVA, коли це доречно) використовувались для порівняння дієти та ефекту генотипу, після чого проводились пост-hoc тести з використанням корекцій Holm-Sidak або Bonferroni для множинних порівнянь. Коли припущення, що лежать в основі ANOVA, не виконувалися інакше, дані трансформувались нелінійно; однак для зручності ілюстрації на малюнках зображені нетрансформовані дані. GraphPad QuickCalcs (тест Груббса) використовували для визначення статистичних відхилень, а t-тест використовували для порівняння середнього рівня інсуліну між HF та LF мишами. Статистичну значимість визначали як P fl/Y), а мишей з дефіцитом адипоцитів-PRR (PRR Adi/Y) диференціювали на адипоцити (рис. 1А). Чисельність PRR мРНК помітно знизилася в адипоцитах, диференційованих від мишей PRR Adi/Y, порівняно з контрольними мишами PRR fl/Y (Рисунок 1B; P Фігура 2A) без суттєвої різниці між генотипами. Маса жиру була значно зменшена у PRR Adi/Y у порівнянні з контрольними мишами PRR fl/Y (рис. 2B) і не збільшувалася з віком у мишей PRR Adi/Y, що припускає, що миші PRR Adi/Y не накопичують жирової тканини (рис. S1) . Маса всіх білих жирових тканин була значно зменшена у мишей PRR Adi/Y порівняно з мишами PRR fl/Y (таблиця S1, миші P fl/Y виявили наявність диференційованих адипоцитів у всьому розрізі, тоді як гістологічний аналіз залишкової жирової тканини з навколо епідидиму PRR Миші Adi/Y показали несподівано дуже малу кількість диференційованих адипоцитів (рис. S2) .Щоб визначити, чи був адипоцит PRR залучений до диференціації адипоцитів, PRR замовчувався in vitro в клітинах 3T3-L1 (рис. S3). Оцінювали PPARγ, важливий ген, що бере участь у диференціації адипоцитів, і білок, що зв’язує жирні кислоти 4 (Fabp4 або aP2), маркер для диференційованих адипоцитів і білок-носій для жирних кислот. Рівень мРНК PPARγ та Fabp4 значно зменшився у диференційовані клітини siPRR порівняно з контрольними клітинами.
Дефіцит PRR адипоцитів зменшує жирову масу у мишей, які харчуються стандартною дієтою. (A) Криві маси тіла мишей PRR fl/Y та PRR Adi/Y. Дані є середніми ± SEM 4-6 мишей. (B) Жирова маса (% від маси тіла) для мишей у кожній групі. Дані є середніми ± SEM 4-6 мишей. * P fl/Y .
Вага тканин печінки, селезінки та підшлункової залози був значно вищим у мишей PRR Adi/Y порівняно з мишами PRR fl/Y (таблиця S1). Концентрації лептину у плазмі крові були меншими у мишей PRR Adi/Y, ніж у мишей PRR fl/Y (таблиця S1). Толерантність до глюкози не відрізнялася між генотипами на 5, 9 або 13 тижні експерименту (рис. S4).
Специфічний для адипоцитів дефіцит PRR викликав накопичення ліпідів у печінці самців мишей, яких годували стандартною дієтою
Мікроскопічне дослідження зрізів печінки виявило збільшення накопичення печінкового жиру, що включає малі та великі жирові вакуолі у мишей PRR Adi/Y порівняно з мишами PRR fl/Y (рис. S5). Нейтральні ліпіди значно підвищувались у печінці мишей PRR Adi/Y порівняно з мишами PRR fl/Y. Тригліцериди плазми суттєво не відрізнялися між групами (таблиця S1).
Специфічний для адипоцитів дефіцит PRR підвищував систолічний артеріальний тиск у самців мишей, які харчувались стандартною дієтою
SBP та пульсовий тиск були значно вищими у мишей PRR Adi/Y порівняно з мишами PRR fl/Y (рис. 3). Середній артеріальний артеріальний тиск, діастолічний артеріальний тиск та частота серцевих скорочень суттєво не відрізнялись між групами (Таблиця S2).
Дефіцит PRR адипоцитів підвищував систолічний артеріальний тиск (SBP; 24 год) у мишей, які годувались стандартною дієтою. (A) SBP (24 год) для самців PRR fl/Y та PRR Adi/Y мишей. Дані є середніми ± SEM 4 мишей. * P fl/Y миші.
Специфічний для адипоцитів дефіцит PRR збільшує концентрацію sPRR у плазмі крові
Специфічний для адипоцитів дефіцит PRR не змінює концентрацію АГТ у плазмі крові (рис. 4А). Активність реніну в плазмі (PRA) та концентрація реніну в плазмі крові (PRC) не суттєво відрізнялися між мишами PRR Adi/Y та мишами PRR fl/Y (рис. 4B), що свідчить про те, що специфічний для адипоцитів дефіцит PRR не впливав на AGT, PRA або PRC . Дивно, але рівень sPRR у плазмі збільшився у три рази у мишей PRR Adi/Y порівняно з мишами PRR fl/Y (рис. 4C).
Дефіцит PRR адипоцитів збільшував sPRR плазми. (A) Концентрація AGT у плазмі крові у самців мишей PRR fl/Y та PRR Adi/Y. (B) Активність реніну плазми (PRA; ліва вісь y) та концентрації (PRC; права вісь y) у самців мишей PRR fl/Y та PRR Adi/Y. (C) Концентрація sPRR у плазмі крові у самців мишей PRR fl/Y та PRR Adi/Y. Дані є середніми ± SEM 4-6 мишей. * P fl/Y миші.
Специфічний для адипоцитів дефіцит PRR запобігав розвитку ожиріння та накопиченню жирової маси у мишей з високим вмістом жиру
Миші PRR Adi/Y були стійкими до ожиріння, спричиненого ВЧ-дієтою (Малюнок 5А). Маса жиру мишей PRR Adi/Y була нижчою приблизно на -70% порівняно з мишами PRR fl/Y, що годувались LF, і була майже на -80% порівняно з мишами PRR fl/Y, що годувались HF (Малюнок 5B). При застосуванні високочастотної дієти вага тканин печінки, серця та нирок був значно вищим у мишей PRR Adi/Y порівняно з мишами PRR fl/Y (таблиця S3). Дефіцит адипоцитів-PRR суттєво не впливав на структуру нирок (рис. S6). Миші PRR Adi/Y, що харчуються HF та LF, мали посилене накопичення ліпідів у печінці порівняно з мишами PRR fl/Y (рис. S7). Дефіцит адипоцитів-PRR не змінює рівні мРНК PRR у нирках та печінці (рис. S8A та S8B). ВЧ-дієта індукувала значне підвищення рівня холестерину в плазмі, яке не відрізнялося між генотипами.
Дефіцит PRR в адипоцитах запобігав розвитку ожиріння та зменшенню жирової маси. (A) Крива маси тіла мишей PRR fl/Y та PRR Adi/Y, які годувались дієтою з низьким вмістом жиру (LF) або з високим вмістом жиру (HF). Дані є середніми ± SEM від n = 5 до 8 мишей/групи. (B) Жирна і нежирна маса (% від маси тіла) мишей PRR fl/Y та PRR Adi/Y, які харчувались НЧ або ВЧ дієтою. Дані є середніми ± SEM для 3 до 8 мишей.
При застосуванні ВЧ дієти специфічний для адипоцитів дефіцит PRR покращує гомеостаз глюкози
Толерантність до глюкози не відрізнялася між генотипами після 16 тижнів LF-дієти (рис. S9A та S9B). Однак миші PRR Adi/Y, які годували HF, демонстрували покращену толерантність до глюкози порівняно з мишами PRR fl/Y, які годували HF. Рівні глюкози натще були значно нижчими у мишей PRR Adi // Y, що годувались HF або LF, порівняно з мишами PRR fl/Y (малюнок S9C). Дефіцит адипоцитів-PRR викликав значне підвищення рівня інсуліну в плазмі крові незалежно від дієти (Таблиця S3).
Незважаючи на стійкість до ожиріння, спричиненого ВЧ-дієтою, специфічний для адипоцитів дефіцит PRR ще більше збільшував SBP
Специфічний для адипоцитів дефіцит PRR індукував значне збільшення SBP у мишей, що годувались НЧ (рис. 6). Збільшення SBP, спричинене дефіцитом PRR, ще більше посилювалось, коли мишей PRR Adi/Y годували HF дієтою. Ці дані свідчать про те, що дефіцит адипоцитів PRR посилює підвищений рівень СД, спричинений ВЧ-дієтою. Середній артеріальний тиск та частота серцевих скорочень були вищими у мишей PRR Adi/Y незалежно від дієти (таблиці S4 та S5).
Дефіцит адипоцитарного PRR перебільшує підвищений артеріальний тиск, спричинений дієтою. SBP (24 год) самців мишей PRR fl/Y та PRR Adi/Y, які харчувались нежирною (LF) або високожирною (HF) дієтою. Дані є середніми ± SEM від n = 5 до 8 мишей. * P fl/Y миші.
У мишей, що страждають ожирінням, специфічний для адипоцитів дефіцит PRR посилював підвищення рівня sPRR у плазмі крові.
Годування з високим вмістом жиру спричинило значне збільшення концентрації AGT у плазмі крові у контрольних мишей PRR fl/Y (рис. 7А). Однак концентрація AGT у плазмі крові не відрізнялася у мишей PRR Adi/Y та PRR fl/Y незалежно від дієти. На PRA не впливали ні дієта, ні специфічний для адипоцитів дефіцит PRR (Малюнок 7B). При застосуванні високочастотної дієти миші PRR fl/Y демонстрували нижчий рівень PRC і нижчу загальну концентрацію прореніну/реніну, ніж миші PRR fl/Y, що годувались LF (Фігура 7B, таблиця S3). PRC та загальна концентрація прореніну/реніну у мишей PRR Adi/Y, що харчуються LF та HF, не відрізнялися від концентрації мишей PRR fl/Y, що годувались LF.
(A) Концентрація AGT у плазмі крові у самців мишей PRR fl/Y та PRR Adi/Y, які годувались низькочастотною або високочастотною дієтою. (B) Активність реніну плазми (PRA; ліва вісь y) та концентрація (PRC; права вісь y). (C) Концентрація sPRR у плазмі. Дані є середніми ± SEM 5–8 мишей. * P fl/Y миші.
Рівні sPRR у плазмі крові значно підвищувались у мишей PRR Adi/Y, що годувались НЧ, порівняно з мишами PRR fl/Y, що годувались НЧ. HF годування індукувало триразове збільшення рівня sPRR у плазмі крові у мишей PRR fl/Y, що годувались HF, порівняно з мишами PRR fl/Y, що годувались LF (Малюнок 7C). Рівні sPRR у плазмі крові були більш ніж удвічі вищими у мишей PRR Adi/Y, що годувались HF, порівняно з мишами PRR fl/Y, які годували HF. Концентрація sPRR у плазмі позитивно корелювала з SBP (миші P fl/Y та PRR Adi/миші разом (малюнок S10A) та лише у мишей PRR fl/Y; кореляція була слабшою (P> 0,05) лише у мишей PRR Adi // Y Однак рівні інсуліну в плазмі крові не корелювали зі СД (Рисунок S10B).
Обговорення
У цьому дослідженні вивчалася роль PRR, отриманого з адипоцитів, у контролі артеріального тиску та фізіологічні наслідки делеції PRR у адипоцитах самців мишей під час розвитку ожиріння. Делеція PRR адипоцитів спричинила помітне зменшення всіх білих жирових тканин без аномального розподілу подушечок жирової тканини. Дослідження in vitro продемонстрували, що PRR регулює PPARγ та Fabp4. Ліподистрофія супроводжувалась стеатозом печінки. Піддані ВЧ-годуванню, жирові PRR-дефіцитні миші були стійкими до розвитку ожиріння та покращували толерантність до глюкози. Незважаючи на відсутність білої жирової тканини та стійкість до ожиріння, спричиненого дієтою, миші з дефіцитом адипоцитів-PRR мали підвищений артеріальний тиск. Це підвищення артеріального тиску у мишей з дефіцитом адипоцитів-PRR виявилось незалежним від системних концентрацій АГТ та реніну. Дивно, але концентрація sPRR у плазмі крові збільшувалась при ВЧ-дієті та помітно підвищувалась у мишей з дефіцитом адипоцитів-PRR.
Видалення PRR адипоцитів призвело до зменшення маси жирової тканини та збільшення відкладення ліпідів у печінці, що свідчить про ліподистрофію, що супроводжується стеатозом печінки. Заглушення PRR in vitro виявило значне зниження PPARγ та Fabp4, що свідчить про те, що PRR є головним регулятором диференціації адипоцитів. Крім того, оскільки білки, що зв’язують жирні кислоти, є важливими носіями для засвоєння жирних кислот та транспортування жирних кислот до місць етерифікації тригліцеридами, 27 наші дані вказують на важливу роль PRR у торгівлі жирними кислотами та їх зберіганні в адипоцитах.
Наш фенотип спостерігався в інших моделях ліподистрофії, таких як A-ZIP/F, aP2/DTA, SREBP-1c або трансгенні моделі мишей з жировою дистрофією печінки (fld). 28,29 На відміну від цього, миші PRR Adi/Y, які харчувались ВЧ-дієтою, продемонстрували набагато більшу чутливість до глюкози, ніж контрольні миші, що годувались ВЧ. Наші результати відрізняються від результатів інших моделей ліподистрофії на мишах, у яких зазвичай спостерігаються гіперглікемія та гіпертригліцеридемія. Крім того, рівень інсуліну в плазмі крові у мишей PRR Adi/Y скромно підвищувався, а у мишей PRR Adi/Y не було вираженої гіперінсулінемії. Наші дані, тим не менше, узгоджуються з фенотипом моделі миші PPARγ P465L/+ 30, яка покращила здатність реагувати на гостре перевантаження глюкозою порівняно з контролем при застосуванні ВЧ годування. Як припускають Tsai et al., 30 розширення острівців підшлункової залози, ймовірно, може сприяти цій підвищеній реакції на глюкозу. Подібно до нашої моделі, модель CGI-58β миші 31 розвинула печінковий стеатоз, але була захищена від ожиріння та непереносимості глюкози. Зменшення маси тіла могло також сприяти кращій чутливості до глюкози.
Миші PRR Adi/Y демонстрували підвищений артеріальний тиск, подібний до рівня, який повідомляли у мишей PPARγ P465L/+ та людей, що виражали мутації FPLD2 та FPLD3. 28–30 В останніх випадках причина підвищення артеріального тиску недостатньо зрозуміла. Підвищений лептин асоціюється з підвищеним артеріальним тиском 32, але може захистити від неалкогольної жирової хвороби печінки 33. Таким чином, хоча малоймовірно, що низький рівень циркулюючого лептину у мишей PRR Adi/Y міг сприяти підвищенню артеріального тиску, низький рівень циркулюючого лептину міг сприяти розвитку стеатозу печінки.
Інсулінорезистентність може спричинити підвищення артеріального тиску, отже, підвищений рівень інсуліну міг би брати участь у підвищенні SBP у мишей PRR Adi/Y. 28 Однак наші результати продемонстрували, що рівень інсуліну не корелював із СДП, припускаючи, що підвищений інсулін може не бути джерелом підвищеного артеріального тиску. На відміну від цього, ми продемонстрували, що рівні sPRR у плазмі зростали з розвитком гіпертонії, спричиненої ожирінням. Дивно, але підвищення концентрації sPRR у плазмі крові посилювалось через дефіцит адипоцитів-PRR. Повідомлялося, що підвищення концентрації sPRR у плазмі крові на ранніх термінах вагітності передбачає як гіпертонію, так і ризик гестозу у вагітної. Більше того, у пацієнтів із серцевою недостатністю рівень sPRR у плазмі крові вищий, ніж у контрольних суб’єктів. 34 Однак наша демонстрація позитивної кореляції між sPRR і SBP, коли контрольні миші та миші PRR Adi/Y поєднуються або в контрольних мишах, лише вказує на те, що sPRR може відігравати роль у контролі артеріального тиску. Потрібне подальше розслідування щодо безпосереднього впливу sPRR на SBP. Серце, мозок, печінка, нирки та гладкі м'язи експресують ген PRR і можуть потенційно брати участь у вивільненні sPRR або бути потенційними тканинами-мішенями. 13–18,34
Перспективи
Чудовий фенотип адипоцитарно-PRR-дефіцитної моделі миші демонструє важливість PRR адипоцитів у гомеостазі ліпідів та глюкози та інсуліну. Наші результати демонструють необхідність адипоцитарного PRR у нормальному розвитку жирової тканини, поза її потенційною роллю в локальній активації RAS. Потрібні подальші дослідження для визначення механізму, за допомогою якого PRR регулює утворення жирових клітин, гомеостаз ліпідів та артеріальний тиск.
- Буряковий квас; Засіб для очищення печінки та тонік крові - Справжній харчовий бунтар
- Напад печінки веде до простішого життя - The New York Times
- 10 найкращих продуктів, які можна їсти після здачі крові - здоровий Celeb
- 5 дієтичних кроків для позбавлення від жирної печінки Vietnam Times
- Яблучний оцет від артеріального тиску працює?