Зміни метилювання, пов’язані з ожирінням, у ДНК лейкоцитів периферичної крові
Анотація
Передумови
Незважаючи на докази, що пов'язують ожиріння з порушенням імунної функції, про конкретні механізми відомо мало. Через нові докази того, що імунні відповіді регулюються епігенетично, ми висунули гіпотезу про те, що зміни метилювання ДНК пов’язані з імунною дисфункцією, спричиненою ожирінням, і мали на меті виявити ці зміни.
Метод
Ми провели широкомасштабний аналіз метилювання на сім випадків ожиріння та сім худорлявих контролів у віці від 14 до 18 років від крайніх кінців розподілу ожиріння та провели подальшу перевірку шести сайтів CpG з шести генів у 46 випадках ожиріння та 46 худорлявих контролів у віці від 14 до 30 років.
Результати
У порівнянні з худими контролями ми спостерігали один сайт CpG в гені UBASH3A, що демонструє більш високі рівні метилювання, і один сайт CpG у гені TRIM3, що демонструє нижчий рівень метилювання у випадках ожиріння на обох етапах геному (P = 5 × 10 -6 і P = 2 × 10 -5 для UBASH3A та гена TRIM3 відповідно) та етап перевірки (P = 0,008 і P = 0,001 для UBASH3A та гена TRIM3 відповідно).
Висновки
Наші результати дають докази того, що ожиріння пов’язане зі змінами метилювання в ДНК лейкоцитів крові. Потрібні подальші дослідження, щоб визначити причинно-наслідковий напрямок цих стосунків, а також те, чи можуть такі зміни метилювання призвести до порушення імунної функції.
Передумови
Ожиріння - це епідемія нашого часу, яка різко та неухильно зростає [1, 2]. Основні несприятливі наслідки ожиріння, включаючи діабет 2 типу, атеросклероз та есенціальну гіпертензію, у поєднанні обумовлюють велику кількість смертей, пов’язаних із захворюваннями [3, 4]. Якщо до цієї кількості додати випадків раку, пов’язаних із ожирінням, смертність від ожиріння значно перевищує смертність від інших загальних захворювань [5]. Останнє свідчить про нагальну необхідність розробки нових ефективних терапевтичних методів лікування цього стану.
Спільним знаменником у патогенезі супутніх захворювань ожиріння є наявність активного запального процесу низького ступеня [6]. Незважаючи на докази, що пов'язують ожиріння із змінами запальної реакції, мало відомо про специфічний вплив ожиріння на імунну систему. Останнім часом спостерігається більша оцінка ролі епігенетики, мейотично та мітотично спадкових змін у експресії генів, які не кодуються в самій послідовності ДНК, в імунних та запальних реакціях [7–9]. Тому ми припускаємо, що зміни метилювання ДНК відіграють певну роль у імунній дисфункції, спричиненій ожирінням. Метою цього дослідження було охарактеризувати профіль метилювання ДНК у лейкоцитах периферичної крові у людей із ожирінням та нежирними тваринами, використовуючи широкомасштабний підхід. Виявлення змін метилювання в конкретних генах забезпечить важливі цілі для подальшого вивчення механізмів впливу ожиріння на імунну систему та потенціалу для розробки нових методів лікування супутніх захворювань із ожирінням.
Методи
Предмети
Широкий аналіз метилювання на геном проводили у семи пацієнтах із ожирінням та семи з урахуванням віку. Ці 14 суб'єктів були ідентифіковані серед учасників (n = 534) у дослідженні "Стиль життя, ожиріння та здоров'я серцево-судинної системи у молоді" (LACHY), використовуючи такі критерії включення: (1) афроамериканські (AA) походження; (2) чоловічий; (3) наявність ДНК лейкоцитів; (4) випадки ожиріння з індексом маси тіла (ІМТ) ≥ 99-го процентиля для віку та статі та худі контролі з ІМТ ≤ 10-го процентиля для віку та статі. Дослідження LACHY включало приблизно однакову кількість підлітків АА та європейських американців (ЕА) віком від 14 до 18 років обох статей, набраних із середніх шкіл в районі Августи, штат Джорджія [10].
Для всіх чотирьох когорт для ідентифікації за попередньо описаними критеріями використовували самоідентифікацію шляхом самозвітів кожного суб’єкта чи батьків, якщо суб’єкт був до 18 років. Суб'єкти у всіх чотирьох дослідженнях були відверто здоровими, не мали жодних гострих чи хронічних захворювань на підставі звітів батьків і не застосовували антигіпертензивні, гіполіпідемічні, протидіабетичні та протизапальні препарати [10–13]. Комісія з огляду інституцій Медичного коледжу штату Джорджія схвалила дослідження. Інформована згода була отримана від усіх випробовуваних та від батьків, якщо випробовувані мали менше 18 років.
Вимірювання
Для всіх чотирьох когорт зріст та вага вимірювались стандартними методами за допомогою настінного стадіометра та ваги відповідно. ІМТ розраховували як вагу/зріст 2. Систолічний АТ (SBP) та діастолічний BP (DBP) вимірювали за допомогою моніторів Dinamap, використовуючи манжету відповідного розміру АТ, розміщену на правій руці суб’єкта. Вимірювання АТ проводили через 11, 13 та 15 хвилин під час 15-хвилинного періоду релаксації лежачи на спині. Середнє значення останніх двох показань було використано для представлення значень SBP та DBP [10–13].
Збирали зразки периферичної крові натощак у когорті LACHY та зразки периферичної крові, що не приймали голоду, в інших трьох когортах. Зразки шаруватої оболонки та плазми відокремлювали та зберігали при -80 ° C. ДНК витягували з пухкої оболонки. У когорті LACHY рівень глюкози натще вимірювали за допомогою системи Ektachem DT II (Johnson and Johnson Clinical Diagnostics, Рочестер, Нью-Йорк, США), а інсулін натще аналізували у двох примірниках за допомогою специфічного радіоімунологічного аналізу (Linco Research, Inc., St Charles, MO, США) [10]. QUICKI (кількісний індекс перевірки чутливості до інсуліну) розраховували для індексації чутливості до інсуліну за такою формулою: 1/[log (інсулін натще, мкО/мл) + log (глюкоза натще, мг/дл)]. Зі скринінгової вибірки, яка включала сім випадків ожиріння та сім нежирних контролів, вибраних з когорти LACHY, рівні глюкози та інсуліну натще не були доступні для одного випадку та одного контролю.
Шипа метилювання широкого геному
Використовували BeadChip HumanMethylation27 від Illumina (Illumina, Сан-Дієго, Каліфорнія, США). Цей чіп може кількісно виміряти 27 000 сайтів CpG, охоплюючи понад 14 000 добре анотованих генів з роздільною здатністю одного CpG. Кожен чіп вміщує 12 зразків. Після обробки бісульфітом 200 нг перетвореної ДНК ампліфікували цілим геномом (WGA) і ферментативно фрагментували. Перетворені бісульфітом зразки WGA-ДНК очищали і наносили на BeadChips. Обробка зображень та вилучення даних про інтенсивність проводились згідно з інструкцією компанії Illumina http://www.illumina.com/products/infinium_humanmethylation27_beadchip_kits.ilmn. Кожна точка даних метилювання представлена флуоресцентними сигналами від метильованих та неметильованих алелей. Значення бета-метилювання ДНК - це безперервні змінні між 0 (повністю неметильованими) та 1 (повністю метильованими), що представляють відношення інтенсивності типу метильованої кульки до об’єднаної інтенсивності локусу. Початкова обробка масиву та контроль якості виконувались за допомогою програмного забезпечення BeadStudio. Дані про мікрочипи, обговорені в цій роботі, були депоновані в Онібусі генезування генів NCBI і доступні за номером приєднання до серії GEO GSE25301 http://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE25301.
Піросеквенування
Рівні метилювання вибраних шести сайтів CpG із шести генів у когорті реплікації визначали за допомогою технології піросеквенування, швидкого та надійного методу кількісного аналізу метилювання. Після обробки бісульфітом 10 нг перетвореної ДНК використовували в реакції ПЛР для ампліфікації цільової області. Одним з ПЛР-праймерів був мічений біотин. Одноланцюгові біотинільовані ПЛР-продукти готували до секвенування за допомогою інструменту для вакуумної підготовки піросеквенування відповідно до інструкцій виробника. Продукти ПЛР (кожні 10 мкл) секвенували за допомогою системи піросеквенування PSQ96 HS (Піросеквенінг-Qiagen) згідно інструкцій виробника. Статус метилювання кожного локусу аналізували індивідуально як SNP T/C за допомогою програмного забезпечення QCpG (Biotage, Kungsgatan, Швеція). Праймери ПЛР та праймери секвенування для цих шести генів перелічені в Додатковому файлі 1. Усі зразки аналізували в одному і тому ж циклі та у випадковій послідовності.
Статистичний аналіз
Для широкого аналізу метилювання в геномах, пакет Limma [15] був використаний для аналізу кожного сайту CpG на предмет диференціального метилювання між ожирілими та худими суб'єктами. Сайти CpG на хромосомах × та Y були виключені з аналізу. Кожному сайту CpG було присвоєно сировину P-значення на основі модерованої статистики t. Для виправлення для багаторазового тестування набір вихідних даних P-за Бенджаміні та Хохбергом [16] значення були перетворені у показники помилкових відкриттів (FDR). Для шести сайтів CpG у когорті реплікації - Студентський т-Тест був використаний для вивчення того, чи відрізняються рівні їх метилювання між ожирінням та худими групами. Далі використовували лінійну регресію для коригування потенційного впливу віку на рівні метилювання. Ми поєднали загальний геном та кроки реплікації для цих шести сайтів CpG, використовуючи підхід зваженого метааналізу на основі оцінки z, реалізований у пакеті METAL [17]. До аналізу рівні метилювання місць CpG у когорті реплікації були перетворені в журнал або перетворені в квадратний корінь, щоб отримати кращу апроксимацію нормального розподілу. Попередні аналізи, t-тести та регресійні аналізи проводились із використанням STATA 8 (StataCorp, College Station, TX, США).
Аналіз онтології генів проводили за допомогою інструменту FatiGO [18]. FatiGO бере два списки генів і перетворює їх у два списки термінів GO. Потім застосовується точний тест Фішера для таблиць непередбачених ситуацій 2 × 2 для перевірки значного надмірного представлення термінів GO в одному з наборів по відношенню до іншого. Кілька виправлень тестування (індексується скоригованим P-значення) для врахування множинної перевіреної гіпотези (по одній для кожного терміну GO) застосовується для зменшення хибнопозитивних результатів. Оскільки принаймні два сайти CpG були включені для більшості генів у цей чіп широкого геному, ми вибрали сайти CpG з найнижчим значенням p для представлення цього гена.
Результати
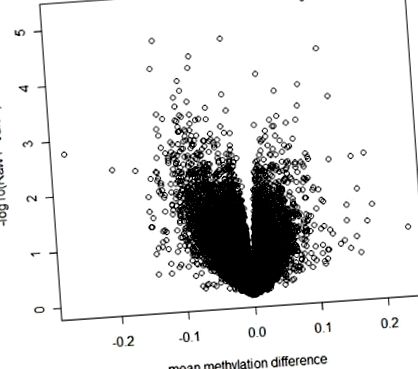
Сюжет вулкана, що показує сирий P- значення проти середньої різниці метилювання між випадками ожиріння та худими контролями.
Незважаючи на те, що піросеквенуючий аналіз був розроблений для націлювання на один конкретний сайт CpG для кожного гена, деякі аналізи охоплювали кілька навколишніх сайтів CpG. Результати цих сайтів CpG також перераховані в таблиці 4. Кореляція між зразками серед множинних сайтів CpG, виміряних в межах гена, перелічена в додатковому файлі 3.
Аналіз генної онтології був проведений, щоб перевірити, чи пов'язані деякі загальні функціональні тенденції у молекулярних функціях та біологічних процесах з генами, що демонструють відмінності між випадками ожиріння та м'яким контролем у чіпі широкого геному. Ми включили ці гени в сировину P ≤ 0,01 до першого списку (n = 298) та включив усі інші гени до другого списку. Як і очікувалося в результаті пілотного дослідження з 14 суб'єктами, ми не спостерігали, щоб жодна категорія GO пережила багаторазове тестування. У таблиці 5 наведено категорії GO із сировиною P-значення менше 0,05. Цікаво, що ми спостерігали збагачені функціональні процеси, які потенційно важливі для запальної реакції з імунною реакцією (GO: 0006955), активацією клітин (GO: 0001775), виробленням цитокінів (GO: 0001816), реакцією на біотичний стимул (GO: 0009607) та антигеном прив'язка (GO: 0003823) серед провідних категорій GO. Результати підтверджують, що ожиріння може призвести до змін метилювання в генах, що беруть участь у запальних шляхах.
Обговорення
У цьому дослідженні ми мали на меті виявити зміни метилювання, пов’язані з ожирінням, у лейкоцитах периферичної крові, використовуючи широкомасштабний підхід у молоді та молодих людей, які не мають супутніх захворювань ожиріння. Основними висновками цього дослідження є підвищення рівня метилювання на одній ділянці CpG в УБАШ3А гена і зниження рівня метилювання на одному сайті CpG в TRIM3 ген у пацієнтів із ожирінням порівняно з худими контролями.
У цього дослідження є кілька сильних сторін. По-перше, ми відібрали випадки ожиріння та засоби контролю з екстремальними фенотипами, що максимізує можливість робити відкриття. По-друге, ми зосередилися на молоді та молодих дорослих з тією очевидною перевагою, що результати не змішуються супутніми захворюваннями ожирінням або вживанням ліків, які дуже часто зустрічаються у дорослих осіб із ожирінням. По-третє, був використаний підхід без генотез без геномів. Цей підхід замінює обмеження, накладені дослідженнями метилювання генів-кандидатів, і дозволяє неупереджено шукати весь геном.
Висновок
У цьому дослідженні ми виявили кілька відтворюваних змін у метилюванні ДНК лейкоцитів периферичної крові між випадками ожиріння та худими контролями. Це дослідження пропонує докази того, що ожиріння пов’язане зі змінами метилювання в ДНК лейкоцитів крові. Потрібні подальші дослідження, щоб визначити причинно-наслідковий напрямок цих стосунків, а також те, чи можуть такі зміни метилювання призвести до порушення імунної функції. Такі дослідження зможуть виявити нові уявлення про етіологію захворювань та забезпечити нові цілі для профілактики захворювань, пов’язаних із ожирінням, таких як серцево-судинні захворювання та діабет 2 типу.
- Регулювання периферичного кровотоку при ожирінні та метаболічному синдромі людини
- Space Adventures - серйозна гра для профілактики ожиріння серед дітей SpringerLink
- Периферичне лікування ожиріння - AptamiR
- Ожиріння та сексуальне функціонування SpringerLink
- Ожиріння та неврози SpringerLink