Змінений сигнал АТФ-калію в мезентеріальних артеріях старих щурів з високим вмістом солі
Меліса А. Уайден
1 кафедра кінезіології Університету Вест Честер, Вест Честер, США,
Білген Басгут
2 Кафедра фармакології, Університет Близького Сходу, Північний Кіпр, Туреччина,
Наталія Кириченко
3 Геріатричні дослідницькі, освітні та клінічні центри, Медичний центр Департаменту у справах ветеранів, Гейнсвілль, США,
4 Кафедра фармакології та терапії, Університет Флориди, Гейнсвілль, США,
Бенедек Ердос
5 Кафедра фармакології, Університет Вермонта, Берлінгтон, США,
Ніхаль Тюмер
3 Геріатричні дослідницькі, освітні та клінічні центри, Медичний центр Департаменту у справах ветеранів, Гейнсвілль, США,
4 Кафедра фармакології та терапії, Університет Флориди, Гейнсвілль, США,
Анотація
[Мета]
І старіння, і споживання дієти з високим вмістом солі пов’язані з чіткими змінами в судинній системі, які можуть призвести до розвитку серцево-судинних захворювань; проте механізми не чітко зрозумілі. Тому ми дослідили, чи старіння та споживання надлишку солі змінюють функцію сигналізації АТФ-залежного каналу калію в мезентеріальних артеріях
[Методи]
Молодих (7 місяців) та старих (29 місяців) щурів Fischer 344 x Brown Brown норвезьку їжу годували контрольним або високосольовим раціоном (8% NaCl) протягом 12 днів, а мезентеріальні артерії використовували для вимірювання судинної реактивності.
[Результати]
Індукована ацетилхоліном релаксація ендотелію була значно знижена у старих артеріях (81 ± 4%) порівняно з молодими артеріями (92 ± 2%). Попередня обробка блокатором калій-АТФ-каналів глібенкламідом знижувала релаксацію до ацетилхоліну в молодих артеріях, але не змінювала дилатації в старих артеріях. На дієті з високим вмістом солі розширення ендотелію до ацетилхоліну значно зменшилось у старих сольових артеріях (60 ± 3%) порівняно зі старими контрольними артеріями (81 ± 4%). Глібенкламід зменшував індуковану ацетилхоліном дилатацію в молодих сольових артеріях, але не впливав на старі сольові артерії. Розширення до кромакаліму, калійного АТФ-каналу, зменшилось у старих сольових артеріях порівняно зі старими контрольними артеріями.
[Висновок]
Ці висновки демонструють, що старіння погіршує ендотелій-залежну релаксацію в брижових артеріях. Крім того, дієта з високим вмістом солі змінює функцію передачі сигналів каналу-АТФ-залежного каналу у старих ізольованих брижових артеріях і впливає на опосередкування релаксаційних стимулів.
ВСТУП
Незалежно від того, як старіння, так і споживання дієти з високим вмістом солі пов’язані з чіткими змінами в судинній системі, які можуть призвести до розвитку серцево-судинних захворювань 1-8. Оскільки серцево-судинні захворювання є основною причиною смертності у великих країнах, механізми, що сприяють змінам, що спостерігаються в судинній системі, мають важливе значення. Артерії малого опору є фізіологічно важливими для регуляції артеріального тиску та місцевого кровотоку, і добре відомо, що старіння та дієта з високим вмістом солі однаково індукують структурні та функціональні зміни в цих артеріях 9-13 .
Однією з основних функціональних змін у судинній системі, яка спостерігається як при нормальному старінні, так і при прийомі великої кількості солі, є дисфункція ендотелію. Ендотеліальні клітини направляють тонус основної судинної гладкої мускулатури, вивільняючи кілька факторів, що діють на розслаблення судини. Оксид азоту (NO), медіатори циклооксигенази (ЦОГ) та похідний від ендотелію гіперполяризуючий фактор (EDHF) діють на розширення артерій опору. З віком зменшення ендотелію-залежної вазодилатації характеризується зниженою агоністичною вазодилатацією 14. Подібним чином, молоді нормотензивні тварини, які харчуються дієтою з високим вмістом солі (ГС), різко послаблюють реакції судинної релаксації 10, 11, 15, 16. Залежне від ендотелію вазорелаксація в аорті та великих проксимальних артеріях майже повністю залежить від NO 14, тоді як EDHF відіграє роль в індукованому агоністами вазорелаксації в артеріях дистального опору, включаючи артерії брижі 17 .
Гіперполяризація через розкриття калієвих каналів є основним механізмом вазорелаксації дрібних судин. АТФ-залежні калієві канали є важливими мішенями медіаторів, що вивільняються з ендотелію 18-20. Калієві АТФ-канали замикаються АТФ і складаються з субодиниць Kir 6 та рецептора сульфонілсечовини 21. Наскільки нам відомо, жодне дослідження не оцінювало комбінований вплив віку та споживання харчової солі на функцію каналу KATP на розширення судин ендотелію. Отже, метою цього дослідження було вивчити вплив віку та дієти при ГС на релаксацію ендотелію в брижовій артерії щурів (МА). Ми припустили, що як вік, так і дієта при ГС призведуть до зменшення розслаблення ендотелію МА. Крім того, ми вірили, що сигналізація каналу АТФ-каналу буде змінена як у віків, так і у щурів, що харчуються ВГ.
МЕТОДИ
Експериментальні тварини та дизайн
Молоді (5 місяців) і старі (27 місяців) самці щурів Fischer 344 x Brown Brown (F344 x BN) були отримані від лабораторій Harlan (Індіанаполіс, штат Індіана, США). Для цих експериментів було обрано щура F344 x BN, оскільки вони живуть довше, ніж штам Wistar або F344, за відсутності специфічних для захворювання аномалій 22. Щурів утримували індивідуально і утримували протягом 12:12 годин циклу світло-темрява (0600-1800 год). Експерименти проводились відповідно до Керівних принципів догляду та використання лабораторних тварин, а процедури були затверджені місцевим інституційним комітетом з догляду та використання тварин.
Щурів випадковим чином розподіляли до однієї з чотирьох груп: (1) молодняк контролю (стандартна дієта щурів; 15% жиру, 3,1 ккал/г; дієта-2018; Харлан Теклад, Медісон, штат Вісконсин, США; n = 8); (2) молода сіль (8% NaCl; 15% жиру; 3,0 ккал/г; TD-92012; Харлан Теклад, Медісон, Вісконсин, США; n = 8); (3) старий контроль (стандартна дієта для щурів; n = 8); та (4) стара сіль (8% NaCl дієта; n = 8). Тварин годували стандартною дієтою та дієтою HS протягом 12 днів, а потім надмірно знеболювали пентобарбіталом (120 мг/кг внутрішньовенно).
Визначення судинної реактивності
Ложе брижової артерії негайно видаляли і поміщали в холодно модифікований розчин бікарбонату Кребса-Рінгера (який містив (в мМ) 118 NaCl, 4,7 KCl, 25 NaHCO3, 1,2 KH2PO4, 1,2 MgSO4, 2,5 CaCl2 і 5,5 глюкози). За допомогою розсікаючого мікроскопа ретельно збирали МА другого порядку. Розділ MA (
Довжиною 2 мм) переносили в камеру посудини, встановлювали її і закріплювали між двома скляними мікропіпетками 10-шовним швом. Камера посудини була перенесена на сцену з перевернутим світловим мікроскопом (Axiovert 100, Zeiss, Thornwood, NY, США), з'єднану з відеоаналізатором розмірів (перемикач Ion Optix, Corporation Hyper). Відеоаналізатор розмірів був підключений як до відеомонітора (для візуалізації судини), так і до комп'ютера для постійного запису внутрішньосвітлового діаметра судини. Кисневий (20% O2 - 5% CO2 - 75% N2) розчин Кребса, підтримуваний при 37 ° C, постійно циркулював через ванну посудини. Крім того, просвіт судини через мікропіпетки заповнювали розчином Кребса. Випускна канюля була затиснута, тоді як припливна канюля була з'єднана з піднятим резервуаром, щоб підтримувати постійний внутрішньосвітловий тиск 80 мм рт.ст. У розчин для ванни додавали ліки, і на один артеріальний сегмент проводили лише один експеримент із реакцією на концентрацію.
Для полегшення аналізу реакцій розширення були додані відповідні кількості фенілефрину (ПЕ) для звуження артерій приблизно до 60% від їх початкового діаметра. Це забезпечило широкий діапазон для аналізу змін діаметра під час релаксації та забезпечило подібний рівень початкового звуження судин. Не було суттєвих відмінностей у відповідях молодих та старих або хворих на ХС артерій щурів на ПЕ, і ми додали однакову кількість ПЕ до всіх артерій (10 -6 М). Експериментальні протоколи не ініціювали, поки діаметр судини не був стабільним протягом 15-хвилинного періоду.
Ми протестували ендотелій-залежну релаксацію, проводячи експерименти з реакцією концентрації з ацетилхоліном (ACh; 10 -8 M - 10 -5 M). Як правило, МА піддавали дії кожної дози АЧ протягом принаймні 6 хвилин і визначали максимальні відповіді. Функцію каналів KATP досліджували за допомогою 10 мкМ глібенкламіду (селективний інгібітор каналу KATP) та cromakalim (від 10 -8 M до 10 -4 M), що відкриває канали KATP. Додавання глібенкламіду в артеріальну ванну за 10 хвилин до АЧ не змінило пасивних максимальних внутрішніх діаметрів будь-яких МА у наших групах.
Зміни діаметра судини представлені у відсотках (%) розширення попередньо звужених судин, розраховані наступним чином:% розширення судин = [(Дагоніст - Dbase)/(Dmax-Dbase)] x100, де Dmax - максимальний діаметр судини під час рівноваги Dbase - це діаметр судини при стаціонарному скороченні, спричиненому РЕ, до індукованого препаратом релаксації, а Dagonist - діаметр судини після лікарської стимуляції. За допомогою цього методу максимальне розширення представляється як 100%, а вихідний діаметр - 0% 23 .
Хімікати
ACh, PE та глібенкламід отримували від Sigma (Сент-Луїс, Міссурі, США), тоді як cromakalim - від Tocris Cookson (Бристоль, Великобританія). Всі препарати розчиняли у розчині Кребса, за винятком кромакаліму, який розчиняли у 10% розчині ДМСО та Кребса. Однакова концентрація DMSO сама по собі не впливала на діаметр посудини.
Оцінка вираження каналу K + за допомогою Вестерн-блот
Мезентеріальні артерії гомогенізували та аналізували для кількісного визначення рівнів білка субодиниць каналу KATP. Зразки тканин гомогенізували в 50 мМ Трис (рН 7,0) з вмістом лейпептину, а вміст білка оцінювали за допомогою аналізу білка DC (Bio-Rad, Hercules, CA, USA). Рівну кількість білка для кожного зразка відокремлювали електрофорезом у поліакриламідному гелі через 12,5% градієнтні поліакриламідні гелі, що містять 0,1% додецилсульфату натрію для
1 год при 100 мА. Після електрофорезу білки переносили в нітроцелюлозні мембрани при 90 В протягом 1:30. Для контролю різниці завантаження та переносу білків мембрани фарбували Понсо S і аналізували. Мембрани промивали і згодом блокували 5% знежиреним молоком у забуференному Tris фізіологічному розчині, що містить 0,1% Tween 20, протягом 1 години при кімнатній температурі, а потім інкубували протягом ночі при 4 ° C з первинним антитілом (анти-Kir6.1 або анти-Kir6 .2; Santa Cruz Biotechnology Inc, Даллас, Техас, США, розведення 1: 500). За цим кроком слідувала інкубація при кімнатній температурі з вторинним антитілом (ослиний анти-козячий IgG-HRP; Santa Cruz Biotechnology Inc) протягом 1 години. Всі зв’язані антитіла виявляли за допомогою хеміфлуоресценції (ECL Plus Western Blotting Detection System; GE Healthcare), сканували (Storm 860 Phosphorimager Scanner; GE Healthcare) та аналізували за допомогою програмного забезпечення Image Quant.
Статистичний аналіз
Таблиця 1.
| Вік (місяці) | 5 | 5 | 27 | 27 |
| Вага (г) | 434 ± 13 | 401 ± 23 | 581 ± 31 * # | 576 ± 14 * # |
| Максимальний діаметр посудини (мкм) | 362 ± 10 | 334 ± 8 | 331 ± 9 | 373 ± 11 |
| Обмеження на ПЕ (%) | 60 ± 4 | 59 ± 3 | 55 ± 4 | 54 ± 5 |
Дані є середніми ± SE
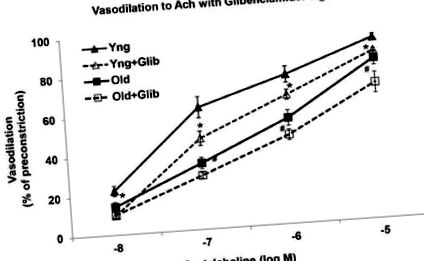
Індукована ACh вазорелаксація була значно знижена у старих МА порівняно з молодими артеріями (рис. 1). Релаксація до АЧ при кожній досліджуваній концентрації (від -8 М до -5 М) була значно знижена у старих контрольних МА порівняно з молодими контрольними артеріями (Р -5 М) становила 92 ± 2% у молодих контрольних МА і лише 81 ± 4% у старих контрольних артеріях (P Рисунок 1). Релаксація до ACh (10 -5 М) становила 60 ± 3% у старих сольових МА проти 81 ± 4% у старих контрольних артеріях (Р * Значно зменшилася порівняно з Янг-контролем (Р # Значно зменшилася порівняно зі старим контролем (Р Малюнок 2). Максимальна релаксація до ACh становила 92 ± 2% та 85 ± 1% у молодих контрольних артеріях з глібенкламідом та без нього, відповідно. На відміну від цього, у старих артеріях попередня обробка глібенкламіду не мала жодного впливу на вже зменшені реакції судин, викликані ACh ( Малюнок 2). Релаксація при -5 М Ач становила 81 ± 3% у старих МА та 69 ± 5% у старих МА, попередньо оброблених глібенкламідом.
ОБГОВОРЕННЯ
Ці експерименти дають важливу інформацію щодо ролі каналів KATP на функцію ендотелію у вікових щурів, які харчуються дієтою з високим вмістом солі. Основними висновками цього дослідження є: (1) залежність від ендотелію вазорелаксації зменшується у вікових щурів і в подальшому порушується на дієті з високим вмістом солі, (2) Канали KATP сприяють ендотелію-залежній релаксації, що викликається Ach у молодих брижових артеріях, однак у старих артерій, релаксація, опосередкована цими іонними каналами, відсутня, і (3) функціонально дефектна сигналізація каналу KATP може сприяти віковому та високосольовому дієтологічному порушенню функції ендотелію.
Канали KATP відіграють важливу роль в індукованій агоністами вазорелаксації в малих артеріях опору. Відкриття калієвих каналів на гладком'язових клітинах судин з отриманою гіперполяризацією відіграє центральну роль в артеріях дистального опору. Показано, що ACh активує ці іонні канали в кількох циркуляційних руслах. У цьому дослідженні ми використовували глібенкламід для блокування відкриття каналу KATP, а в молодих (контрольних та високосольових артеріях) релаксації, спричиненій ACh, було значно знижено. Цей висновок дає докази того, що канали KATP сприяють дилатації, викликаній ACh, у брижових артеріях молодих щурів. Однак на зменшення релаксації, спричиненої ACh, у старих (контрольних та високосольових) артеріях застосування глібенкламіду не впливало далі. Таким чином, ці дані демонструють, що ослаблене розширення, викликане ACh у старих тварин, здається, обумовлене порушенням сигналізації та/або активації каналу KATP.
Потрібне подальше дослідження, щоб з'ясувати, як зміни у старих щурів, що харчуються високою кількістю солі, впливають на функцію цих K + каналів гладком'язових клітин судин. Однією з можливостей є те, що вік у поєднанні з дієтою з високим вмістом солі збільшує продукцію активних форм кисню (АФК) у судинній тканині, що впливає на структуру та активність цих іонних каналів. Наступні докази підтверджують цю гіпотезу. По-перше, було доведено, що вироблення супероксиду підвищено в брижових артеріях як старих, так і щурів із високим вмістом солі. По-друге, опосередковані релаксації каналів K + порушуються в патофізіологічних умовах, коли відбувається надмірна продукція АФК, наприклад, під час ішемії-реперфузії 31, 32, травми головного мозку 33, 34 або гіперглікемії 35, 36. Таким чином, порушення калійного АТФ-каналу, опосередкованого судинною реакцією у старих мезентеріальних артеріях, що харчуються високою кількістю солі, також може бути наслідком підвищеного вироблення АФК.
На закінчення результати цього дослідження показують, що надмірне споживання солі під час нормального старіння суттєво погіршує функцію сигналізації каналу KATP в мезентеріальних артеріях щурів, а змінена сигналізація цих каналів впливає на посередництво ендотелію-залежної релаксації. Змінена судинна регуляція може бути причиною підвищеного артеріального тиску та підвищеного ризику серцево-судинних подій у людей похилого віку, особливо тих людей, які щодня вживають надлишок солі.
Подяка
Цю роботу підтримали Служба медичних досліджень Департаменту у справах ветеранів (д-р Ніхал Тумер), Національний інститут старіння T32> AG000196 (д-р Меліса Уайден), TUBITAK (д-р Білген Басгут) та Американська асоціація серця (Доктор Бенедек Ердос).
- 47 способів використання ріпи - Садівничий канал
- 10 найкращих диванів для важких людей 2020- (велика місткість)
- Коробка смачних найкращих дегустаційних батончиків UNJURY® з високим вмістом білка, 12 упаковок
- Підсилюйте VHC (дуже калорійна) ваніль 237 мл (8 жидких унцій
- Калорії спалили TRX (висока інтенсивність) Nutracheck