Зменшення ожиріння алантоїном через імідазолін I1-Активація рецепторів у мишей із високим вмістом жиру, що харчуються дієтою
1 Інститут основних медичних наук, Медичний коледж, Національний університет Ченг Кунга, місто Тайнань 70101, Тайвань
2 Кафедра хірургії, Гаосюнська муніципальна лікарня Сяо-Кан і Медичний університет Гаосюна, місто Гаосюн 81201, Тайвань
3 Інститут медичних наук, Коледж медичних наук, Християнський університет Чанг Юнг, Гуей-Рен, місто Тайнань 71101, Тайвань
Анотація
Відомо, що активація імідазолінового I1-рецептора (I1R) регулює апетит. Повідомлялося, що алантоїн, активний інгредієнт ямсу, покращує метаболізм ліпідів у мишей, що харчуються з високим вмістом жиру (HFD-). Однак вплив алантоїну на ожиріння залишається незрозумілим. У цьому дослідженні ми досліджували вплив алантоїну на ожиріння, спричинене HFD. Хронічне введення алантоїну мишам, яким годували HFD, протягом 8 тижнів суттєво знижувало масу їх тіла, і цей ефект був скасований ефароксаном у дозі, достатній для блокування I1R. Розмір і вага клітин білої жирової тканини епідидиму (eWAT) у мишей, що харчуються HFD, також зменшувалися алантоїном через активацію I1R. Крім того, алантоїн значно зменшив споживання енергії мишами, що харчуються HFD, і це зниження було пов’язане зі зниженням рівня NPY у мозку. Однак ніякого інгібуючого впливу алантоїну на споживання енергії у мишей db/db не спостерігалося. Більше того, алантоїн знижував індуковану HFD гіперлептинемію, і ця активність була скасована блокадою I1R ефароксаном. У сукупності ці дані свідчать про те, що алантоїн може покращити споживання енергії та накопичення eWAT, активуючи I1R для поліпшення ожиріння, спричиненого HFD.
1. Вступ
Ожиріння є основною проблемою для здоров'я. Це провідна причина метаболічного синдрому, і його поширеність у всьому світі зросла протягом 21 століття [1–3]. Ожиріння пов'язане з підвищеним ризиком багатьох ускладнень, таких як серцево-судинні захворювання, діабет 2 типу та деякі типи раку [4, 5]. Фізичні вправи, обмеження дієти та прийом ліків є основними способами поліпшення ожиріння [6–8], але їх ефективність залишається обмеженою. Деякі дослідження показали, що деякі рослинні засоби мають ефект ожиріння [9, 10]. Таким чином, необхідна розробка альтернативного засобу для лікування ожиріння.
Алантоїн відомий як активний інгредієнт ямсу (Діоскорея spp.) [11]. Ямс (Кореневище діоскореї) містить уреїди, включаючи алантоїн, які використовуються для попередження запалення [12, 13]. Ямс - поширена рослина, яка широко використовується в сільському господарстві та в фармацевтичній промисловості. Нещодавно було показано, що деякі трави з Dioscoreaceae покращують симптоми метаболічних захворювань завдяки антигіперліпідемічній та антиоксидантній діям [14, 15]. Показано, що алантоїн активує імідазоліновий I1-рецептор (I1R) на тваринних моделях та клітинних лініях [16]. Крім того, алантоїн послаблює гіперліпідемію та покращує стеатоз печінки завдяки активації I1R для регуляції рецептора фарнезоїду X (FXR), демонструючи, що I1R бере участь у ліпідному гомеостазі [16]. Однак вплив алантоїну на ожиріння залишається неясним. Таким чином, у цьому дослідженні ми досліджували вплив алантоїну на ожиріння, спричинене дієтою (HFD-), та потенційні механізми, що лежать в основі його активності.
2. Матеріали та методи
2.1. Індукція ожиріння у HFD-мишей
Вісім тижневих самців мишей C57BL/6 (20–25 г), отриманих з Центру тварин Національного медичного коледжу університету Ченг Кунга, утримувались у приміщенні з контрольованою температурою (25 ± 1 ° C) протягом 12: 12 год. світло: темний цикл (світло вмикається о 06:00 год). Мишей розділили на дві групи. Одну групу годували стандартною лабораторною дієтою (3,04 ккал/г), а іншу групу - висококалорійною дієтою, що містила 5,16 ккал/г (TestDiet, Річмонд, США, США) протягом 12 тижнів, щоб викликати ожиріння та метаболізм розлади. Мишей db/db отримували від Japan SLC, Inc. (Шидзуока, Японія). Всі процедури на тваринах проводились відповідно до Керівництва з догляду та використання лабораторних тварин Національного інституту охорони здоров’я, а також до вказівок Закону про захист тварин.
2.2. Вимірювання маси тіла та споживання енергії
У попередніх експериментах алантоїн (Sigma-Aldrich, Сент-Луїс, Міссурі, США) зменшував масу тіла мишей, яких годували HFD. Його активність поступово зростала і досягла стабільного плато через 8 тижнів. Таким чином, мишей, яких годували HFD, обробляли алантоїном тричі на день протягом 8 тижнів, а масу тіла вимірювали на початковому рівні (0 тижнів) та на 2-му, 4-му, 6-му та 8-му тижнях експерименту. Крім того, щоденне споживання енергії розраховувалося на основі споживання нормальної чау (3,04 ккал/г) або HFD (5,16 ккал/г).
2.3. Вимірювання споживання енергії у db/db мишей
Мишей позбавляли їжі протягом ночі протягом 12 год (8 вечора – 8 ранку). Мишей зважували, а потім внутрішньочеревно вводили або носій, або алантоїн перед подачею їжі. Кожна миша трималася в ізоляції в клітці. Споживання енергії розраховували протягом 4 год, як описано раніше [17].
2.4. Вимірювання епідидимальних білих жирових тканин
В кінці експериментального періоду мишей забивали під 3% анестезією ізофлураном. Білі жирові тканини епідидиму (eWAT) були виділені та зважені. Потім коефіцієнт eWAT розраховували щодо маси тіла кожної людини.
2.5. Імуносорбційний аналіз на рівні NPY
Гіпоталамус виділяли з пожертвованих мишей та визначали концентрацію NPY. Отримані зразки гомогенізували при 4 ° С в крижаному буфері для гомогенізації, що містить 10 мМ Трис-HCl (рН 7,4), 20 мМ ЕДТА, 10 мМ ЕГТА, 20 мМ
-гліцеролфосфат, 50 мМ NaF, 50 мМ пірофосфат натрію, 1 мМ фенілметилсульфонілфторид, 25
г/мл лейпептину і 25 μг/мл апротиніну - інгібітори протеази в гомогенізаторі тефлон/скло. Гомогенат центрифугували при 6000
g протягом 20 хв при 4 ° C, а супернатант використовували для кількісного визначення NPY. NPY у кожній пробі вимірювали за допомогою комерційно доступного імуноферментного аналізу на мишах (Phoenix Europe GmbH, Карлсруе, Німеччина). Поглинання вимірювали в зчитувачі ELISA SpectraMax 340PC (Molecular Devices Corporation, Union City, CA, USA) при 450 нм.
2.6. Визначення рівня лептину
Мишей голодували протягом 12 год і знеболювали. Зразки крові відбирали з ретро-орбітальних пазух кожної групи. Потім зразки крові центрифугували при 3000 об/хв протягом 10 хв. Потім концентрацію лептину визначали за допомогою імуноферментного аналізу (ІФА). Відповідно до процедури аналізу, визначення лептину у зразках проводили за допомогою комерційно доступного набору ІФА для мишей (Assaypro, Сент-Чарльз, Міссурі, США). Поглинання вимірювали за допомогою зчитувача ELISA SpectraMax 340PC (Molecular Devices Corporation, Union City, CA, USA) при 450 нм.
2.7. Гістологічний аналіз
Білі жирові тканини епідидиму видаляли з кожної групи мишей і фіксували у 10% формальдегіді при 4 ° C протягом 2 днів. Фіксовані зразки зневоднювали і вкладали у парафін. Потім зразки розрізали на ділянки товщиною 5 м з інтервалом у 50 м і фарбували гематоксиліном та еозином (H та E; Muto Pure Chemicals, Токіо, Японія). Зрізи спостерігали під світловим мікроскопом.
2.8. Статистичний аналіз
Всі значення представлені як середнє значення ± SEM від однієї групи тварин або зразків. Для оцінки будь-яких суттєвих відмінностей між групами використовували дисперсійний аналіз та пост-хост-тест Даннета.
вважалося, що це свідчить про значну різницю.
3. Результати
3.1. Вплив алантоїну на масу тіла у HFD-мишей
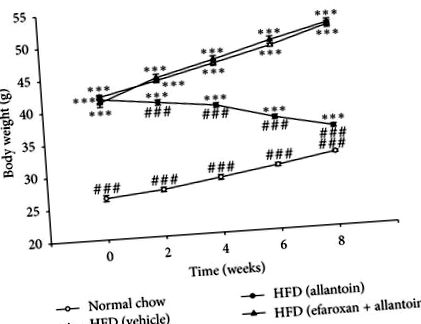
Як показано на малюнку 1, миші, яких годували HFD протягом 3 місяців, продемонстрували помітне () збільшення маси тіла (42,00 ± 0,34 г,
) порівняно із звичайними мишами, яких годували чау (26,38 ± 0,44 г,). Середня маса тіла мишей, що годували HFD, які отримували інтраперитонеальні ін’єкції алантоїну (5 мг/кг) тричі на день протягом 8 тижнів, була значно знижена порівняно з масою мишей, що годували HFD (35,38 ± 0,26 г проти 51,00 ± 0,44 г,). Індуковане алантоїном зменшення маси тіла послаблювалось внутрішньочеревною ін'єкцією ефароксану в дозі (1,5 мг/кг), достатній для блокування імідазолінових I1-рецепторів [17].
в порівнянні з нормальною групою, яку годували чау, у той же момент часу;
3.2. Поліпшення епідидимальної білої жирової тканини (eWAT) у HFD-мишей від Алантоїну
Як показано на малюнку 2, HFD суттєво індукував ожиріння у мишей. Розмір клітин білої жирової тканини епідидиму (eWAT) у мишей, що годували HFD, був більшим, ніж у звичайних мишей, що годували чау. Алантоїн покращив ці зміни в eWAT. Попередня обробка ефароксаном змінила розподіл та типи eWAT до такої для групи HFD, вказуючи на те, що активність алантоїну була скасована ефароксаном (рис. 2). Алантоїн також зменшив вагу eWAT, і це зменшення може бути скасовано шляхом попередньої обробки ефароксаном. Співвідношення eWAT також демонструвало однакову закономірність (Таблиця 1).
3.3. Залучення імідазоліну I1-рецепторів до індукованого алантоїном зменшення споживання енергії
Внутрішньочеревна ін’єкція алантоїну (5 мг/кг) тричі на день протягом 8 тижнів помітно знижувала споживання енергії мишами, що харчуються HFD, з 18,77 ± 1,52 ккал/г/день до 11,29 ± 0,47 ккал/г/день (Рисунок 3) . Попередня обробка ефароксаном (1,5 мг/кг, i.p.) скасувала цю активність. Однак лікування лише ефароксаном не впливало на споживання енергії мишами, що харчуються HFD.
порівняно з нормальною групою, яку годували чау;
3.4. Зміни рівня нейропептиду Y (NPY) у гіпоталамусі HFD-мишей
Як показано на малюнку 4, рівень гіпоталамусової NPY у мишей, що годували HFD, помітно знижувався при обробці алантоїном (5 мг/кг, i.p.) протягом 8 тижнів. Попередня обробка ефароксаном (1,5 мг/кг внутрішньовенно) за 30 хв до введення алантоїну скасувала цю зміну гіпоталамусу NPY (рис.4).
порівняно з нормальною групою, яку годували чау;
3.5. Алантоїнова активність у db/db мишей
Як показано на малюнку 5, споживання енергії помітно зросло у мишей db/db. Однак ін'єкція алантоїну (5 мг/кг, i.p.) мишам db/db не зуміла змінити споживання енергії порівняно з мишами db/db, обробленими носієм. Це вказує на те, що інгібуючий ефект алантоїну на споживання енергії зник у db/db мишей.
3.6. Поліпшення гіперлептинемії алантоїном у мишей, хворих на HFD
Введення алантоїну (5 мг/кг, внутрішньовенно, три рази на день) протягом 8 тижнів суттєво знижувало рівень лептину в плазмі крові у мишей, що годували HFD (табл. 2). Це зменшення послаблювалось попередньою обробкою ефароксаном (1,5 мг/кг внутрішньовенно) через 30 хв до введення алантоїну.
4. Обговорення
У цьому дослідженні ми виявили, що алантоїн спричиняв помітне зниження маси тіла та покращував накопичення eWAT та споживання енергії у мишей, що годувались HFD. Ця дія алантоїну проти ожиріння була скасована блокадою I1R. Ці результати вказують на те, що алантоїн може покращити ожиріння, спричинене HFD, шляхом активації I1R.
Вміст жирової тканини тісно пов’язаний із ожирінням, а eWAT широко використовується як показник при дослідженні ожиріння [18, 19]. У цьому дослідженні алантоїн ефективно зменшував розмір клітини eWAT (рисунок 2) та вагу (таблиця 1) завдяки активації I1R. Ця дія алантоїну на eWAT ефективна у дозі, подібній дозі, необхідній для поліпшення стеатозу печінки у мишей, що харчуються HFD [16]. Таким чином, можна вважати, що алантоїн впливає на ліпідний гомеостаз шляхом активації I1R [16].
-MSH) та рецептори меланокортину-3 (MC3) [46, 47]. Таким чином, детальний механізм дії алантоїну при ожирінні, спричиненому ВЧР, вимагає подальших досліджень у майбутньому.
5. Висновки
Ми виявили, що алантоїн впливає на ожиріння у мишей, що харчуються HFD, і що ці ефекти опосередковані активацією I1R, що призводить до нижчого споживання енергії та зменшення накопичення eWAT. Таким чином, алантоїн можна використовувати як альтернативний засіб для поліпшення ожиріння в майбутньому.
Скорочення
Внесок авторів
Сянь-Хуей Чун і Кунг Шинг Лі внесли однаковий внесок у цю статтю.
Подяка
Учасники дякують доктору К. Ченгу та пану К. Ф. Лю за вмілу допомогу в цих експериментах. Дане дослідження фінансувалось головним чином грантом Національної ради з питань наук (NSC 99-2628-B309-001-MY3) Тайваню.
Список літератури
- Дієтичне ожиріння сприяє розвитку пухлини товстої кишки у мишей, які отримували азоксиметан
- Вплив Enterococcus faecalis FK-23 на проти ожиріння у мишей із ожирінням, спричинених дієтою
- Рівень злочинності пов'язаний з високим кров'яним тиском, ожирінням - UChicago Medicine
- Список профілактики ожиріння серед дітей Перелік статей із сильним впливом PPts Журнали Відео
- ERAPSO виявляє високий тягар ожиріння у німецьких хворих на псоріаз - PubMed