Журнали діабету та ожиріння Наукові журнали діабету
Кафедра токсикології Інституту фармакології та токсикології Національної академії медичних наук України, Україна
Подання: 26 жовтня 2017 р .; Опубліковано: 14 листопада 2017 року
*Відповідний автор: Бондаренко Лариса Борисівна, кафедра токсикології, Інститут фармакології та токсикології Національної академії медичних наук України, вул. Євгена Поттіє, 14, Київ, 03680, Україна, тел: + 38067-683-2659; Електронна адреса: [email protected]
Як цитувати цю статтю: Бондаренко L B, Шаяхметова G M, Вороніна A K, Коваленко V M. Вплив метформіну на функціонування цитохромів CYP3А, CYP2С та CYP2Е1 при метаболічному синдромі у щурів різного віку. Curre Res Diabetes & Obes J. 2017; 4 (4): 555645. DOI: 10.19080/CRDOJ.2017.04.555645
Анотація
Метою нашого дослідження було провести комплексну оцінку метаболічного синдрому (МС) та опосередкованих метформіном змін у експресії мРНК CYP3А, CYP2С, CYP2Е1 та активності відповідних маркерних ферментів, як тільки антиоксидантна система печінки та параметри перекисного окислення ліпідів дорослих та пубертатні щури.
Самці щурів-альбіносів Wistar двох вікових категорій (молоді тварини 21-денного віку (50-70г) та дорослі (160-180г)) були розділені на 6 груп (по 8 тварин у кожній): 1 -Контроль 1 (інтактні молоді щури); 2 -Контроль 2 (інтактні дорослі щури); 3 -MS3 (молоді щури з РС); 4 -MS4 (дорослі щури з РС); 5 -MS3 (молоді щури з MS + метформін); 6 -MS4 (дорослі щури з MS + метформін). Модель метаболічного синдрому була індукована повною заміною питної води 20% розчином фруктози (200 г/л). Через 60 днів моделювання РС проводили дослідження експресії мРНК печінки CYP3А, CYP2С та CYP2Е1 печінки щурів, активність їх ферментних ферментів, а також параметри перекисного окислення ліпідів.
Було продемонстровано, що введення метформіну знижувало експресію мРНК CYP3А та його ферментну активність у щурів з РС, але не могло нормалізувати відповідні показники CYP2Е1 та CYP2C у пубертатних тварин. Одночасно активність глутатіонтрансферази та редуктази також нормалізувалась під введенням метформіну з РС. Зміщений у печінці вміст глутатіону залишався значно зниженим у пубертатних тварин, тоді як у дорослих виявлено більш виражений нормалізуючий ефект метформіну щодо перекисного окислення ліпідів. Таким чином, метформін продемонстрував вікову ефективність для нормалізації швидкості експресії ізоформ цитохрому Р-450, а також системи глутатіону та швидкості перекисного окислення ліпідів. Відсутність інформації про вікові відмінності впливу метформіну на стан систем CYP450 та глутатіону при РС робить ці дані значущими. Отримані результати свідчать про необхідність оптимізації та індивідуалізації фармакотерапії РС залежно від віку пацієнтів.
Ключові слова: Метаболічний синдром; Метформін; CYP450; Пубертатний; Дорослий; Щури
Скорочення: МС: метаболічний синдром; CYP: цитохром P450; PNP: P-нітрофенол гідроксилаза; LPO: перекисне окислення ліпідів; TBARS: речовина, що реагує на тіобарбітурову кислоту; bp: Базові пари
Вступ
Розвиток метаболічного синдрому (РС) супроводжується значним зрушенням у системі CYP450 [1], метаболізуючи більшість ліків. Одночасно зі специфічним впливом РС на експресію та активність CYP450, ліки, що використовуються для лікування РС, також можуть мати значний вплив на ці параметри. Таким чином, метформін (широко застосовуваний для лікування РС) здатний інгібувати експресію CYP17A1 [2]. Він суттєво пригнічує експресію стероїдогенного регуляторного білка (StAR) та 17α-гідроксилази (CYP17А1) [3]. Серія експериментів з різними індукторами та інгібіторами ізоформ CYP450 дозволила з'ясувати їх роль у метаболізмі метформіну у щурів [4]. Згідно з отриманими результатами метформін у щурів метаболізується переважно через печінкові CYP2C11, 2D1 та 3A1/2. Інші автори також показали, що в гепатоцитах щурів мікросомальна фракція 2C11, 2D1 і 3A1, але не CYP1A2, 2B1/2 і 2E1, бере участь у метаболізмі метформіну [5].
Оцінка комплексного впливу МС та ліків для його лікування на різні ізоформи CYP450 може представляти особливий інтерес, оскільки дозволяє визначити додаткові модифікуючі компоненти для метаболічних взаємодій препаратів, віднесених до цієї патології. Однак така інформація обмежена кількома дослідженнями на дорослих [2,3] без урахування метаболічних характеристик дітей та підлітків. Наші попередні результати вказували на існування деяких вікових особливостей цитохромів CYP3А, CYP2С та CYP2Е1, що функціонують при метаболічному синдромі [6]. Метою нашого даного дослідження було провести комплексну оцінку опосередкованих РС та метформіном змін в експресії мРНК CYP3А, CYP2С, CYP2Е1 та відповідних активності ферментів-маркерів, як тільки антиоксидантна система печінки та параметри перекисного окислення ліпідів дорослих та пубертатних щурів із РС.
Матеріали і методи
Рівні перекисного окислення ліпідів (LPO) у мікросомах печінки досліджували як швидкість утворення НАДФН-залежних реакційноздатних речовин тіобарбітурової кислоти (TBARS) [18]. Отримані дані виражали як середнє значення ± стандартна похибка середнього значення (M ± SEM) та аналізували одностороннім дисперсійним аналізом (ANOVA) з подальшим тестом Тукі з використанням програмного забезпечення Origin Pro 7.5. Різниці вважалися статистично значущими при p Go to
- Стаття дослідження
- Анотація
- Вступ
- Матеріали і методи
- Результати і обговорення
- Висновок
- Список літератури
Результати і обговорення
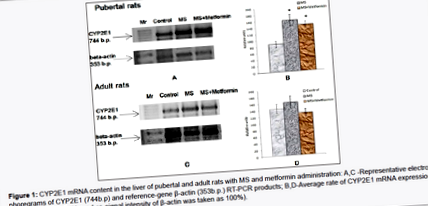
Порівняльне дослідження експресії мРНК CYP2E1 у печінці пубертатного та дорослого щурів із застосуванням МС та метформіну продемонструвало більш виражені зміни у групах молодих щурів (рис. 1). Експресія мРНК CYP2E1 була збільшена як у групі пубертатних тварин з РС (1,8 рази порівняно з контролем), так і у групі пубертатних тварин з РС та введенням метформіну (в 1,7 рази порівняно з контролем). Зміни цих параметрів у групах дорослих тварин не були статистично значущими.
Результати дослідження експресії мРНК CYP3A2 у печінці пубертатного та дорослого щурів із введенням МС та метформіну також продемонстрували більш виражені зміни у групах молодих щурів (рис. 2). МС спричинив статистично значущий ріст експресії мРНК CYP3A2 у групи пубертатних тварин, тоді як введення метформіну призвело до нормалізації цього параметра. Як і у випадку з CYP2E1, зміни експресії гена CYP3A2 у групах дорослих тварин суттєво не відрізнялися від контролю.
У випадку CYP2C23 ми виявили зниження рівня експресії мРНК у печінці обох вікових груп із РС порівняно з контролем: пубертатні тварини -1,4 рази, дорослі -1,6 рази (рисунок 3). Введення метформіну дозволяло нормалізувати швидкість експресії мРНК CYP2C23 лише у групі дорослих тварин. У групі пубертатних тварин такий ефект метформіну відсутній. Ми досліджували активність PNP-гідроксилази в мікросомах печінки дорослих та пубертатних щурів із застосуванням РС та метформіну. Статистично значуще зростання активності PNP-гідроксилази при РС було виявлено як у пубертатному (1,6 рази), так і у дорослого (1,38 рази) групах тварин (табл. 1).
Одночасно зі змінами метаболізму глутатіону посилювались процеси LPO у клітинах печінки дорослих щурів (рис. 4). На це вказували підвищені показники виробництва реакційноздатних речовин тіобарбітурової кислоти, що залежить від NADPH (+ 30%). У пубертатних щурів цей параметр залишався незмінним. Біотрансформація є важливою частиною реалізації лікарських засобів на фізіологічні системи організму [19]. В результаті біотрансформації можуть з'являтися не тільки біологічно активні та неактивні метаболіти, а й цитотоксичні реактивні проміжні сполуки [19]. Основними характерними ознаками ферментів, які беруть участь у процесах біотрансформації, є не тільки значна індивідуальна мінливість їх швидкості та індуцибельності під впливом ендогенних та екзогенних агентів, але також наявність великої різноманітності механізмів регулювання експресії та ізоформ [20].
Серед цього патологічні процеси, які є предметом фармакотерапії, можуть також суттєво змінити швидкість процесів біотрансформації. Раніше ми продемонстрували, що під час розвитку РС рівні експресії певних ізоформ цитохрому Р-450 сильно порушувались одночасно із системою глутатіону [6]. Зміни досліджуваних параметрів залежали від віку та були більш глибокими у пубертатних щурів з РС.
Цілком очевидним є той факт, що для ефективної та безпечної фармакотерапії РС слід точно знати профілі ізоформ CYP450 з цим патологічним станом. Ситуація ускладнюється тим фактом, що одночасно беруть участь не тільки різні ізоформи CYP450, але й те, що більшість ліків метаболізується кількома шляхами, що також включає кілька ізоформ [19,20]. Наприклад, було продемонстровано, що метаболізм метформіну в печінці щурів залучає ізоформи CYP2С та CYP3А [21]. Таким чином, для оптимізації фармакотерапії абсолютно необхідна комплексна оцінка впливу МС та препаратів для його впливу на профілі експресії ізоформ CYP450 2E1, 3A2 та 2C23. При цьому врахування глибокого збільшення РС у педіатричній популяції оцінка вікових особливостей цих ефектів представляє особливий інтерес.
Отримані нами результати щодо підвищення експресії гена CYP2E1 у пубертатних щурів як при РС, так і при введенні метформіну, що узгоджуються з даними інших авторів, показали більшу активність CYP2E1 у лабораторних тварин та людей із ожирінням (один із ключових факторів РС) [22,23]. У пубертатних щурів введення метформіну не дозволяло експресії гена CYP2E1 знижуватись до статистично значущого рівня. У випадку дорослих тварин з введенням метформіну рівні експресії гена CYP2E1 залишалися на рівні контролю. Слід зазначити, що в експериментах інших авторів також була продемонстрована здатність метформіну зменшувати експресію мРНК CYP2E1 у печінці дорослих нецукрових діабетиків з неалкогольним стеатогепатозом [24].
Слід підкреслити, що зміни активності PNP-гідроксилази (фермент-маркер CYP2E1) у мікросомальній фракції печінки пубертатних щурів (як при РС, так і при введенні метформіну при РС) повністю відповідали нашим даним щодо експресії гена CYP2E1. Раніше ми продемонстрували вікові залежності різниці ефектів РС на показники експресії гена CYP2E1 та ферментну активність CYP2E1 [20]. Таку саму ситуацію ми відзначали у випадку введення метформіну пубертатному та дорослому щурам. Пам'ятаючи про великі вікові відмінності у функціонуванні системи CYP450 [25] та попередні наші дані [20], слабку інтенсифікацію експресії CYP2E1 з наступною статистично значущою стимуляцією активності відповідного маркера ферменту у дорослих тварин (як при РС, так і при введенні метформіну при МС ), очікувалося. Такі зміни можливо здійснити за допомогою деяких посттрансляційних механізмів [26].
Ефекти введення метформіну на експресію гена CYP3A2 як у печінці пубертатного, так і у дорослих щурів повністю відповідали його впливу на активність ферментного маркера CYP3A2. Оскільки рівні експресії гена CYP3A2 у пубертатного та дорослого щурів, рівні активності еритроміцин-N-деметилази в обох вищезазначених групах не відрізнялися від контролю. Такий ефект метформіну на CYP3A2 може бути реалізований завдяки його впливу на PXR, CAR, VDR та GR, що регулює експресію гена CYP3A [27]. Наші припущення узгоджуються з даними, отриманими іншими авторами з використанням гепатоцитів людини, де метформін інгібував експресію CYP3A4 та PXR-цільового гена завдяки регуляції SHP [27]. Слід зазначити, що PXR також регулює експресію кількох інших метаболізуючих препаратів цитохромів, таких як CYP2C9 та CYP2C19. Крім того, метформін також може інгібувати рецептори вітаміну D, глюкокортикоїдні рецептори та опосередковану індукцію експресії мРНК CYP3A4 в гепатоцитах людини [27]
Як і у випадку з CYP2E1, введення метформіну не могло нормалізувати рівень експресії гена CYP2C23 у пубертатних щурів з РС: у цій групі ми помітили статистично значуще зниження вмісту мРНК CYP2C23, тоді як у дорослих тварин з введенням МС і метформіну цей параметр не відрізнявся від контролю . Ми помітили відмінності в ефектах введення MS та метформіну на швидкість експресії гена CYP2C23 та активність ферментів маркера CYP2C23, як це було продемонстровано у випадку активності CYP2E1 та PNP-гідроксилази. Порівняно слабкі зміни експресії CYP2C23 супроводжувались статистично значущими порушеннями активності відповідного маркера ферменту у дорослих тварин із застосуванням РС та метформіну. Такі відмінності, можливо, можуть бути реалізовані за допомогою різних впливів метформіну на синтез білка SHP, ядерні рецептори VDR, CAR та GR, коактивовані з SRC1, та його здатність спричиняти пряме порушення активованої взаємодії PXR із SRC1 незалежно від кишеньки, що зв'язує ліганд PXR, як це було раніше продемонстровано для регулювання CYP3A [27]. Деякі інші посттрансляційні механізми також не можна виключати [26].
Спостережувані відмінності у впливі метформіну на показники експресії генів CYP2E1, CYP3A2 та CYP2C23 у щурів різного віку, можливо, можуть бути спричинені не лише раніше встановленими вікозалежними змінами впливу РС [20]. Значний внесок належить також складному молекулярному механізму регуляції ферментів CYP, опосередкованого лікарськими засобами [27], та здатності сімейства Cyp3a викликати компенсаторну регуляцію інших генів Cyp, як це було показано раніше в дослідженнях на мишах Cyp3a -/- [28] ].
Підсумовуючи результати щодо експресії ізоформ CYP450 та ферментативної активності при введенні МС та метформіну, можна відзначити більшу мінливість експресії всіх генів ізоформ у пубертатних щурів порівняно з дорослими. Порушення системи CYP450, спричинені введенням МС та метформіну, супроводжуються зниженням продуктивності антиоксидантного захисту, що створює умови для розвитку окисного стресу. Наші попередні дослідження вікових ефектів РС показали більш глибокі зміни зменшеного вмісту глутатіону, а також активності глутатіон-S-трансферази та редуктази у пубертатних тварин, тоді як у дорослих - лише вміст глутатіону зменшився [20]. Введення метформіну дозволяло нормалізувати (до певної міри) активність глутатіон-S-трансферази та редуктази в обох вікових групах. Але в групі пубертатних тварин із введенням МС та метформіну зберігався знижений вміст глутатіону. Наші результати щодо змін системи глутатіону відповідають результатам інших авторів, отриманим в експериментах в пробірці і в природних умовах [29-33].
Щодо тварин пубертатного періоду, слід підкреслити, що наші результати щодо незначного впливу як РС, так і метформіну на показники перекисного окиснення ліпідів у цій віковій групі в оголених контурах, відповідали даним інших авторів [38].
Висновок
Таким чином, метформін демонструє вікову ефективність щодо нормалізації рівня експресії ізоформ цитохрому Р-450, а також системи глутатіону та швидкості перекисного окислення ліпідів. Відсутність інформації про вікові відмінності впливу метформіну на стан CYP450 та системи глутатіону при РС робить ці дані значними. Отримані результати свідчать про необхідність оптимізації та індивідуалізації фармакотерапії РС залежно від віку пацієнтів.
- Препарати, схвалені FDA для лікування діабету та ожиріння, можуть зменшити рецидив кокаїну та допомогти залежним
- Годування хлібом вбиває птахів, викликаючи ожиріння, діабет; Деформації
- Відкриття може бути ключовим для ожиріння, діабету Rx
- Ожиріння GEM; Центр діабетичної хірургії - Брошура
- Генетичні тести на ризик ожиріння є недостатніми порівняно з ІМТ - діабетом