Жирова тканина як імунологічний орган
Департамент науки про харчування, Університет Пердью, Вест-Лафайєт, штат Індіана, США
Секція порівняльної медицини, Єльська школа медицини, Нью-Хейвен, штат Коннектикут, США
Кафедра імунобіології Єльської школи медицини, Нью-Хейвен, штат Коннектикут, США
Департамент науки про харчування, Університет Пердью, Вест-Лафайєт, штат Індіана, США
Секція порівняльної медицини, Єльська школа медицини, Нью-Хейвен, штат Коннектикут, США
Кафедра імунобіології Єльської медичної школи, Нью-Хейвен, штат Коннектикут, США
Бюджетні агентства: Дослідження в лабораторії Dixit частково підтримуються Національними інститутами охорони здоров’я (AG043608, AG31797, DK090556 та AI105097). Райана Гранта підтримує Університет Пердью.
Розкриття інформації: Автори не заявили про конфлікт інтересів.
Внески автора: Обидва автори сприяли розробці, написанню та редагуванню рукопису.
Анотація
Об’єктивна
Цей огляд буде зосереджений на імунологічних аспектах жирової тканини та її потенційній ролі у розвитку хронічного запалення, що викликає супутні захворювання, пов’язані з ожирінням.
Методи
В огляді використовувались результати пошуку у поточній літературі PubMed для дослідження лейкоцитозу жирової тканини.
Результати та висновки
Жирова тканина у людей із ожирінням запалюється і сприяє розвитку інсулінорезистентності, діабету 2 типу та метаболічного синдрому. У жировій тканині виявлено численні імунні клітини, включаючи В-клітини, Т-клітини, макрофаги та нейтрофіли, і ожиріння впливає як на кількість, так і на характер підтипів імунних клітин, що виникає як активний імунологічний орган, здатний модифікувати метаболізм у всьому тілі через паракринний та ендокринний механізми. Жирова тканина є великим імунологічно активним органом під час ожиріння і має ознаки як вродженої, так і адаптивної імунної відповіді. Незважаючи на наявність клітин гемопоетичного походження в жировій тканині, незрозуміло, чи має жировий відділ пряму роль у імунному нагляді чи захисті господаря. Розуміння взаємодії між лейкоцитами та адипоцитами може виявити клінічно значущі шляхи, що контролюють запалення жирової тканини, і, ймовірно, виявить механізми, за допомогою яких ожиріння сприяє підвищеній сприйнятливості як до метаболічних, так і до деяких інфекційних захворювань.
Вступ
Зростання рівня надмірної ваги та ожиріння сприяв прискоренню рівня діабету 2 типу та метаболічного синдрому, що має великі наслідки для глобального здоров'я. Епідеміологічні дані свідчать, що на ожиріння припадає 18% усіх смертей людей у віці від 40 до 85 років у Сполучених Штатах (1). Таким чином, необхідна розробка безпечних та ефективних методів лікування ожиріння та його супутніх захворювань, особливо діабету 2 типу. Зростає усвідомлення того, що хронічне запалення низького ступеня сприяє супутнім захворюванням ожиріння та що жирова тканина є основним імунологічно активним органом, який сприяє цьому запаленню.
Запалення та метаболічно здорове та нездорове ожиріння
Хоча метаболічно здорові люди з ожирінням, здається, захищені від пов'язаних із ожирінням захворювань, цілком зрозуміло, що розвиток запалення та резистентності до інсуліну під час ожиріння може бути адаптивним механізмом для контролю дисфункції органів, пов'язаної з накопиченням надлишкової енергії. Наприклад, протягом останніх двох десятиліть отримали вагомі докази досліджень індіанців Піма та інших груп населення про те, що зниження рівня глюкози: окислення ліпідів або низький коефіцієнт дихання пов'язане зі зниженням швидкості збільшення ваги (8-10). З цих ранніх досліджень було висунуто гіпотезу про те, що низька швидкість окислення глюкози призводить до супутнього зменшення утилізації глюкози, а резистентність до інсуліну може бути біологічною адаптацією до зниження ваги за рахунок зменшення накопичення енергії в жировій тканині.
Лейкоцитоз жирової тканини
Розуміння лейкоцитозу жирової тканини розпочалося з виявлення макрофагів у жировій тканині. Насіннєві висновки Weisberg та співавт. та Xu та співавт. продемонстрували, що макрофаги збільшуються в жировій тканині під час ожиріння і що макрофаги є основним джерелом ФНО (13, 14). На додаток до макрофагів були виявлені інші імунні клітини, включаючи: В-клітини (15), Т-клітини (16), нейтрофіли (17, 18), еозинофіли (19) та тучні клітини (20, 21). Клітинний склад жирової тканини пластичний і регулюється як гострими, так і хронічними подразниками, включаючи дієту (13, 14, 18), стан маси тіла (13, 14), вплив холоду (22) та годування та голодування (23). Точний перебіг подій, що призводять до змін клітинного складу жирової тканини у відповідь на дієту з високим вмістом жиру, ще не визначено. Однак відомо, що нейтрофіли рекрутуються в жирову тканину протягом 3 днів, макрофаги - протягом 2 тижнів, а В-клітини і Т-клітини збільшуються протягом 4 тижнів після жирної дієти у мишей (15, 18) .
Загальна кількість кожного типу клітин є важливою, але також відбуваються зміни в якості цих популяцій клітин. Ожиріння та резистентність до інсуліну здатні перекосити імунні клітини від протизапальних підтипів до більш прозапальних підтипів. Це включає перехід поляризації макрофагів з М2-подібних клітин на більш прозапальні М1-подібні клітини (24) та втрату регуляторних Т-клітин у жировій тканині (25). Місцеві ефекти цих композиційних змін під час ожиріння викликають запалення жирової тканини та впливають на здатність адипоцитів зберігати ліпіди, чутливість до адипоцитів до інсуліну, системний метаболізм глюкози та метаболічний гомеостаз. Основні фактори та типи клітин, що спричиняють запалення жирової тканини, є дуже активною сферою досліджень, проте все ще існує багато невідомих факторів в етіології захворювання, спричиненого ожирінням.
Адипоцитарний стрес та пов'язані з небезпекою молекулярні структури
У відповідь на надлишок енергії адипоцити піддаються гіпертрофії та/або гіперплазії. Розміри адипоцитів корелюють із чутливістю до інсуліну у людей, а ті, що мають менші адипоцити, мають нижчі маркери запалення (26, 27); однак моделі гризунів вказують, що під час відсутності певних білків адипоцити можуть бути великими, тоді як тварина підтримує чутливість до інсуліну (28). Гістологічний аналіз жирової тканини виявляє наявність коронкоподібних структур, які складаються з імунних клітин, що оточують мертві адипоцити, які забруднюють периліпін негативно навколо своїх крапель ліпідів (29). Поява коронкоподібних структур та загибель адипоцитів йде за тимчасовим ходом, в результаті якого зростає захворюваність від початку годування з високим вмістом жиру до 16-го тижня. До 20-го тижня коронкоподібні структури зменшуються порівняно з 16-м тижнем, хоча і у худих контрольних тварин кількість все ще збільшена, а миші залишаються резистентними до інсуліну, хоча в меншій мірі, ніж у пік захворюваності на кроноподібну структуру (29). Це вказує на те, що реконструкція жирової тканини є адаптивною реакцією, але вона не може повністю компенсувати надлишок поживних речовин і врешті-решт обмежує накопичення ліпідів, що призводить до дисфункції тканин.
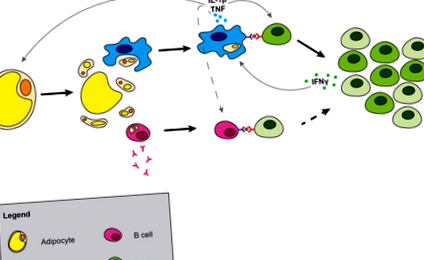
Точний спосіб загибелі адипоцитів незрозумілий; однак останні дослідження вказують, що загибель адипоцитів може протікати через піроптоз (30). Піроптоз - це спеціалізована форма залежної від каспази-1 загибелі клітин, яка передбачає витікання цитозольних компонентів у позаклітинний простір. Витікання цитозольних компонентів та опромінення краплі ліпідів у тканині спричиняє вивільнення пов'язаних з небезпекою молекулярних структур (DAMP), які можуть бути сприйняті рецепторами розпізнавання образів (рис. 1). Метаболічні DAMP включають вільні жирні кислоти (31), високі концентрації глюкози (32), АТФ (33), кераміди (34) та інші сфінголіпіди, а також холестерин (35, 36) та кристали урату. Нещодавно було показано, що адипоцити синтезують сечову кислоту, а вироблення сечової кислоти в жировій тканині збільшується під час ожиріння (37). Ці метаболічні DAMP здатні викликати активацію макрофагів та ініціювати запалення жирової тканини.
Генерація запалення в жировій тканині. Смерть адипоцитів вивільняє цитозольні компоненти і відкриває краплю ліпідів. Макрофаги поглинають або активуються компонентами адипоцитів, що призводить до продукування макрофагами цитокінів. В-клітини також активуються, що призводить до вироблення антитіл та взаємодії Т-клітин, залежної від MHCII, що може сприяти резистентності до інсуліну. IL-1β, який секретується макрофагами та антигеном, рухає клональне розширення Т-клітин і зміщує баланс Т-клітин в жировій тканині від наївних до ефекторних клітин пам'яті. Штрихові лінії вказують на можливу взаємодію між клітинами.
Макрофагове зондування DAMP жирової тканини та презентація антигену
Метаболічні DAMPs та молекулярні структури, асоційовані з патогенами (PAMPs), сприймаються вродженими імунними клітинами та призводять до активації запальних шляхів через рецептори розпізнавання образів, такі як домен олігомеризації, що зв’язує нуклеотиди та нуклеотиди, що містять сімейства білкоподібних рецепторів (TLR та NLR ). Аналіз розподілу цих рецепторів, а також маркерів макрофагів був утруднений через ферментативну дисперсію жирової тканини. Ферментативна дисперсія жирової тканини відокремлює жирову тканину на плавучу фракцію адипоцитів і стромальну судинну гранулу; однак він обмежений через тісні асоціації між адипоцитами та макрофагами та наявність вільно плаваючих макрофагів у фракції адипоцитів (38) .
Усі представники сімейства TLR (TLR 1–9) експресуються в жировій тканині в різній мірі в межах стромальної судинної та адипоцитарної фракцій (39). Що стосується запалення жирової тканини, TLR4 приділяв найбільшу увагу. Взаємодія TLR4 та жирних кислот пов'язана з білком фетуїн А (40). Ідентифіковано, що фетуїн А є ендогенним лігандом TLR4 і виробляється у великих кількостях жировою тканиною (40). У кокультурних системах фетуїн А виділяється адипоцитами після впливу вільних жирних кислот і здатний поляризувати макрофаги від М2-подібного фенотипу до М1-подібного фенотипу, подібно до змін, що відбуваються в жировій тканині під час розвитку ожиріння ( 40). На додаток до своєї поляризуючої активності, фетуїн А також служить хемоаттрактантом для макрофагів, що призводить до збільшення трафіку до тканини (40). Абляція TLR4 зменшує запалення жирової тканини, проте його вплив на чутливість до інсуліну у всьому тілі не був послідовним у всіх дослідженнях, деякі демонструють підвищену чутливість до інсуліну (41, 42), тоді як інші не мають змін (42) .
Підмножини Т-клітин, розширення та скорочення популяцій
Внесок В-клітин у запалення жирової тканини та резистентність до інсуліну
Імунологічні структури жирових тканин
Жирова тканина не є рівномірною за своїм розподілом і має регіональність, засновану на імунних структурах, включаючи коронкоподібні структури, асоційовані з жиром лімфоїдні скупчення (FALC) та молочні плями, а також на появі адипоцитів з брита/бежа. Однак вплив регіонарності жирової тканини на жирову функцію недостатньо вивчений. Деякі депо жирової тканини, включаючи пахове депо у гризунів та багато невеликих депо у людей та інших ссавців, містять лімфатичні вузли (67). Первинні дослідження складів жирової тканини морської свинки показали, що експлантати жирової тканини, розташовані поблизу лімфатичних вузлів, порівняно з жировою тканиною, яка не прилягає до лімфатичних вузлів, мали посилену здатність придушувати стимульоване мітогеном проліферацію змішаного препарату лейкоцитів лімфатичних вузлів (67). Цікаво, що вплив на проліферацію було зменшено шляхом лікування інсуліном. Ці висновки вказують на те, що виділяються продукти жирової тканини поблизу лімфатичних вузлів мають імунодепресивну здатність, але механізм цього не відомий. У цих дослідженнях використовували інтактні експлантати жирової тканини, тому незрозуміло, чи мали секретовані продукти адипоцитів чи імунні клітини біологічну дію.
Запалення, пов’язане з ожирінням, і реакція на патогени
Ожиріння пов'язане з численними захворюваннями, включаючи: діабет 2 типу, подагру, артрит, атеросклероз, захворювання печінки та підвищену сприйнятливість до деяких патогенів. Як метаболічні, так і запальні зміни жирової тканини обумовлюють патологію, пов’язану з ожирінням. TNF, IL-1β та IL-6 мають здатність погіршувати дію інсуліну та засвоєння глюкози в периферичній тканині. Хоча зазвичай спостерігається підвищення системних концентрацій IL-6, зміни системного IL-1β та TNF важче виявити через низьку кількість цих цитокінів у циркуляції. Місцево ці цитокіни в жировій тканині мають здатність модулювати ліполіз і диференціювання адипоцитів. Таким чином, ці цитокіни мають здатність обмежувати накопичення жиру в жировій тканині і перерозподіляти цей жир в інші тканини, утворюючи позаматковий жир.
Висновок
Подяка
Автори дякують Енн Лю за допомогу у розробці та створенні фігур.
- Міхур; Ламінарія - Фітофармація - Інтернет-бібліотека Wiley
- Кальцитріол та енергетичний метаболізм - Zemel - 2008 - Відгуки про харчування - Інтернет-бібліотека Wiley
- Запалення жирової тканини сприяє зниженню маси тіла, викликаному експериментальним хронічним харчуванням
- 100 лекцій та 8 годин фітнесу - План схуднення - Інтернет-бібліотечна освіта - EllEdu
- Розподіл жирових тканин передбачає виживання при аміотрофічному бічному склерозі