Збільшення ваги пов’язане зі зменшенням реакції смугастості на смачну їжу
Ерік Стіс
1 кафедра психології Техаського університету, Остін, штат Техас 78712,
Соня Йокум
1 кафедра психології Техаського університету, Остін, штат Техас 78712,
Кеннет Блюм
2 Департамент психіатрії, Медичний коледж Університету Флориди та Інститут мозку Мак-Найта, Гейнсвілль, Флорида, 32611, та
Кара Бохон
3 Кафедра психіатрії Каліфорнійського університету, Лос-Анджелес, Лос-Анджелес, Каліфорнія 90095
Анотація
У відповідності з теорією, що люди з гіпофункціональною схемою винагороди переїдають, щоб компенсувати дефіцит винагороди, у людей з ожирінням та нежирними людьми менше рецепторів D2 поперечно-смугастого типу і менше виявляється реакція смугастості на приємний прийом їжі. Низька стриатальна реакція на прийом їжі передбачає приріст ваги в майбутньому у тих, хто перебуває під генетичним ризиком, для зниженої сигналізації схем винагороди на основі дофаміну. Проте дослідження на тваринах показують, що прийом смачної їжі призводить до зниження регуляції D2-рецепторів, зниження чутливості до D2 та зниження чутливості до винагороди, вказуючи на те, що переїдання може сприяти зменшенню чутливості смуг. Таким чином, ми перевірили, чи переїдання призводить до зниження реакції смугових смуг на смачне споживання їжі у людей, використовуючи функціональну магнітно-резонансну томографію, що повторюється. Результати показали, що жінки, які набрали вагу за 6 місяців, продемонстрували зменшення реакції смугастості на приємне споживання їжі порівняно з стабільно ваговими жінками. У сукупності результати свідчать про те, що низька чутливість схем винагород збільшує ризик переїдання і що це переїдання може ще більше послабити чутливість схем винагород у процесі подальшої подачі.
Вступ
Стриатум відіграє ключову роль у кодуванні винагороди від прийому їжі. Годування пов'язане з вивільненням дофаміну (DA) у спинному стриатумі, а ступінь вивільнення DA корелює із кількістю задоволення від їжі (Szczypka et al., 2001; Small et al., 2003). Спинний стриатум реагує на поглинання шоколаду худими людьми і чутливий до його знецінення, годуючи понад насичення (Small et al., 2001).
Люди, що страждають ожирінням, демонструють меншу доступність смугастих рецепторів D2, ніж худі люди (Wang et al., 2001; Volkow et al., 2008), а ожирілі щури мають нижчий базальний рівень DA та знижують доступність рецепторів D2, ніж худі щури (Orosco et al., 1996; Фетисов та ін., 2002). Люди, що страждають ожирінням та худими, демонструють меншу активацію стриатальних цільових областей DA (хвостаті, путамени) у відповідь на смачне споживання їжі (Stice et al., 2008a, b), проте демонструють більшу активацію смугастості у відповідь на фотографії їжі (Rothemund et al., 2007; Stoeckel et al., 2008; Stice et al., 2010), вказуючи на розбіжність між споживчою винагородою за їжу та стимулюючою помітністю харчових сигналів. Критично важливо, що у людей, які виявляли слабшу активацію стриатального реагування у відповідь на прийом їжі, у кого був алель A1 TaqIA, що пов’язано з меншою доступністю рецепторів D2 у стриатах (Noble et al., 1991; Ritchie and Noble, 2003; Tupala et al., 2003) і зменшення метаболізму в стані стриатального спокою (Noble et al., 1997), показав підвищений приріст ваги в майбутньому (Stice et al., 2008a). У сукупності ці висновки узгоджуються з теорією, згідно з якою особи з нижчою сигнальною здатністю у схемою винагороди переїдають, щоб компенсувати цей дефіцит винагороди (Blum et al., 1996; Wang et al., 2002).
Однак є дані, що споживання смачної їжі призводить до зниження регуляції сигналізації DA. Регулярний прийом їжі з високим вмістом жиру та цукру, що призводить до збільшення ваги, призводить до зниження регуляції постсинаптичних рецепторів D2, зниження чутливості до D2 та зниження чутливості до винагороди у гризунів (Colantuoni et al., 2001; Bello et al., 2002; Kelley та ін., 2003; Джонсон та Кенні, 2010). Оскільки ці дані вказують на те, що переїдання може сприяти подальшому ослабленню реакції смугастості на їжу, ми провели перспективне дослідження з функціональною магнітно-резонансною томографією (fMRI), щоб безпосередньо перевірити, чи пов'язане переїдання зі зниженою активацією смуг у відповідь на смачні страви в люди.
Матеріали і методи
Учасники
Учасниками були 26 жінок із надмірною вагою та ожирінням (середній вік 21,0 ± 1,11 року; середній індекс маси тіла [ІМТ] 27,8 ± 2,45). Вибірка складалася з 7% азіатсько-тихоокеанських островів, 2% афроамериканців, 77% європейців, 5% корінних американців та 9% змішаної расової спадщини. Учасники надали письмову згоду. Місцева комісія з огляду етики схвалила це дослідження. Ті, хто повідомляв про переїдання або компенсаційну поведінку протягом останніх 3 місяців, поточне вживання психотропних препаратів або заборонених наркотиків, травму голови із втратою свідомості або поточний психічний розлад Axis I. Дані збирали на початковому рівні та протягом 6 місяців спостереження.
Заходи
Маса тіла.
ІМТ (кг/м 2) використовувався для відображення ожиріння (Dietz and Robinson, 1998). Після зняття взуття та пальто висоту вимірювали з точністю до міліметра за допомогою стадіометра, а вагу оцінювали з точністю до 0,1 кг за допомогою цифрової шкали. Дві міри кожного були отримані та усереднені. Учасників попросили утриматись від їжі протягом 3 год, перш ніж виконувати антропоморфні заходи для цілей стандартизації. ІМТ корелює з прямими показниками загального жиру в організмі, такими як рентгенівська абсорбціометрія з подвійною енергією (r = 0,80–0,90), та такими показниками, як артеріальний тиск, несприятливі профілі ліпопротеїнів, атеросклеротичні ураження, рівень інсуліну в сироватці крові та цукровий діабет (Dietz and Робінзон, 1998).
Парадигма фМРТ.
Учасників попросили споживати звичну їжу, але утримуватися від їжі та пиття (включаючи напої з кофеїном) протягом 4–6 годин до їх сеансу візуалізації для стандартизації. Ми вибрали цей період позбавлення, щоб охопити стан голоду, який відчуває більшість людей, коли вони підходять до наступного прийому їжі, а це час, коли індивідуальні відмінності в нагородженні за їжу логічно впливають на споживання калорій. Учасники завершили парадигму між 11:00 та 13:00 або 16:00 та 18:00. Незважаючи на те, що ми намагалися проводити базове та подальше сканування одночасно, через обмеження планування лише 62% учасників провели своє друге сканування протягом 3 годин з моменту завершення базового сканування (середня різниця в часі сканування, 3,0 год; діапазон 0,5–6,0 год). Учасники були ознайомлені з парадигмою fMRI на практиці на окремому комп’ютері перед скануванням.
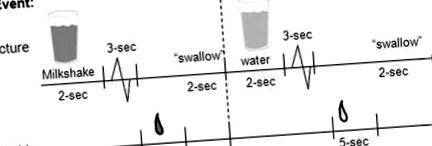
Приклад хронометражу та впорядкування презентації фотографій та напоїв під час бігу.
Смаковий колектор був прикріплений до столу. Для кожного суб'єкта використовували нові трубки та шприци, а мундштук очищали та стерилізували між використаннями.
Візуалізація та статистичний аналіз
Сканування проводилося за допомогою головної МРТ-камери Siemens Allegra 3 tesla. Для збору даних із усього мозку використовували стандартну котушку пташиної клітки. Термопінна вакуумна подушка та додаткові прокладки використовувались для обмеження руху голови. Всього під час кожного функціонального циклу було зібрано 152 сканування. Для функціональних сканувань використовували зважений градієнт T2 * одноразовий ехо-планарний послідовність зображення [час відлуння = 30 мс, час повторення (TR) = 2000 мс, кут відкидання = 80 °] з роздільною здатністю в площині 3,0 × 3,0 мм 2 Матриця 64 × 64; 192 × 192 мм 2 поле зору (FOV)]. Для покриття цілого мозку було взято 32 зрізи (товщина 4 мм; переміщення із переміщенням, без пропуску) вздовж поперечної, косої площини AC – PC, як визначено на середньосагітальному відділі. Структурні скани збирали з використанням зваженої послідовності інверсії T1 (MP-RAGE) в тій же орієнтації, що і функціональні послідовності, для отримання детальних анатомічних зображень, вирівняних до функціональних сканувань. Були отримані структурні послідовності МРТ з високою роздільною здатністю (FOV = 256 × 256 мм 2, 256 × 256 матриці, товщина = 1,0 мм, n ≈ 160 зрізів).
Дані були попередньо оброблені та проаналізовані за допомогою SPM5 (Wellcome Department of Imaging Neuroscience, Лондон, Великобританія) в MATLAB (Worsley and Friston, 1995). Зображення з часом одержували, виправляючи на зріз, отриманий при 50% TR. Функціональні зображення були вирівняні за середнім значенням. Анатомічні та функціональні зображення нормалізували до стандартного шаблону МНІ головного мозку, реалізованого в SPM5 (ICBM152, на основі в середньому 152 нормальних МРТ-сканувань). Нормалізація призвела до розміру вокселя 3 мм 3 для функціональних зображень і 1 мм 3 для структурних зображень. Функціональні зображення згладжували 6-міліметровою повною шириною з напівмаксимальним ізотропним ядром Гауса.
Щоб визначити ділянки мозку, активовані споживанням смачної їжі, ми порівняли реакцію, залежну від рівня оксигенації крові (BOLD) під час отримання молочного коктейлю, та отримання несмачного розчину. Ми вважали надходження смаку в рот скоріше винагородою, а не тим, коли смак був проковтнутий, але ми визнаємо, що постингестивні ефекти сприяють нагородженню вартості їжі (O'Doherty et al., 2002). Ефекти для кожного стану вокселів оцінювали за допомогою загальних лінійних моделей. Вектори нападів для кожної цікавої події були зібрані та введені в матрицю проектування, щоб відповіді, пов'язані з подіями, могли моделюватися за допомогою канонічної функції гемодинамічної реакції, реалізованої в SPM5, що складається з суміші двох гамма-функцій, які емулюють ранню пік через 5 с і подальше зниження. Щоб врахувати дисперсію, спричинену ковтанням розчинів, ми включили час проковтування (суб’єкти були навчені ковтати в цей час) як контрольну змінну. Ми також включили часові похідні гемодинамічної функції, щоб отримати кращу модель даних (Henson et al., 2002). Фільтр високих частот 128 с (згідно з конвенцією SPM5) був використаний для усунення низькочастотних шумів та повільних дрейфів сигналу.
Були побудовані індивідуальні карти для порівняння активацій у кожного учасника для отримання контрастного молочного коктейлю – несмачного отримання. Потім проводили порівняння між групами з використанням моделей випадкових ефектів для врахування мінливої мінливості. Оцінки параметрів були введені в ANOVA другого рівня 2 × 2 випадкових ефектів (квитанція від молочного коктейлю - несмачна квитанція) за групою збільшення ваги в порівнянні з групою, яка стабільно важить, групою збільшення ваги в порівнянні з групою втрати ваги або групою стабільної ваги проти група схуднення. Значимість активації BOLD визначали, враховуючи як максимальну інтенсивність відповіді, так і ступінь відповіді. Ми проводили пошук регіонів інтересу (ROI), використовуючи піки в спинному смугастому тілі, визначені раніше (Stice et al., 2008a) як центроїди, щоб визначити сфери діаметром 10 мм. Значимість для цих апріорних рентабельних інвестицій оцінювали при статистичному порозі р 2 = 0,21–0,42) у відповідь на отримання молочного коктейлю, ніж жінки, які очікують, що їжа буде менш корисною.
Результати
Ми перевірили, чи виявляли суб'єкти, у яких протягом 6 місяців спостереження збільшився ІМТ>> 2,5% (N = 8; середній відсоток зміни ІМТ = 4,41; діапазон, 2,6-8,2), чи не спостерігалося зменшення активації хвостатих у відповідь на відносне споживання молочного коктейлю. для тих, хто продемонстрував зниження ІМТ на 2,5% (N = 6; середній відсоток зміни ІМТ = -4,7; діапазон, -3,1–6,8), виявляв різну зміну реакції смугастості на смачну їжу, ніж учасники, які залишалися стабільними у вазі або набирали вагу. Що стосується зміни ваги в сирому вигляді, це перетворюється на середню зміну ваги на 6,4 фунтів для групи, яка набирає вагу, середню зміну ваги на 0,5 фунтів для вагостійкої групи та середню зміну ваги на -6,8 фунтів на вагу -група втрат. Хоча групи не відрізнялись за ІМТ на вихідному рівні, ми контролювали цю змінну. Оскільки існувала певна різниця в часі доби, коли базові та подальші сканування проводились у суб’єктів, які могли вплинути на результати, ми також контролювали різницю в часі двох сканувань (у годинах). Оцінки параметрів від несмачного контрасту молочного коктейлю були введені в ANOVA другого рівня 2 × 2 × 2 випадкових ефектів (наприклад, збільшення ваги – стабільність ваги за отриманням молочного коктейлю - несмачне отримання до 6-місячного спостереження - базовий рівень.
Корональний зріз, що демонструє меншу активацію в правому хвості (12, −6, 24; Z = 3,44; FDR-скориговане p = 0,03; pd-амфетамін-індуковане вивільнення DA у вентральній смугастій тканині, оцінене за допомогою позитронно-емісійної томографії (ПЕТ) та активації BOLD оцінювали за допомогою fMRI в тому самому регіоні під час очікування (підготовка двигуна до отримання) грошової винагороди (r = 0,51), паралельно з результатами іншого дослідження PET/fMRI (Schott et al., 2008). По-друге, ми не проводили вимірювання ваги в той самий час доби для учасників на початковому рівні та 6-місячні подальші оцінки, що могло б спричинити помилку в нашому моделюванні зміни ваги. Однак ми стандартизували час після останнього прийому їжі, попросивши учасників утриматися від будь-якого прийому їжі або напоїв (крім води) протягом 3 год перед зважуванням.Ми також виявили, що ІМТ показав високу надійність тесту 1 місяця - повторне тестування (r = 0,99) у попередньому дослідженні, яке також не проводило вимірювання ваги в той самий час доби на вихідному та подальша оцінка (Stice et al., 2006). По-третє, ми не могли підтвердити, що учасники фактично утримувались від їжі протягом 4–6 год до сканування фМРТ, що, можливо, призвело до непотрібних розбіжностей.
На закінчення, нинішні результати, взяті в поєднанні з минулими висновками, свідчать про те, що низька чутливість схем винагород на основі DA до прийому їжі може збільшити ризик переїдання, і, крім того, це переїдання призводить до додаткового послаблення реакції схем винагород, тим самим збільшуючи ризик майбутнього набору ваги в подальшому. Ця робоча модель може пояснити, чому ожиріння зазвичай має хронічний перебіг і стійке до лікування.
Виноски
Це дослідження підтримали Національні інститути грантів R1MH64560A та DK080760.
- Збільшення ваги у відповідь на годування з високим вмістом жиру у мишей-самців CD-1 - W L Breslin, K Strohacker, K C
- Втрата ваги у відповідь на позбавлення їжі передбачає ступінь ожиріння, спричиненого дієтою, у C57BL6J
- 10 найкращих продуктів для відгодівлі, завдяки яким ви набираєте вагу - справжня їжа на все життя
- Що викликає ожиріння 10 продуктів харчування, які можуть спричинити надмірне збільшення ваги
- Розуміння викривлення порцій та його ролі у безпеці харчових продуктів для схуднення; Якісний блог