Захисні ефекти Akkermansia muciniphila про когнітивні дефіцити та амілоїдну патологію в мишачій моделі хвороби Альцгеймера
Предмети
Анотація
Об’єктивна
Хвороба Альцгеймера (АД) є глобальною проблемою здоров’я без ефективних методів полегшення прогресування захворювання. Амілоїдний β-білок (Aβ) широко прийнятий як ключовий біомаркер для AD. Метаболічні синдроми, включаючи ожиріння та резистентність до інсуліну, є ключовими факторами високого ризику розвитку АД. Akkermansia muciniphila (Akk), єдиний представник роду кишечника людини Веррукомікроб, може запобігти збільшенню ваги, спричиненої дієтою з високим вмістом жиру, відновленню порушеної цілісності бар’єрного кишкового епітелію, зниженню рівня ендотоксинів у крові та поліпшенню резистентності до інсуліну. Метою цього дослідження є вивчення впливу введення Akk у мишей-моделей AD на різні дієти.
Методи
Мишей APP/PS1 годували або звичайною чау-дієтою, або дієтою з високим вмістом жиру, і їх обробляли АКК давальницею щодня протягом 6 місяців. Визначено вплив Akk на метаболізм глюкози, кишковий бар’єр та ліпідний обмін на мишачій моделі AD. Також були проаналізовані зміни в патології мозку та нейроетології.
Результати
Akk ефективно знижував рівень глюкози в крові та діаміноксидази в сироватці крові та пом'якшував зменшення клітин слизу товстої кишки у мишей APP/PS1. Після лікування Akk миші APP/PS1 продемонстрували очевидно знижений рівень ліпідів у крові, покращений стеатоз печінки та відбілювання лопаточного коричневого жиру. Більше того, Akk сприяв зниженню рівня Aβ 40–42 у корі головного мозку мишей APP/PS1, скоротив час дослідження та покращив рівень завершення тестів на Y-лабіринт.
Висновок
Akk ефективно покращував толерантність до глюкози, дисфункцію кишкового бар'єру та дисліпідемію у мишей на моделі AD. Результати нашого дослідження припустили, що Akk може затримати патологічні зміни в мозку та зняти порушення просторового навчання та пам'яті у мишей моделі AD, що забезпечує нову стратегію профілактики та лікування AD.
Вступ
Хвороба Альцгеймера (БА) - це хвороба із генералізованою деменцією, такою як порушення пам’яті, втрата зорових навичок, порушення працездатності та поведінкові зміни. АД характеризується серйозними когнітивними порушеннями та значними патологічними змінами в мозку. Амілоїдний β-білок (Aβ) - це пептид, що продукується білком-попередником Aβ (APP) шляхом протеолізу β- та γ-секретази. Aβ40 і Aβ42 мають сильну токсичність, їх легше агрегувати та спричиняти нейротоксичні ефекти 1, що широко прийнято як ключовий біомаркер для AD. Сучасні методи лікування АД полегшують лише симптоми, але не можуть полегшити прогресування захворювання 2. Таким чином, рання діагностика є найефективнішим методом лікування 3. У 2010 році Міжнародна хвороба Альцгеймера (ADI) повідомила, що витрати на лікування та догляд за деменцією у всьому світі сягнули понад 818 мільярдів доларів. Експерти припускають, що кількість хворих на АД може досягти 30 мільйонів до 2050 року 4, 71% з яких буде зосереджено в країнах, що розвиваються, включаючи Китай, Індію, Південну Азію та регіони західної частини Тихого океану.
Нещодавно велика кількість звітів показала, що метаболічні синдроми, включаючи ожиріння та резистентність до інсуліну, є ключовими факторами високого ризику когнітивних порушень та деменції 5. Дані свідчать про те, що молоді люди, які страждають ожирінням або діабетом, мають більший ризик розвитку деменції 6,7,8,9. Цукровий діабет 2 типу також значно збільшує ризик розвитку АД, і відкладення білка Aβ конкурує з інсуліном за рецептори інсуліну, спричиняючи резистентність до інсуліну 10,11,12,13. Крім того, експерименти на тваринах показали, що метаболічний синдром, зокрема хронічне запалення низької ступеня, може посилити специфічні патологічні зміни в AD 13,14,15, і експерти вважають, що AD є метаболічним захворюванням 16,17,18. Патогенез БА ще не визначений чітко. Багато досліджень показали, що розвиток інсулінорезистентності в мозку проявляється у хворих на АД, що може бути спричинено відкладенням білка Aβ, оскільки це пов'язано з безліччю патологічних особливостей 19,20. Тому багато вчених вважали, що дисфункціональний мозковий шлях інсуліну може бути частковою причиною розвитку AD 21 .
Akkermansia muciniphila (Akk) є єдиним представником Веррукомікроб кишкових мікробів людини, які можна культивувати, і це легко виявити метагеномним аналізом кишечника людини. Враховуючи, що його чисельність тісно пов’язана зі здоров’ям людини, A. muciniphila приділяється все більша увага 22. Є дані, що достаток A. muciniphila було значно зменшено в кишечнику у пацієнтів з діабетом 2 типу 23 та мишами моделі AD 24. Також було показано, що A. muciniphila не тільки може запобігти збільшенню ваги у дієтичних мишей з високим вмістом жиру, але також може відновити пошкоджену цілісність епітеліального бар’єру та покращити ендотоксемію 25,26. Отже, конкретною метою цього дослідження було оцінити, чи може лікування Акк покращити стан здоров'я тваринних моделей з АД, щоб запропонувати нову стратегію профілактики та лікування АД.
Методи
Тварина модель
Культура та управління A. muciniphila
Китайський штам A. muciniphila GP01 виділяли з людського стільця, як описано раніше 28, і культивували анаеробно в середовищі на основі базального муцину. Концентрацію бактерій розраховували шляхом вимірювання значень OD при 600 нм. Експериментальним мишам APP/PS1 давали щодня протягом 6 місяців 5 × 10 9 КОЕ A. muciniphila в 200 мкл стерильного PBS або 200 мкл стерильного PBS.
Мишей знеболювали 1–3% ізофлураном у 100% O2. Анестезованих мишей сканували на 7-тонному МРТ для дрібних тварин (PharmaScan70/16 US; BRUKER Biospin MRI GmbH), оснащеному чутливими поверхневими котушками та підсилювачем. Добробут тварин забезпечувався за допомогою системи циркуляції гарячої води та фізіологічного моніторингу. Протокол візуалізації включав послідовність T2 з такими параметрами: TR/TE: 2500/35 мс; FoV: 15 × 30 мм; розмір зображення: 256 × 256 мм; Товщина зрізу: 0,7 × 3,4 мм; час сканування: 2 хв 4 с. Розмір півкуль головного мозку та бічних шлуночків по обидва боки миші можна оцінити за допомогою МРТ.
Імуногістохімія та гістологія
Біохімічні аналізи та ІФА
Рівні загального холестерину (Chol), тригліцеридів (TG), аланінамінотрансферази (ALT) та аспартат трансамінази (AST) визначали за допомогою модульного аналізатора Roche P 800. Рівні діаміноксидази (DAO) (CUSABIO) у сироватці крові та рівні A40 та Aβ42 (Invitrogen) у корі головного мозку вимірювали за допомогою наборів ІФА.
Тест на толерантність до глюкози
Мишей APP/PS1 голодували протягом 12 год і вимірювали глюкозу в крові натще. Потім глюкозу (2 г/кг) вводили перорально, а рівень глюкози в крові визначали за допомогою глюкометра (Abbott Laboratories, Abbott Park, IL, USA) через 15, 30, 60, 90 і 120 хв.
Тести на відкритому полі та Y-лабіринт
Вестерн-блот-аналіз
Миші гіпокампі гомогенізували в охолодженому TBS, доповненому коктейлем інгібітора протеази та фосфатази (Thermo Fisher Scientific, Waltham, MA, USA). Концентрації білка в гомогенатах визначали за допомогою аналізу BCA (CWBIO). Зразки електрофоретично розділяли на 10 або 12% гелях SDS – PAGE і переносили на мембрани PVDF (Millipore, Бедфорд, МА, США). Мембрани блокували 5% знежиреного молока в TBS, що містить 0,1% Tween-20 (TBS-T), протягом 1 години і зондували первинними антитілами (Anti-UCP-1 антитіло ab10983) при 4 ° C протягом ночі. Потім мембрани були розроблені з відповідними кон'югованими з пероксидазою хрону вторинними антитілами та набором ECL (Thermo Fisher Scientific). Кількісне визначення денситометрії білкових смуг аналізували за допомогою програмного забезпечення для зображення IMAGE-PRO PLUS 6.0.
Суміш білків екстрагували з лопаткової коричневої жирової тканини в буфері RIPA (0,5% NP40, 0,1% доксицикліну натрію, 150 мМ NaCl, 50 мМ Tris.HCl [рН 7,4]), що містить повний коктейль-інгібітор протеази (Abcam). Мембрани PVDF досліджували одночасно з первинними антитілами до UCP1 (Abcam) та β-тубуліну (Abcam). Білкові смуги візуалізували за допомогою хемілюмінесцентних реагентів ECL (Thermo Fisher Scientific) та кількісно визначали за допомогою програмного забезпечення для візуалізації IMAGE-PRO PLUS 6.0.
ПЛР у режимі реального часу
Для аналізу чисельності Akk у фекаліях ДНК фекальних бактерій екстрагували набором ДНК Magen Hipure Stool. Після регулювання концентрації ДНК проводили ПЛР у реальному часі за допомогою набору реактивів PrimeScript ™ RT (Cat No. RR820A, Takara, Dalian) згідно протоколу виробника в системі ПЛР LightCycle480 в реальному часі (Рош, Німеччина). Процедура включала попередню денатурацію зразків ДНК при 95 ° С протягом 30 с, потім 40 циклів денатурації при 95 ° С протягом 5 с і відпал при 60 ° С протягом 30 с, плавлених при 95 ° С протягом 5 с і 60 ° С протягом 1 хв, остаточно охолоджували при 50 ° С протягом 30 с. Флуоресцентний продукт був виявлений на останньому кроці кожного циклу. Відносне кількісне визначення розраховували за допомогою 2 ΔΔCt, результати нормалізували до гена 16 S рРНК.
Праймери були: Akkermansia muciniphila ген,
Статистичний аналіз
Всі зразки були залучені до статистичного аналізу. Всі аналізи проводились за допомогою Статистичного пакету для соціальних наук версії 19.0 (SPSS) (IBM Corp, Armonk, NY, USA). Дані були виражені як середнє значення ± SEM. Статистичну значимість визначали за Стьюдентом т-тест (для порівняння двох експериментальних груп) або односторонній ANOVA (для порівняння трьох або більше експериментальних груп). Порівняння з стор
Результати
Akk ефективно регулював гомеостаз глюкози та пошкодження кишкового бар’єру у мишей APP/PS1
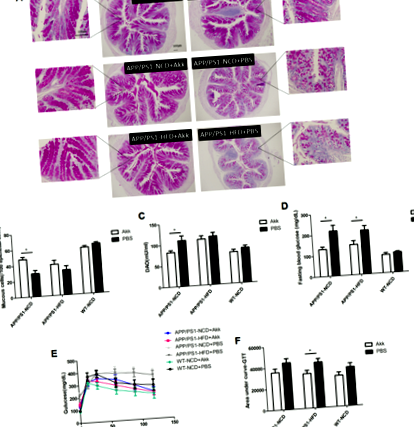
Для оцінки ефекту Akk на кишковий бар’єр та гомеостаз глюкози у моделі AD-миші ми порівнювали у мишей APP/PS1, які лікувались Akk та обробляли PBS, або годували нормальною дієтою чау (NCD) або дієтою з високим вмістом жиру ( HFD). У мишей APP/PS1, які отримували PBS, ми виявили, що рівень глюкози в крові натще був вищим, а результати OGTT також показали збільшення площі AUC (рис. 1d – f), стор Рис. 1: Akkermansia muciniphila покращений гомеостаз глюкози та відновлена бар’єрна функція кишечника.
Далі ми дослідили можливу роль Akk у функції кишкового бар’єру у мишей APP/PS1. Діаміноксидаза (DAO) є високоактивним внутрішньоклітинним ферментом у верхніх ворсинках кишечника у людини та ссавців, відіграє роль в метаболізмі гістаміну та різних поліамінів і тісно пов’язана із синтезом нуклеїнової кислоти та білка в клітинах слизової оболонки (рис. 1а, b, стор Рис.2: Akkermansia muciniphila покращені порушення обміну ліпідів.
Акк зменшив відкладення нальоту Aβ і рівень Aβ в мозку мишей APP/PS1
Аналіз відкладення білка Aβ за допомогою імуногістохімії показав, що миші APP/PS1 мали більше бляшок Aβ в гіпокампі (рис. 3а). Площа осадження білка Aβ збільшувалась у мишей APP/PS1-HFD-PBS, але при лікуванні за допомогою Akk, хоча статистично значущої різниці не було (рис. 3b). Крім того, ми також аналізували розчинні білки Aβ 40 та Aβ 42 за допомогою ІФА. У мишей APP/PS1-Akk ми виявили значне зниження рівня розчинних Aβ 40 і Aβ 42 порівняно з мишами APP/PS1-PBS (рис. 3c, d, стор Рис. 3: Акермансія muciniphila зменшення відкладень Aβ-бляшок та рівня Aβ у мозку мишей APP/PS1.
Акк покращив порушення пізнання та поведінку, пов’язану з тривогою, у мишей APP/PS1
Для того, щоб дослідити можливості навчання та пам'яті мишей APP/PS1, було проведено тест Y-лабіринту. Перед втручанням всі миші проходили тест Y-лабіринту протягом максимум 3 днів. Однак миші APP/PS1-PBS проводили більше часу, ніж миші WT-PBS під час тренувань. Після 6 місяців лікування Akk мишам APP/PS1 потрібно було значно коротший час навчання, ніж група, яка отримувала PBS (рис. 4а, стор Рис.4: Akkermansia muciniphila покращення когнітивних порушень та поведінки, пов’язаної з тривогою, у мишей моделі APP/PS1.
У тесті на відкритих майданчиках не було значущих відмінностей при порівнянні частки часу, проведеного в центральному районі серед усіх груп (рис. 4в). Час очищення мишей APP/PS1-PBS був меншим, ніж у мишей WT-PBS (рис. 4г, стор
Обговорення
Основними патологічними особливостями БА є утворення в мозку старечих бляшок (СП) та клубків нейрофібрил (НТФ) 42. Більше того, основним компонентом SP є β-амілоїд (Aβ), який відіграє вирішальну роль у виникненні та розвитку АД, і є загальним шляхом для різних факторів, що викликають AD 43. Білок Aβ відіграє важливу роль у патогенезі БА. Самоочищення та деградація бар’єрів білка Аβ призводять до білкових бляшок. Білок Aβ може зменшити кліренс Aβ білка макрофагами, тим самим виробляючи імунну відповідь 44. Білок Aβ також може сприяти апоптозу нейронів. Існувала значна різниця у складі кишкової мікрофлори між хворими на АД та нормальними суб’єктами, що свідчить про те, що мікробний склад може відігравати певну роль у розвитку амілоїдозу Aβ мозку 24. Варто зазначити, що в нашому дослідженні відкладення білка Aβ було зменшено в гіпокампі та корі головного мозку мишей APP/PS1, які отримували препарат Akk.
Миші APP/PS1 також виявили знижену увагу до себе та навколишнього середовища після оцінки за допомогою тесту на відкритому полі в нашому дослідженні, за погодженням з попередніми дослідженнями 27, і ці явища були полегшені лікуванням Akk. Результати тесту на Y-лабіринт показали, що дієта з високим вмістом жиру ще більше погіршує порушення навчання та здатність просторової пам’яті у мишей APP/PS1. Однак ці симптоми значно покращились при лікуванні Акк. Ці результати свідчать про те, що Akk може збільшувати клітини слизу та сприяти секреції слизу для відновлення порушеного кишкового бар'єру, тим самим знижуючи рівень LPS та інших протизапальних речовин, покращуючи рівень метаболізму, полегшуючи резистентність до інсуліну в мозку, зменшуючи відкладення Aβ білок, і захищаючи нерви від пошкодження.
Загалом лікування Акк ефективно покращувало дисфункцію кишкового бар’єру, порушення метаболізму глюкози та ліпідів та полегшувало когнітивні порушення за рахунок зменшення рівня відкладення бляшок Aβ у мозку. Ці висновки свідчать про те, що поліпшувальний ефект лікування Акк на когнітивні функції може бути пов’язаний з відновленням метаболічних розладів і, одночасно, зменшенням частоти патології Aβ. Наші висновки дадуть нове розуміння того, що добавки Akk, як очікується, будуть новою стратегією для профілактики та лікування АД.
Список літератури
Кульманн, Дж., Андреассон, У. і Панні, Дж. CSF Aá1-42: чудовий, але складний біомаркер Альцгеймера - шлях до стандартизації. Клін. Чим. Acta 467, 27–33 (2016).
Стоун, Дж. Г. та співавт. Межі терапії хвороби Альцгеймера. Тер. Адв. Хронічний дис. 2, 9–23 (2011).
- Захисна дія естрогену на гендерно-специфічний розвиток гіпертонії, спричиненої дієтою
- Захисна дія на експериментальних моделях запалення оліви незайманої з поліфенолом
- Вплив ожиріння та фібриляції передсердь, патогенез та прогноз
- Застосування капусти Skunk, побічні ефекти, взаємодія, дозування та попередження
- Дієта сплячої краси Жінки приймають заспокійливі препарати, щоб отримати тонкий ризик небезпечних побічних ефектів