Загальний обсяг нирок та печінки є основним фактором ризику недоїдання у амбулаторних хворих з аутосомно-домінантною полікістозом нирок
Анотація
Передумови
У пацієнтів з аутосомно-домінантною полікістозом нирок (ADPKD) може розвиватися гіпотрофія, оскільки знижується функція нирок та збільшуються органи черевної порожнини. Ми досліджували взаємозв'язок внутрішньочеревної маси з харчовим статусом.
Методи
Це поперечне дослідження було проведено в амбулаторії вищої лікарні. Були зібрані антропометричні та лабораторні дані, включаючи сироватковий креатинін, альбумін та холестерин, а також вимірювали обсяги нирок та печінки. Загальний обсяг нирок та печінки визначався як сума об’ємів нирок та печінки та регулювався за висотою (htTKLV). Харчовий статус оцінювали за допомогою модифікованої суб'єктивної глобальної оцінки (SGA).
Результати
Загалом у 288 пацієнтів (47,9% жінок) середній вік становив 48,3 ± 12,2 року, а середня оціночна швидкість клубочкової фільтрації (РКШ) - 65,3 ± 25,3 мл/хв/1,73 м 2. З цих пацієнтів 21 (7,3%) мали легке та середнє недоїдання (оцінка SGA 4 та 5), а 63 (21,7%) мали ризик недоїдання (оцінка SGA 6). Загалом, пацієнти з недоїданням або з ризиком недоїдання були старшими, мали нижчий індекс маси тіла, нижчий рівень гемоглобіну та гіршу функцію нирок порівняно з добре харчуваною групою. Однак статистично значущих відмінностей у цих параметрах у пацієнтів жіночої статі не спостерігалось, за винятком СКФР. На відміну від цього, більш високий рівень htTKLV корелював з нижчим показником SGA, навіть у суб'єктів із коефіцієнтом коефіцієнта коефіцієнта коефіцієнта коефіцієнта коефіцієнта корисної дії ≥45 мл/хв/1,73 м 2. Суб'єкти з htTKLV ≥2340 мл/м показали у 8,7 разів вищий ризик гіпотрофії після корекції віку, гемоглобіну та eGFR.
Висновки
Харчовий ризик був виявлений у 30% амбулаторних пацієнтів з ADPKD із відносно хорошою функцією нирок. Внутрішньочеревна органомегалія була пов’язана з харчовим статусом незалежно від погіршення функції нирок.
Передумови
Недоїдання збільшує смертність, захворюваність та тривалість перебування в лікарні в різних клінічних умовах, включаючи стаціонар загалом, а також у печінкової недостатності та хворих на рак [1]. При хронічній хворобі нирок (ХХН) поширеність недоїдання зростає до 30–40% пацієнтів, а білково-енергетичне недоїдання є одним із найсильніших предикторів захворюваності та смертності [2, 3]. У попередніх дослідженнях харчові маркери, такі як сироватковий альбумін, креатинін, індекс маси тіла (ІМТ) та оцінка суб'єктивної глобальної оцінки (SGA), були незалежними предикторами смерті та невдалого лікування при ХХН [4, 5]. Харчовий статус перед трансплантацією також впливає на результати трансплантації нирок [6]. Тому були докладені зусилля щодо встановлення керівних принципів для правильної оцінки харчового стану хворих на ХХН та втручання для поліпшення їх результатів [7]. Однак значення харчових маркерів на ранній стадії ХХН не було ретельно оцінено у пацієнтів з ранніми стадіями ХХН.
Аутосомно-домінантна полікістозна хвороба нирок (ADPKD) є найпоширенішим спадковим захворюванням нирок і може прогресувати до термінальної стадії ниркової хвороби (ESRD) у міру зростання кісти нирки. Поширеність кіст печінки у пацієнтів з ADPKD становила 58% у пацієнтів у віці 15–24 років та до 94% пацієнтів старше 35 років [8]. Багато нездатних ускладнень може розвинутися в міру зростання кіст, що спричиняють масивну органомегалію. З попереднього дослідження повідомлялося, що масовий ефект через органомегалію викликав симптоми, пов'язані з тиском (46,5%), біль (58,8%), шлунково-кишкові симптоми (32,4%) та обструктивні ускладнення, які можуть призвести до набряку ніг (20,4%), асциту (16,6 %) та інфекції (3,1%) [9]. У цих пацієнтів вплив тиску на збільшені органи може також призвести до поганого прийому всередину та, зрештою, недоїдання. Іноді масивна органомегалія вимагає втручань щодо зменшення об’єму для полегшення симптомів та поліпшення якості життя пацієнта [10].
При ADPKD масові наслідки збільшення обсягу нирок та печінки можуть посилити гіпотрофію навіть на ранніх стадіях захворювання нирок [11]. Тому оцінка стану поживності навіть на ранніх стадіях ADPKD зі значною органомегалією рекомендується для забезпечення своєчасних втручань, що призводять до подальшого поліпшення клінічних результатів, як у пацієнтів з полікістозом печінки [11, 12]. Однак традиційні антропометричні параметри, такі як маса тіла та ІМТ, мають обмежене значення через нирки та печінку, наповнені рідиною. У цьому дослідженні ми оцінили харчовий статус амбулаторних пацієнтів з АДПКД, використовуючи СГА як стандартний метод, та визначили внутрішньочеревний обсяг органів як незалежний фактор ризику недоїдання.
Методи
Населення пацієнтів
У це дослідження були включені пацієнти ADPKD, які відвідували клініку полікістозу нирок в Національній університетській лікарні Сеула з грудня 2013 року по березень 2014 року. Були включені пацієнти віком від 18 років, які погодились взяти участь у дослідженні. Сканування черевної комп’ютерної томографії (КТ) у пацієнтів з АДПКД брали через рік з клінічною метою як стандартизований протокол оцінки під час амбулаторної клініки [13]. Пацієнти з активним раком, активною інфекцією, ХХН 5 стадії на момент зарахування, ШОЗ, що отримували замісну ниркову терапію, або в анамнезі об’ємно-редукційні терапії печінки (трансартеріальна емболізація, резекція або трансплантація печінки) через тяжку полікістоз печінки виключено. Електронні медичні записи були переглянуті ретроспективно та виявлено 31 пацієнта, який відповідав критеріям виключення.
Оскільки це дослідження було поперечним перерізом з використанням клінічних даних, і воно не передбачало подальшого інвазивного втручання, лікування або витрат на пацієнтів, дослідження отримало звільнення від згоди і воно було схвалено Інституційною комісією з огляду Національної університетської лікарні Сеула ( H-1407-083-594). Запис пацієнта було деідентифіковано та проаналізовано анонімно. Це дослідження було проведено відповідно до Гельсінської декларації.
Суб’єктивна глобальна оцінка та збір клінічних даних
Оцінка SGA - це метод оцінки поживності, який був добре перевірений в різних умовах і базується на клінічній історії та фізичному обстеженні. Харчова оцінка була підтверджена у хворих на ХХН як провісник ускладнень та результатів [10–13]. На основі цих результатів SGA рекомендовано в керівних принципах Ініціативи з якості захворювань нирок як інструмент оцінки поживності, особливо для хворих на ХХН [7]. SGA часто використовується як еталонний метод для оцінки нових методів оцінки поживності.
Вимірювання об’єму нирок та печінки
У нашій клініці полікістозу нирок кожні два роки проводили КТ черевної порожнини. Остання КТ черевної порожнини на момент оцінки поживності використовувалась для вимірювання загального об’єму печінки (TLV) та загального об’єму нирок (TKV). Середній інтервал часу між КТ та оцінкою поживності становив 12,5 ± 12,6 місяців. TLV розраховували шляхом додавання добутку товщини зрізу та площі, виміряної на наборі суміжних зображень, сформованих КТ, за допомогою програмного забезпечення Rapidia 2.8 CT (INFINITT Healthcare Co. Ltd, Сеул, Корея). TKV оцінювали за допомогою еліпсоїдного методу [19]. У цьому дослідженні використовували регульований по висоті TLV (htTLV, мл/м) і TKV з регульованим по висоті (htTKV, мл/м). Загальний об’єм нирок і печінки з урахуванням висоти (htTKLV, мл/м) визначався як сума значень htTLV та htTKV.
Статистичний аналіз
Для статистичного аналізу між статями ми використовували студента т-тест на змінні з нормальним розподілом та використаний тест Манна-Уітні для змінних з ненормальним розподілом (зріст, вага, білок, альбумін, htTLV, htTKV та htTKLV). Щодо балів SGA, усіх пацієнтів класифікували на три групи: м’яко та помірно недоїдали (оцінка SGA 4–5), групи ризику (оцінка SGA 6) та добре харчувались (оцінка SGA 7), оскільки жоден Оцінка SGA менше 4 [20]. Для статистичного аналізу ми використовували тест лінійної асоціації або тест Джонкхеера-Терпстри для аналізу стор-для тенденції серед трьох груп SGA. P-значення
Результати
Базові характеристики
Всього в аналіз було включено 288 пацієнтів, з них 138 (47,9%) - жінки. Середній вік становив 48,3 ± 12,2 року, без суттєвої різниці за статтю. Середні показники SGA були подібними (6,7 ± 0,6 проти 6,6 ± 0,6, стор = 0,197) між статями. Середній коефіцієнт коефіцієнта шуму становив 65,3 ± 25,3 мл/хв/1,73 м 2, а коефіцієнт коефіцієнта шуму був вищим у пацієнтів жіночої статі (62,3 ± 24,5 мл/хв/1,73 м 2 проти 68,5 ± 25,8 мл/хв/1,73 м 2, стор = 0,035). Суттєвої різниці в рівні альбуміну між статями не було. Розподіл стадій ХХН був наступним: 52 пацієнти (18,1%) перебували у стадії 1 ХХН, 116 (40,3%) були у стадії 2, 53 (18,4%) були у стадії 3А, 46 (16,0%) були у стадії 3В, а 21 (7,3%) були на стадії 4. Розподіл ХХН не показав різниці між статями. Двісті тридцять вісім пацієнтів (82,6%) мали гіпертонію, а 227 пацієнтів (78,8%) мали кісти печінки. Чоловіки мали вищу поширеність гіпертонії (чоловіки; 134 пацієнти, 89,3% та жінки; 104 пацієнти, 75,4%, стор = 0,002) і менша поширеність кіст печінки. (чоловіки; 101 пацієнт, 67,3% та жінка 126 пацієнтів, 91,3%, стор Таблиця 1 Характеристики пацієнта на вихідному рівні відповідно до поживного стану за оцінкою SGA
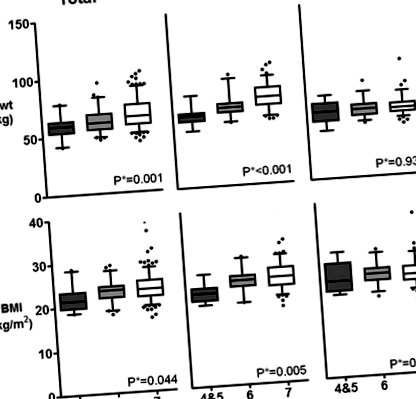
Пацієнти з гіпотрофією (SGA 4–5) або з ризиком гіпотрофії (SGA 6) були старшими за добре харчувану групу (SGA 7) (середній вік 53,4 ± 11,1 року проти 52,7 ± 12,6 років проти 46,4 ± 11,7 років відповідно p для тренду 2 проти 23,3 ± 2,6 кг/м 2 проти 23,7 ± 2,9 кг/м 2, відповідно p для тренду 0,044), як правило, демонструє нижчі значення у пацієнтів із нижчими показниками SGA. Однак ця тенденція спостерігалася лише у пацієнтів чоловічої статі, і жоден з антропометричних параметрів не показав статистично значущих відмінностей у пацієнтів жіночої статі (рис. 1).
Співвідношення між показником SGA та антропометричними харчовими параметрами. a вага тіла (Bwt) і b індекс маси тіла (ІМТ). P*; стор для тренду, SGA; суб'єктивна глобальна оцінка, SGA 7, добре харчується; SGA 6, в зоні ризику; SGA 5, слабко недоїдає; SGA 3–4, помірно недоїдає
Що стосується лабораторних показників, то знижені значення коефіцієнта коефіцієнта коефіцієнта коефіцієнта шуму (51,3 ± 23,2 мл/хв/1,73 м 2 проти 57,1 ± 24,9 мл/хв/1,73 м 2 проти 69,2 ± 24,6 мл/хв/1,73 м 2 відповідно, стор для тренду Рис. 2
Співвідношення між шкалою SGA та наступними лабораторними маркерами. a розрахункова швидкість клубочкової фільтрації (eGFR), b гемоглобін (Hb), c альбумін, і d загальний холестерин (загальний хол). P*; стор для тренду, SGA; суб'єктивна глобальна оцінка, SGA 7, добре харчується; SGA 6, в зоні ризику; SGA 5, слабко недоїдає; SGA 3–4, помірно недоїдає
Гіпертонія показала вищу поширеність у нижчих групах СГА (100, 87,3 та 79,4% відповідно, стор для тренду = 0,011). Однак статистичної різниці в поширеності кісти печінки серед груп СГА не було (стор для тренду = 0,16) (Таблиця 1).
Коли ми порівняли різні дані між показниками SGA 4 та 5 (недоїдання) з 6 та 7 (з ризиком або добре харчуванням), були отримані подібні результати (додатковий файл 1: Таблиця S2).
htTKLV асоціювався з SGA незалежно від eGFR
Нижні показники SGA відповідали вищим значенням htTKLV (медіана 2622 мл/м; IQR 1719–4906 мл/м проти медіани 2147 мл/м; IQR 1535–2687 мл/м проти медіани 1649 мл/м; IQR 1311–2151 мл/м, відповідно, стор для тренду Рис. 3
Співвідношення між показником SGA та обсягом живота. a загальний об'єм нирок і печінки з урахуванням висоти (htTKLV), b загальний об'єм нирок з урахуванням висоти (htTKV) та c загальний об’єм печінки з урахуванням висоти (htTLV); d кореляція між показником SGA та обсягом живота у суб'єктів із коефіцієнтом коефіцієнта ШКФ ≥45 мл/хв/1,73 м 2 . P*; стор для тренду, SGA; суб'єктивна глобальна оцінка, SGA 7, добре харчується; SGA 6, в зоні ризику; SGA 5, слабко недоїдає; SGA 3–4, помірно недоїдає
Аналіз кривої ROC був використаний для порівняння об'ємних параметрів для виявлення порогового прогнозу гіпотрофії (СГА 4–5) щодо стану добре харчується (оцінка СГА 7). Оскільки оцінка за шкалою SGA 6 може бути неоднозначною через обмеження самої SGA, ми побудували криву ROC, використовуючи дані оцінки SGA 7 (нормальна) та 4–5 (недоїдання). Площа під кривою (AUC) htTKLV була більшою (0,727), ніж площа htTKV (0,687) та htTLV (0,645). Порогове значення для htTKLV становило 2340 мл/м, з чутливістю 66,7% та специфічністю 81,4% (рис. 4). Для порівняння, під час аналізу кривої ROC між станом ризику або недоїданням над добре харчуваним станом (SGA 4–6 проти 7) були отримані подібні, але менш значущі результати (AUC htTKLV, htTKV та htTLV становили 0,658, 0,646 та 0,571 відповідно), а граничне значення для htTKLV становило 2190 мл/м з чутливістю 53,6% та специфічністю 76,5% (дані не наведені).
ROC-крива htTKLV, порівнюючи показники SGA від 4 і 5 до 7. ROC; робочі характеристики приймача, SGA; суб'єктивна глобальна оцінка, SGA 7, добре харчується; SGA 6, в зоні ризику; SGA 5, слабко недоїдає; SGA 3–4, помірно недоїдає
Загальновідомо, що збільшення нирок тісно пов’язане з нирковою недостатністю у хворих на АДПКД [21]. Як і очікувалось, коефіцієнт коефіцієнта коефіцієнта шуму знизився, оскільки показник SGA зменшився (рис. 2), а частка пацієнтів із нижчими показниками SGA зросла у наших пацієнтів, оскільки стадії ХХН зросли з 1 до 3 (рис. 5). Коли ми стратифікувались на стадію ХХН, навіть на стадіях 1 та 2 стадії ХХН 15,4 та 20,9% пацієнтів або недоїдали, або мали ризик недоїдання відповідно. Серед пацієнтів із ХХН 3 та 4 стадій 43,4 та 42,8% або недоїдали, або мали ризик недоїдання відповідно. У пацієнтів із ХХН стадії 4 частка пацієнтів із нижчим показником SGA була трохи нижчою, ніж серед пацієнтів із ХХН стадії 3B, що могло бути пов’язано з відносно невеликою кількістю пацієнтів із ХХН стадії 4 або через те, що ми виключили пацієнтів з важкою органомегалією які вже перенесли хірургічне втручання.
Розподіл балів SGA за стадіями ХХН. P-значення отримували за допомогою точного критерію Фішера. Бари вказати відсоток пацієнтів у кожній категорії. ХХН; хронічні захворювання нирок, СГА; суб'єктивна глобальна оцінка
Для того, щоб мінімізувати незрозумілий ефект ниркової недостатності, аналіз підгрупи проводили у пацієнтів із коефіцієнтом коефіцієнта ШКФ ≥45 мл/хв/1,73 м 2 (стадії ХХН 1–3A). У цих пацієнтів лише htTKLV продемонстрував значну зв'язок з показниками SGA (рис. 3d).
Використовуючи 2340 мл/м як граничне значення htTKLV на основі аналізу кривої ROC, використовували логістичний регресійний аналіз для оцінки співвідношення шансів між недоїдаючим (оцінка SGA 4–5) та добре харчуваною групою (SGA оцінка 7) з використанням змінних, які показали статистичну значимість серед груп SGA. Пацієнти з htTKLV ≥2340 мл/м показали вищий ризик недоїдання (показник SGA 4–5) (співвідношення шансів = 8,74, 95% довірчий інтервал 3,30–23,13, стор
Обговорення
Ниркова недостатність сама по собі може сприяти гіпотрофії та витраті білкової енергії [27]. Ми також спостерігали збільшення частки пацієнтів з недоїданням у міру розвитку стадії ХХН. Частка пацієнтів з нижчим балом SGA була трохи нижчою на стадії 4 ХХН, ніж пацієнти 3B стадії, що, можливо, було пов'язано з відносно невеликою кількістю пацієнтів із ХХН стадії 4 або тому, що ми виключили пацієнтів з важкою органомегалією, які вже перенесли хірургічну операцію втручання. Крім того, коли ми аналізували параметри за шкалами SGA, більшість антропометричних або лабораторних параметрів, які широко використовуються як маркери харчового статусу, не змогли продемонструвати зв'язок з показниками SGA, за винятком функції нирок. Цей висновок про те, що функція нирок була суттєво пов’язана з показниками SGA, свідчить про необхідність регулярної оцінки стану харчування у пацієнтів з ADPKD у міру прогресування захворювання.
Асоціація параметрів з оцінками SGA різнилася у статей. У пацієнтів чоловічого віку літній вік, нижча маса тіла, нижчий ІМТ та нижчий рівень гемоглобіну були пов’язані з нижчими показниками SGA, але цих взаємозв’язків не спостерігалося у пацієнтів жіночої статі. Одним із пояснень могло б бути порівняно менша м’язова маса жінок у порівнянні з чоловіками, зміни маси тіла та ІМТ, спричинені недоїданням, можуть бути занадто малі, щоб їх можна було виявити в популяції азіатських жінок. Більше того, збільшені кісти, асцит або набряки, які є частими ускладненнями у пацієнтів з ADPKD, можуть маскувати зменшення м’язової маси або частки жиру в організмі. Лабораторні параметри, такі як гемоглобін, загальний білок, альбумін або загальний холестерин, були недостатньо чутливими для виявлення змін харчового статусу на ранніх стадіях недоїдання. Таким чином, будуть потрібні подальші дослідження, щоб підтвердити цю знахідку в інших когортах та з’ясувати причину, включаючи аналіз м’язової маси. Також слід розробити інші маркери стану харчування для пацієнтів з ADPKD, особливо для пацієнтів ADPKD.
У цьому дослідженні ми виявили, що 23,5% пацієнтів мали проблеми з харчуванням (показник SGA ≤6) навіть на ранній стадії ХХН (стадія 1-3a). Крім того, підвищення htTKLV було незалежним фактором ризику після коригування функції нирок за допомогою багатоваріантної моделі логістичної регресії. Інші харчові біомаркери, такі як преальбумін, інсуліноподібний фактор росту-1 або трансферин, у цьому дослідженні не оцінювались. htTKLV може надати цінну інформацію про стан харчування, а також про прогресування хвороби, але вимірювати за допомогою сучасних методів досить громіздко. Тому необхідна розробка нових інструментів для оцінки харчування хворих на ADPKD, і такі інструменти були б корисними для поліпшення довгострокових результатів пацієнта.
Висновки
На закінчення, виявлення маргінального недоїдання у пацієнтів амбулаторних клінік ADPKD та започаткування належної підтримки може зіграти важливу терапевтичну роль, особливо у пацієнтів із зниженою функцією нирок або підвищеним htTKLV.
- Чому недоїдання є проблемою для більш ніж половини пацієнтів в реанімації
- Чому томат шкідливий для ниркових пацієнтів Ниркова дієта від nikita sharma Medium
- Найкращий корм для собак з низьким вмістом білка для здоров'я нирок та печінки у 2020 році
- Результати загальної ендопротезування колінного суглоба у хворих із ожирінням пацієнтів систематичний огляд
- Талія без ваги Ключ до неалкогольної жирової хвороби печінки Хворі на ожиріння з великою талією