Споживання натрію, але не ниркових нервів, послаблює зміни ниркової гемодинаміки щурів, спричинені нирковим венозним тиском.
Нефрологічний відділ, Медичний факультет, Університет Альберти, Едмонтон, Альберта, Канада
Нефрологічний відділ, Медичний факультет, Університет Альберти, Едмонтон, Альберта, Канада
Кафедра фізіології, Університет Альберти, Едмонтон, Альберта, Канада
Нефрологічний відділ, Медичний факультет, Університет Альберти, Едмонтон, Альберта, Канада
Біомедична фізіологія та кінезіологія, Університет Саймона Фрейзера, Бернабі, Британська Колумбія, Канада
Нефрологічний відділ, Медичний факультет, Університет Альберти, Едмонтон, Альберта, Канада
Кафедра фізіології, Університет Альберти, Едмонтон, Альберта, Канада
Адреса для запитів на передрук та іншої кореспонденції: B. Braam, Univ. лікарні Альберти, кафедра медицини/Див. Нефрологія та імунологія, 11-132 CSB Clinical Sciences Bldg., Edmonton, AB T6G 2G3, Канада (e-mail: [email protected]).
Анотація
Підвищення центрального венозного тиску та ниркового венозного тиску (RVP) пов'язані з погіршенням функції нирок при гострому загостренні застійної серцевої недостатності. Ми перевірили, чи гостре ізольоване підвищення рівня RVP в одній нирці призводить до іпсилатеральної вазоконстрикції нирок та зниження швидкості клубочкової фільтрації (ШКФ), і чи залежить це від вживання харчової солі або активації ниркових нервів. Самці щурів Льюїса отримували звичайну (1% NaCl, NS) або високосолену (6% NaCl) дієту протягом ≥14 днів до гострого експерименту. Потім щурів рандомізували на наступні три групи: контроль часу та підвищення рівня RVP до 10 або 20 мм рт. Ст. Для оцінки частоти серцевих скорочень, ниркового кровотоку (RBF) та ШКФ. Для збільшення RVP ліва ниркова вена була частково закупорена протягом 120 хв. Для визначення ролі ниркових нервів проводили хірургічну денервацію у щурів на обох дієтах. Активність ниркових симпатичних нервів (RSNA) додатково реєстрували в окремій групі щурів. Збільшення RVP до 20 мм рт.ст. знижує іпсилатеральний RBF (7,5 ± 0,4-4,1 ± 0,7 мл/хв., P −1 · мм рт. Ст. −1, P 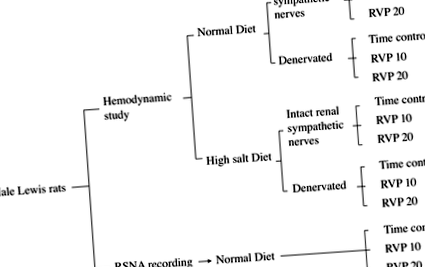
Рис. 1.Блок-схема експериментальної групової організації дослідження.
Підготовка
Ниркові гемодинамічні експерименти.
Після лапаротомії середньої лінії оголили ліву нирку. Ліву вену надниркових залоз або надшерстну вену канюлювали (Micro-Renathane MRE-025; Braintree Scientific, Braintree, MA), і канюлю просували до тих пір, поки кінчик не впирався в основну ниркову вену для прямого вимірювання RVP. Пролен довжиною 3–0 (Джонсон-Джонсон, Сан-Лоренцо, Пуерто-Рико) прослизали навколо лівої ниркової вени в місці її з’єднання з нижньою порожнистою веною і обшивали невеликим шматочком труби PE-90 для створення слінгу. Щоб збільшити RVP, стропу натягнули, щоб звузити ниркову вену. Зонд для потоку часу транзиту 1RB був розміщений навколо лівої ниркової артерії для прямого вимірювання RBF (Transonic, Ithaca, NY). Лівий сечовід був катетеризований для збору сечі (PE-10; BD Intramedic). Щур отримував додаткові рідини під час хірургічної підготовки [5% бичачий сироватковий альбумін (BSA), A7906; Sigma, Oakville, ON] з 250 мкг/хв FITC-інуліну (Sigma) при 1,5 мл/год. Ця інфузія продовжувалась протягом експерименту з 1% BSA з 250 мкг/хв FITC інуліну при 1,5 мл/год.
Ниркова денервація.
Щурів готували, як описано, за винятком того, що ниркові нерви, що курсували уздовж лівої та правої ниркових судин, були хірургічно видалені, а ниркові судини забарвлені 10% фенолом у 70% етанолі.
Нирково-симпатична нервова діяльність.
Експериментальний дизайн
Після завершення хірургічного інструментарію щурів стабілізували протягом 60 хв. Базові дані збирали протягом 60 хв, після чого RVP селективно підвищували до 10 або 20 мм рт. Ст. Шляхом поступового звуження лівої ниркової вени або не маніпулювали (контроль часу). Збір даних тривав ще 120 хв. Для гемодинамічних експериментів зразки крові (200 мкл) отримували на початку базового періоду та кожні 60 хв після цього. Зразки сечі, відкладені за часом, збирали кожні 30 хв. Під час експериментів з реєстрацією нервів не проводилось забору крові та сечі.
Аналітичні методи
Для визначення ШКФ за допомогою FITC-інуліну зразки плазми та сечі розводили у 0,5 моль/л HEPES (рН 7,4) для підтримки фізіологічного рН. Для завантаження по 50 мкл кожного розчину в двох примірниках використовували чорну пластину з 96 лунками (Greiner, Monroe, NC). Флуоресценцію визначали за допомогою флуорометра Fluoroskan Ascent Microplate Fluorometer (Thermo Fisher Scientific, Вантаа, Фінляндія) при довжині хвилі збудження 485 нм та довжині хвилі випромінювання 527 нм. Кінцеві зразки крові отримували із стегнового катетера для вимірювання рівня реніну в плазмі крові методом ІФА (NOVATEINBIO, Кембридж, Массачусетс).
Для визначення RSNA загальну кількість спайків над фоном визначали кількісно за допомогою програмного забезпечення Spike Histogram (лабораторна діаграма 8; ADInstruments). Шість вимірювань було проведено протягом базового періоду запису та усереднено. Вимірювання проводили з інтервалом у 5 хвилин протягом перших 30 хвилин збільшення RVP та з інтервалом у 30 хвилин після цього. Кількісна оцінка відповіді RSNA на підвищений RVP була розрахована як відсоток зміни RSNA від вихідного рівня.
Аналіз та статистика
Дані представлені у середньому за 30-хвилинні інтервали поспіль. Базову характеристику порівнювали як інтактних, так і денервованих щурів на нормальному харчуванні та дієті з ГС, використовуючи загальну лінійну модель багатоваріантності (MANOVA) з тестом Bonferroni post hoc. Для оцінки впливу підвищеного рівня RVP використовували багаторазову лінійну модель з повторним вимірюванням для порівняння кожної точки часу трьох груп як знежирених, так і інтактних тварин на різні дієти, використовуючи Бонферроні як пост hoc тест. Рівні реніну та альдостерону в плазмі крові аналізували за допомогою одностороннього аналізу ANOVA за допомогою пост-тесту Student-Newman-Keuls. Дані були перетворені в журнал або ранжировані, якщо вони зазвичай не розподілялись. Дані RSNA аналізували за допомогою двостороннього повторного вимірювання ANOVA за допомогою пост-тесту Student-Newman-Keuls. Дані аналізували за допомогою SPSS 24 (IBM, Armonk, NY) та SigmaPlot 13 (Systat, Сан-Хосе, Каліфорнія). Статистичне значення було прийнято на P
Таблиця 1. Характеристика вихідних груп щурів Льюїса, які підтримували нормальну дієту з високим вмістом солі
Значення - середні значення ± SE; n, ні. щурів. ЧСС, частота серцевих скорочень; MAP, середній артеріальний тиск; RVP, нирковий венозний тиск; RBF, нирковий кровотік; RVC, провідність судин нирок; ШКФ, швидкість клубочкової фільтрації.
* P ** P # P ## P † n = 14.
Збільшення RVP та ниркової гемодинаміки
Підвищений RVP не впливав на MAP, незалежно від дієти та наявності або відсутності ниркових нервів (рис. 2; усі дані представлені в таблиці 2). ЧСС зменшувалася при значному підвищенні RVP (рис. 3A). Помірне збільшення RVP (від 0,3 ± 0,2 до 12,5 ± 0,8 мм рт.ст.) викликало значне зниження RBF до 73 ± 5% (P
Рис.2.Середній артеріальний тиск (MAP) у відповідь на підвищення ниркового венозного тиску (RVP) у всіх щурів Льюїса. Перші дві часові точки кожного графіку представляють базову лінію. Останні чотири часові точки (чорна смужка) представляють або контроль (●, контроль), помірне піднесення RVP (□, RVP 10) та основне піднесення RVP (△, RVP 20). Збільшення RVP не вплинуло на MAP (мм рт. Ст.) Ні в одній із нормальних солей (NS) інтактною (A), з високим вмістом солі (HS) цілим (B), NS денервований (C.), або HS денервований (D) щури.
Таблиця 2. Усі характеристики групи як вихідної, так і кінцевої точки від інтактних щурів Льюїса, які підтримували нормальну та високосолену дієту
Значення - середні значення ± SE; n, ні. щурів. HCT, гематокрит; ЧСС, частота серцевих скорочень; MAP, середній артеріальний тиск; RVP, нирковий венозний тиск; RBF, нирковий кровотік; RVC, провідність судин нирок; ШКФ, швидкість клубочкової фільтрації; RVP 10, помірне збільшення RVP; RVP 20, значне збільшення RVP.
* P ** P
Рис.3.Зміна частоти серцевих скорочень (ЧСС) у відповідь на підвищення ниркового венозного тиску (RVP) у всіх щурів Льюїса. Перші дві часові точки кожного графіку представляють базову лінію. Останні чотири часові точки (чорна смужка) представляють або контроль (●, контроль), помірне піднесення RVP (□, RVP 10) та основне піднесення RVP (△, RVP 20). Помірне підвищення рівня RVP не впливало на HR у інтактних щурів із нормальною сіллю. Велике підвищення рівня RVP спричинило значне зниження ЧСС порівняно з контрольними тваринами (A, *P
Рис.4.Зміна ниркового кровотоку (RBF) у відповідь на підвищення ниркового венозного тиску (RVP) у всіх щурів Льюїса. Перші дві часові точки кожного графіку представляють базову лінію. Останні чотири часові точки (чорна смужка) представляють або контроль (●, контроль), помірне піднесення RVP (□, RVP 10) та основне піднесення RVP (△, RVP 20). У інтактних щурів збільшення RVP (RVP 10 і RVP 20) зменшувало RBF (A, *P
Рис.5.Зміна нирково-судинної провідності (RVC) у відповідь на підвищення ниркового венозного тиску (RVP) у всіх щурів Льюїса. Перші дві часові точки кожного графіку представляють базову лінію. Останні чотири часові точки (чорна смужка) представляють або контроль (●, контроль), помірне піднесення RVP (□, RVP 10) та основне піднесення RVP (△, RVP 20). Помірне підвищення рівня RVP не знижувало RVC у всіх щурів. Значне збільшення RVP зменшило RVC у нормальних солей (NS) інтактних щурів (A, *P
Рис.6.Зміна швидкості клубочкової фільтрації (ШКФ) у відповідь на підвищення ниркового венозного тиску (RVP) у всіх щурів Льюїса. Перші дві часові точки кожного графіку представляють базову лінію. Останні чотири часові точки (чорна смужка) представляють або контроль (●, контроль), помірне піднесення RVP (□, RVP 10) та основне піднесення RVP (△, RVP 20). Основне підвищення рівня RVP знизило ШКФ значно порівняно з контрольними тваринами за часом (A, *P
Всі ці гемодинамічні реакції були або скасовані, або покращені дієтою ГС. Як помірне (з 1,4 ± 0,3 до 10,8 ± 0,4 мм рт.ст.), так і значне збільшення показника RVP (з 1,6 ± 0,4 до 19,3 ± 0,7 мм рт.ст.) знижувало RBF (P
Таблиця 3. Усі характеристики групи як вихідної, так і кінцевої точки у денервованих щурів Льюїса, які підтримували нормальну та високосолену дієту
Значення - середні значення ± SE; n, ні. щурів. HCT, гематокрит; ЧСС, частота серцевих скорочень; MAP, середній артеріальний тиск; RVP, нирковий венозний тиск; RBF, нирковий кровотік; RVC, провідність судин нирок; ШКФ, швидкість клубочкової фільтрації; RVP 10, помірне збільшення RVP; RVP 20, значне збільшення RVP.
* P ** P
Рис.7.Активність ниркових симпатичних нервів (RSNA) у відповідь на підвищення рівня ниркового венозного тиску (RVP) у щурів Льюїса, які отримували нормальну сольову дієту. Дані RSNA представлені з використанням відсотка базового рівня. 10 часових точок (чорна смужка) представляють або контроль (●, контроль), помірне піднесення RVP (□, RVP 10) або велике підняття RVP (△, RVP 20). Помірне збільшення RVP не вплинуло на RSNA. На відміну від цього, посилене збільшення RVP негайно пригнічує RSNA (*P
Підвищений рівень RVP, рівня реніну в плазмі та альдостерону
Загальний рівень реніну в плазмі крові у тварин з НС був вищим (P
Таблиця 4. Рівень реніну та альдостерону у плазмі крові всіх груп
Значення є середніми ± SE. ТК, контроль часу; RVP 10, помірне підвищення ниркового венозного тиску; RVP 20, значне підвищення ниркового венозного тиску; NS, нормальна сіль; ГС, висока сіль.
* P ** P # P ## P 20 мм рт. Ст. Цю відповідь приписували ниркові нерви, оскільки денервація запобігала будь-якому зменшенню RVC (5). Нещодавнє дослідження на щурах продемонструвало, що підвищення центрального венозного тиску до 10 мм рт.ст. (що, імовірно, збільшує RVP на таку саму ступінь) збільшило RSNA на 285% (20). Однак пневмоперитонеум, індукований у щурів у цьому дослідженні, міг активувати RSNA за допомогою інших механізмів, ніж підвищений RVP.
На противагу цьому, Копп та ін. повідомив, що збільшення RVP до 22 мм рт.ст. зменшує іпсилатеральний RVC, результати якого узгоджуються з нашими висновками. Вони також показали, що підвищений RVP збільшує активність аферентного ниркового нерва, але знижує еферентну активність ниркового нерва та гальмує реноренальний рефлекс (13). Наші результати узгоджуються, припускаючи, що гемодинамічні зміни, які ми спостерігаємо при гострому значному збільшенні RVP, швидше за все, не опосередковуються нирковими нервами. Очевидною залишається можливістю є те, що у наших нирково денервованих щурів активація внутрішньониркової RAS все ще може мати місце і викликати спостережуване зниження RBF та RVC. Це підтверджується нашими спостереженнями у денервованих щурів на дієті ГС, у яких ця реакція послаблюється, і що у денервованих щурів, які харчуються НС, значне збільшення RVP викликало більш високе вивільнення альдостерону.
Перспективи
Дані сумісні із ситуацією підвищеного RVP внаслідок венозного застою, такого як комбінована серцева та ниркова недостатність, де підвищений RVP сприяє порушенню функції нирок. Крім того, у пацієнтів з хронічними захворюваннями нирок пошкодження тубулоінтерстицію може посилити ниркову реакцію на збільшення рівня RVP. Більше того, зменшення HR у цьому відношенні свідчить про потенційний системний вплив підвищеного RVP, що може ще більше посилити серцево-ниркову недостатність. Незважаючи на те, що можуть бути задіяні декілька механізмів, наші дані свідчать про важливу роль RAS. Переактивація RAS при застійній серцевій недостатності може також посилити гемодинамічний ефект підвищеного RVP, породжуючи виражену серцево-судинну та ниркову дисфункцію. Для дослідження цього ключового медіатора необхідні дослідження, що визначають роль RAS шляхом інгібування ангіотензин-перетворюючого ферменту та системної інфузії ANG II.
Дослідження були підтримані грантом Канади від Фонду серця та інсульту. X. Хуанга підтримав Фонд Лі Ка Шинг.
- Переглянуті контрольні значення споживання натрію та хлоридів - FullText - Annals of Nutrition та
- Вживання натрію та гіпертонія
- Виділення сечі з натрієм та калієм та споживання з їжею поперечний аналіз у підлітків
- Екстракт материнки, доданий у раціон молочних телиць, змінює поведінку годування та споживання концентрату
- Purina® Pro Plan® Ветеринарні дієти NF Функція нирок Сухий корм для собак