Взаємозв’язок траєкторії зміни ваги з медіальною атрофією скроневої частки у пацієнтів із легкою хворобою Альцгеймера: результати когортного дослідження
Анотація
Вступ
Втрата ваги була описана у 20% - 45% пацієнтів з хворобою Альцгеймера (АД) і пов’язана з несприятливими наслідками. Запропоновано різні механізми зниження ваги у хворих на АД, хоча жоден з них не доведений. Це дослідження мало на меті з’ясувати механізм втрати ваги у хворих на АД шляхом вивчення гіпотези про те, що втрата ваги пов’язана з медіальною атрофією скроневої частки (МТА).
Методи
Пацієнти з когортного дослідження хвороби Альцгеймера (ретроспективне, поздовжнє дослідження 576 хворих на АД, що мешкають у громаді) були включені, коли проводили МРТ головного мозку, за яким можна було оцінити МТА. Щоб дослідити гіпотезу про те, що втрата ваги пов’язана з МТА, ми дослідили, чи залежить траєкторія зміни маси тіла від тяжкості МТА на момент постановки діагнозу (тобто базової лінії). Ми припустили, що пацієнти з більш серйозним MTA на початковому рівні мали б нижчу масу тіла на вихідному рівні та швидше зменшували масу тіла протягом перебігу захворювання. Узагальнена лінійна змішана модель (GLMM) була використана для визначення взаємозв'язку траєкторії зміни ваги з тяжкістю MTA.
Результати
Всього було включено 214 пацієнтів (середній вік 79 років, медіана MMSE 23, середня вага 73,9 кг). Пацієнти з середньою, важкою або дуже важкою МТА на вихідному рівні важили на 3,2 - 6,8 кг більше, ніж пацієнти з відсутністю МТА або легким. Протягом 3,5 років пацієнти набирали в середньому 1,7 кг маси тіла, незалежно від тяжкості їх МТА на вихідному рівні.
Висновки
Ми не виявили жодних доказів того, що MTA пов'язаний із втратою ваги у хворих на АД. Більше того, всупереч очікуваному, пацієнти з АД не втрачали, а набирали вагу під час спостереження.
Вступ
Різні дослідження досліджували взаємозв’язок між масою тіла та хворобою Альцгеймера (AD). З одного боку, надмірна вага пов'язана з гіршою когнітивною функцією [1] і була описана як фактор ризику розвитку АД [2]. З іншого боку, в 1907 році Алоїз Альцгеймер описав втрату ваги у свого першого пацієнта [3], і втрата ваги в даний час визнана клінічною особливістю АД [4]. У цьому дослідженні ми зупинимось на взаємозв'язку між втратою ваги та БА.
Втрата ваги була описана приблизно у 20% - 45% пацієнтів з АД [5-11] і була пов'язана з несприятливими наслідками, такими як прискорене прогресування АД [5,7,11,12], більш високий рівень інституціоналізації [13] та збільшення смертності [14-16]. Запропоновано різні механізми схуднення у хворих на АД [5,17-19], однак жоден з них не доведений.
Регулювання маси тіла є складним і на нього впливають різні фактори, такі як апетит, поведінка годування та ендокринна система [20,21]. Крім того, передбачається, що задіяні різні ділянки мозку, одна з яких - медіальна скронева частка, можливо, впливаючи на споживання їжі та апетит [22-24]. Більше того, атрофія медіальної скроневої частки відображає зміни у функціональних нейроанатомічних мережах, які беруть участь у регуляції маси тіла [22]. Медіальна скронева частка - це місце, де типово присутня патологія АД [25]. На магнітно-резонансній томографії (МРТ) вона виявляє атрофію на самих ранніх стадіях захворювання, яка погіршується в міру прогресування АД [25]. Грундман та ін. показали, що медіальна атрофія скроневої частки (МТА) асоціюється з низькою масою тіла у хворих на АД [22]. Через конструкцію поперечного перерізу в цьому дослідженні було неможливо віднести причинно-наслідкові зв’язки, тобто втрата ваги може бути наслідком МТА або, навпаки, погіршити МТА [17,22]. Якщо останнє відповідає дійсності, збільшення ваги, наприклад, забезпечуючи дієтичні втручання, може запобігти або уповільнити МТА і, можливо, прогресування захворювання.
Кілька досліджень досліджували взаємозв'язок між патологією головного мозку та харчовим статусом у хворих на АД. Результати цих досліджень суперечливі, і жодне з досліджень не зосереджувалось насамперед на взаємозв'язку між MTA та харчовим статусом [26-28]. Метою цього дослідження було з'ясувати механізм втрати ваги у хворих на АД шляхом вивчення гіпотези про те, що втрата ваги пов'язана з МТА.
Методи
Налаштування
Учасники та дизайн дослідження
Пацієнти, які брали участь у когортному дослідженні хвороби Альцгеймера, відвідували клініку пам’яті в період з 2002 по 2012 роки, мали 65 років і старше, на момент постановки діагнозу проживали вдома або в інтернатному закладі та розпочали з ІХЕ. Пацієнти були включені в це дослідження, коли їм було проведено базову оцінку, принаймні одну подальшу оцінку та МРТ головного мозку (виконану за 6 місяців до діагностики АД), на якій можна було оцінити МТА. Щоб вивчити гіпотезу про те, що втрата ваги пов’язана з МТА, ми дослідили, чи залежить траєкторія зміни маси тіла від тяжкості МТА на момент постановки діагнозу (тобто базової лінії). Ми припустили, що пацієнти з більш серйозним MTA на початковому рівні мали б нижчу масу тіла на вихідному рівні та швидше зменшували масу тіла протягом перебігу захворювання. Це дослідження, на яке не вимагалася інформована згода, було схвалено місцевим комітетом з етики Медичного центру Леуварден. Інформована згода не потрібна, оскільки це було ретроспективне дослідження карт, в якому гарантувалася анонімність пацієнтів.
Вимірювання
Соціодемографічна характеристика
Було зафіксовано вік, стать, соціальний статус, використання неформальної та професійної допомоги (тобто допомога в побуті, харчування вдома). Супутню захворюваність оцінювали за кумулятивною шкалою оцінки захворювань (CIRS) із загальними балами від 0 (без порушень) до 56 (надзвичайно важких порушень) [32]. AD як індекс захворювання не був включений до оцінки CIRS. Було зафіксовано кількість ліків поруч із ІЕЗ. Поліфармація визначалася як використання чотирьох або більше ліків поряд із ІЕЗ.
Когнітивне функціонування
Когнітивне функціонування оцінювали за допомогою мінімального обстеження психічного стану (MMSE) [33] та тесту на годинниковий малюнок (CDT). CDT було набрано за системою підрахунку балів Шульмана та ін. у 1993 р., в якому загальний бал коливається від 1 до 6, а оцінка 3 і більше вказує на когнітивні порушення [34].
Поведінкові та психологічні симптоми (BPS) деменції
На підставі інформації про пацієнта та вихователя, що повідомляється самостійно, ми записали, чи був BPS присутній чи відсутній. Оскільки БПС не функціонували за допомогою вимірювального приладу, неможливо було повідомити про тяжкість, характер або частоту БПС.
Тип та дозування ХЕІ
Під час кожного амбулаторного візиту реєстрували тип та дозування ХЕІ та, якщо застосовно, мемантин. У нашій клініці пам’яті галантамін-ретард є першим вибором лікування для пацієнтів з легким та середнім типом АД. Затримку форми галантаміну призначають з 2005 року. До 2005 року галантамін давали двічі на день. Дозу поступово збільшують з 8 міліграмів (мг) на день до 24 мг на день за 8 тижнів.
Поживний статус
Були зафіксовані маса тіла (кг), індекс маси тіла (ІМТ), втрата ваги, апетит та використання пероральних харчових добавок (ОНС), про які повідомляли самі. Втрата ваги, апетит та використання ОНС, про які повідомляли самостійно, реєструвались на основі інформації про пацієнта та доглядача.
Медіальна атрофія скроневої частки (MTA)
МРТ головного мозку отримували за допомогою МРТ-сканера Philips 3.0 Tesla (Philips, Ейндховен, Нідерланди). MTA оцінювали на корональному тривимірному градієнтному T1-зваженому послідовності МРТ. МТА оцінювали за допомогою перевіреної 5-бальної візуальної шкали оцінок, заснованої на оцінці ширини хоріоїдальної щілини, ширини скроневого рогу та висоти гіпокампа [35,36]. Ступінь тяжкості МТА оцінювали від 0 (відсутність атрофії) до 4 (дуже важка атрофія) [35]. Відповідно до інструкцій візуальної шкали оцінок, досліджувались як лівий, так і правий MTA [37,38]. МТА оцінювали незалежно від двох оцінювачів (ED та HB, обидва наукові співробітники), які пройшли навчання з оцінки MTA досвідченим неврологом. Згода між двома оцінювачами вимірювалася шляхом обчислення значення каппа [39]. Розбіжності між ED та HB було вирішено шляхом обговорення з третім оцінювачем (DA).
Статистичний аналіз
Дані аналізували за допомогою Статистичного пакету соціальних наук (SPSS) 16.0 (SPSS Inc., Чикаго, Іллінойс, США) та Програми статистичного аналізу (SAS) 9.2 (SAS Institute Inc., Cary, NC, USA). Гіпотези були перевірені двосторонніми. Ймовірність (P) значення менше 0,05 вважалося статистично значущим. Описова статистика представлена як середнє значення ± стандартне відхилення (SD) для нормально розподілених змінних. Для косих розподілених змінних наводяться медіана та 25–75-й процентилі. Для встановлення розподілу змінної ми використовували тест Колмогорова-Смірнова. Число та пропорція вказані для категоріальних змінних.
Щоб дослідити, чи траєкторія зміни маси тіла залежить від тяжкості МТА на вихідному рівні, траєкторію зміни маси тіла порівнювали між групами оцінок МТА, використовуючи узагальнену лінійну змішану модель (GLMM) [40,41]. GLMM був розроблений для аналізу поздовжніх, залежних даних і забезпечує оцінку зміни залежної змінної (тобто маси тіла) з плином часу. Аналізи GLMM проводились з даними пацієнтів з базовою оцінкою та принаймні однією подальшою оцінкою. В іншому випадку неможливо описати зміну маси тіла з часом. Бази лівого та правого MTA використовувались окремо для аналізів. З шостого (лівого МТА), відповідно п'ятого (правого МТА) моменту вимірювання, не вдалося дати достовірної оцінки зміни маси тіла через невелику кількість пацієнтів, що залишились на той момент. Отже, аналізи GLMM проводили на перших п’яти моментах вимірювання (період 3,5 роки) для лівих оцінок МТА, відповідно на перших чотирьох вимірах (період 2,5 року) для правих оцінок МТА.
Взаємозв'язок лівого MTA і правого MTA з траєкторією ваги аналізували в багатовимірному GLMM, включаючи потенційні змішувачі. Багатофакторний аналіз GLMM проводили за зворотним методом з вагою як основним результатом (тобто залежною змінною). Група МТА, час (тобто кількість моментів вимірювання) та потенційні перешкоди використовувались як незалежні змінні. Потенційними змішувачами були вихідні змінні, пов'язані з ходом ваги в одновимірному аналізі GLMM, він включав: стать (P
Результати
Характеристика пацієнта на вихідному рівні
Включено двісті чотирнадцять пацієнтів. На початковому рівні середній вік становив 79 років (25-75-й процентиль 75,0-82,0), середній показник MMSE 23 (25-75-й процентиль 20,0-25,0) та середня вага 73,8 ± 12,0 кг. Більше половини пацієнтів мали легкий ПЕКЛ і ніхто з хворих не мав тяжкого ПЕ. Майже кожен шостий пацієнт повідомляв про втрату ваги (14,4%), а у тринадцяти пацієнтів (7,1%) був поганий апетит (таблиця 1). Додаткова таблиця підсумовує кількість пацієнтів, у яких спостерігалася втрата ваги, збільшення ваги або відсутність змін у вазі (Таблиця 2).
Медіальна атрофія скроневої частки (MTA)
МРТ проводили медіану за 20,5 днів (25–75-й процентиль 45,0–8,0) до встановлення діагнозу АД. Три пацієнти (1,4%) мали показник MTA 0 (таблиця 1), вони були згруповані за пацієнтами з оцінкою MTA 1, що представляло пацієнтів, які не мали або мали MTA. У 75,4% пацієнтів МТА лівого боку був таким самим, як і правого. Угода між двома оцінювачами була справедливою і доброю для лівого МТА (каппа Коена 0,66) та справедливою для правого МТА (каппа Коена 0,60) [39,42].
Зв'язок лівого MTA з траєкторією зміни ваги
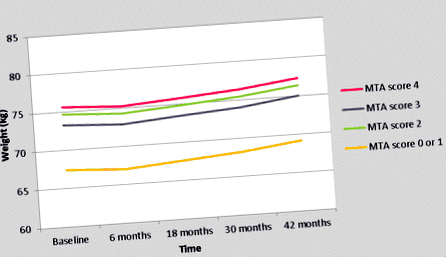
Траєкторія зміни ваги для лівого балу МТА представлена в таблиці 3 та на малюнку 1. Протягом перших 6 місяців маса тіла зменшилась на 0,4 кг у всіх групах МТА (таблиця 3, рисунок 1). Після цього він поступово збільшувався на 2,1 кг протягом наступних 3 років (рисунок 1, таблиця 3). Загалом усі пацієнти набрали в середньому 1,7 кг маси тіла протягом 3,5 років (таблиця 3, малюнок 1). На малюнках 1 та 3 показана очевидна різниця у масі тіла між пацієнтами з оцінкою MTA 0 або 1 у порівнянні з пацієнтами з оцінкою MTA 2, 3 або 4 (таблиця 3, рисунок 1). Через цю чітку різницю з дуже порівнянною траєкторією ваги у пацієнтів з оцінками MTA 2, 3 та 4 ми порівняли траєкторію ваги між пацієнтами з оцінкою MTA 0 або 1, у порівнянні з пацієнтами з оцінкою MTA 2, 3 або 4 (таблиця 4, малюнок 2). Пацієнти з MTA 0 або 1 важили на 6,8 кг менше, ніж пацієнти з MTA 2, 3, 4 в кожен момент під час спостереження, незалежно від потенційних споживачів (P = 0,001). Не було взаємодії лівої оцінки MTA з часом або з чотирма потенційними перешкодами. Як показано в таблиці 5, пацієнти з MTA 0 або 1 були молодшими та мали вищий показник MMSE на початковому рівні порівняно з пацієнтами з оцінкою MTA 2, 3 або 4 (таблиця 5).
Траєкторія ваги за лівий бал MTA (результати одновимірного аналізу GLMM). GLMM, узагальнена лінійна змішана модель; MTA, медіальна атрофія скроневої частки.
Траєкторія ваги; лівий бал MTA 0 або 1 проти 2, 3 або 4 (результати одновимірного аналізу GLMM). GLMM, узагальнена лінійна змішана модель; MTA, медіальна атрофія скроневої частки.
Зв'язок правої МТА з траєкторією зміни ваги
Траєкторія ваги за правий бал MTA представлена в таблиці 6 та малюнку 3. Що стосується лівого MTA, ми порівняли траєкторію ваги між пацієнтами з оцінкою MTA 0 або 1, у порівнянні з пацієнтами з оцінкою MTA 2, 3 або 4 (таблиця 7, малюнок 4). Пацієнти з MTA 0 або 1 важили менше, ніж пацієнти з MTA 2, 3, 4 у будь-який момент під час спостереження. У цьому взаємодія з часом (P = 0,001), залежно від моменту спостереження, пацієнти з МТА 0 або 1 важили на 3,2 кг (через 6 місяців) та 6,4 кг (через 18 місяців) менше, ніж пацієнти з МТА 2, 3, 4 (табл. 7, рисунок 4). Загалом усі пацієнти набрали в середньому 0,7 кг ваги після 2,5 років (табл. 7). Що стосується лівого MTA, ми порівняли вихідні характеристики між пацієнтами з MTA 0 або 1, у порівнянні з пацієнтами з оцінкою MTA 2, 3 або 4 (таблиця 8). Пацієнти з МТА 0 або 1 були молодшими, мали вищий показник MMSE і рідше використовували неформальну допомогу на початковому етапі порівняно з пацієнтами з оцінкою МТА 2, 3 або 4 (Таблиця 8).
Траєкторія ваги за правим балом MTA (результати одновимірного аналізу GLMM). GLMM, узагальнена лінійна змішана модель; MTA, медіальна атрофія скроневої частки.
Траєкторія ваги; правильний показник MTA 0 або 1 проти 2, 3 або 4 (результати одновимірного аналізу GLMM). GLMM, узагальнена лінійна змішана модель; MTA, медіальна атрофія скроневої частки.
Обговорення
Метою цього дослідження було з'ясувати механізм втрати ваги у хворих на АД. На відміну від очікуваного, пацієнти з АД у нашій популяції не втрачали, а набирали вагу протягом 3,5 років спостереження. Недавні дослідження повідомили про подібні результати [43,44]. Сехер та ін. показали, що пацієнти, що проживають у громадах із середнім ступенем AD, не втрачали вагу протягом 4 років спостереження [43], Gu та ін. показали, що після клінічного початку АТ ІМТ збільшився [44]. Як можна пояснити збільшення маси тіла?
Кількість хворих на АД, що мешкають у громадах та мають втрату ваги, описана в літературі, коливається від 20% до 45% [5-10]. Найвищі показники повідомляються в дослідженнях до епохи до ІХЕ [5,6,9], а останні дослідження показали зниження ризику втрати ваги у хворих на АД, які отримували ХЕІ, порівняно з нелікованими [7,8,45,46 ]. У цих дослідженнях ChEI, як видається, захищали від втрати ваги. Тому збільшення ваги в нашій когорті можна пояснити використанням ІЕО.
Можливо, в даний час втрата ваги у хворих на АД спостерігається рідше через підвищену якість догляду за хворими на АД, що проживають вдома. За останнє десятиліття не тільки фармакологічне лікування змінило управління АД. Наркотики отримують на додаток до численних немедикаментозних втручань, включаючи дієтичні поради та харчування в домашніх умовах [31,47]. Гу та ін. показали, що ІМТ хворих на АД знижувався аж до клінічного початку АТ. Після клінічного початку не спостерігалося зниження ІМТ, яке навіть зростало, можливо, тому, що догляд був організований після діагностики АД [44]. Ми постулюємо, що втрата ваги у хворих на АД може розглядатися як показник якості надання допомоги хворим на АД, а не як маркер тяжкості БА. Це підтверджується нашими висновками, що тяжкість АД, виміряна тяжкістю МТА, не була пов’язана з траєкторією ваги.
Наш дивовижний висновок про те, що пацієнти з більш важким MTA важили більше, ніж пацієнти без MTA або з легким, повинен тлумачитися обережно, оскільки менше 10% пацієнтів з нашої когорти мали показник MTA 0 або 1. Представництво пацієнтів з або слабкий MTA в нашій когорті незрозумілий. Як і очікувалося, пацієнти з відсутністю або легким MTA мали вищий базовий показник MMSE і були менш залежними, ніж пацієнти з середнім, важким або дуже важким MTA [25]. Хоча, незважаючи на те, що ці пацієнти не мали або мали лише легкий МТА, їх скерували до клініки пам'яті. Немає даних про вагу пацієнтів з оцінкою МТА 0 або 1, які не були направлені в клініку пам’яті. Не можна виключати, що ці пацієнти мають вищу масу тіла, ніж пацієнти з оцінкою МТА 0 або 1, які були представлені в нашій клініці пам'яті.
Наскільки нам відомо, це найбільше дослідження, що вивчає взаємозв'язок між МТА та траєкторією зміни ваги у хворих на АД, і єдине дослідження, в якому вага тіла вимірювалася поздовжньо. Ще однією сильною стороною дослідження є використання GLMM. Статистичний аналіз поздовжніх даних ускладнений через взаємозалежність вимірювань і, особливо у пацієнтів старшого віку, які страждають на АД [54]. GLMM спеціально розроблений для аналізу поздовжньо-залежних даних. Усі дані сприяють поздовжньому аналізу, і навіть дані пацієнтів, які кинули навчання, можуть бути використані. Таким чином ми могли б включити велику кількість пацієнтів з тривалим періодом спостереження. Більше того, ступінь тяжкості МТА оцінювали незалежно від двох оцінювачів. Угода між оцінювачами була добросовісною і кращою, ніж угода про інтеросервер Шелтенса та ін., що було справедливо [37].
Висновки
Ми не виявили жодних доказів того, що атрофія медіальної скроневої частки пов'язана із втратою ваги у хворих на АД. Більше того, всупереч очікуваному, пацієнти з АД не втрачали, а набирали вагу під час спостереження.
- Збільшення ваги як предиктор втрати обсягу лобової та скроневої часток при біполярному розладі A
- Збільшення ваги як предиктор втрати обсягу лобової та скроневої часток при біполярному розладі A
- Чи схуднення змінить ваші стосунки Стиль життя - диспетчерська служба Колумба - Коламбус, штат Огайо
- Чи стане втрата ваги майбутнім лікуванням гепатоцелюлярної аденоми у пацієнтів із ожирінням Докмак -
- Чи закінчаться мої стосунки, якщо я схудну