Взаємодія субодиниці p70 RPA з матрицею ДНК спрямовує p32 на 3′-кінець зароджується ДНК
Інститут біоорганічної хімії Сибірського відділу Російської академії наук, 630090 Новосибірськ, Росія
Institut fuer Molekulare Biotechnologie Jena, D-07708 Єна, Німеччина
Institut fuer Molekulare Biotechnologie Jena, D-07708 Єна, Німеччина
Інститут біоорганічної хімії Сибірського відділу Російської академії наук, 630090 Новосибірськ, Росія
Кафедра молекулярної біології, Університет Вандербільта, Нашвілл, TN 37235, США
Інститут Жака Моно (CNRS, Університет Парижа 6, Університет Парижа 7), 75351 Париж Седекс 05, Франція
Інститут біоорганічної хімії Сибірського відділу Російської академії наук, 630090 Новосибірськ, Росія
Відповідний автор. Факс: (7) (38) 3233 3677 Шукати інші статті цього автора
Інститут біоорганічної хімії Сибірського відділу Російської академії наук, 630090 Новосибірськ, Росія
Institut fuer Molekulare Biotechnologie Jena, D-07708 Єна, Німеччина
Institut fuer Molekulare Biotechnologie Jena, D-07708 Єна, Німеччина
Інститут біоорганічної хімії Сибірського відділу Російської академії наук, 630090 Новосибірськ, Росія
Кафедра молекулярної біології, Університет Вандербільта, Нашвілл, TN 37235, США
Інститут Жака Моно (CNRS, Університет Парижа 6, Університет Парижа 7), 75351 Париж Седекс 05, Франція
Інститут біоорганічної хімії Сибірського відділу Російської академії наук, 630090 Новосибірськ, Росія
Відповідний автор. Факс: (7) (38) 3233 3677 Шукати інші статті цього автора
Анотація
Білок реплікації людини А - гетеротримерний білок, який бере участь у різних процесах метаболізму ДНК. Щоб зрозуміти внесок окремих субодиниць реплікаційного білка А у зв’язування ДНК, ми виразили їх окремо як розчинні злиті білки, що зв’язують білки мальтози. Використовуючи конструкцію ДНК, яка включала фотореактивну групу на 3′-кінці ланцюга праймерів, ми показуємо, що субодиниця p70 сама по собі ефективно зшита з праймером при фізіологічних концентраціях. На відміну від цього, зшивання субодиниці p32 вимагало вищих концентрацій білка на два порядки. Ні в якому разі субодиниця p14 не була позначена над фоном. p70, здається, є переважною субодиницею для зв'язування одноцепочечної ДНК, і ця взаємодія позиціонує субодиницю p32 на 3'-кінці праймера.
1. Вступ
Хоча здається очевидним, що p70 зв'язується переважно з областю ssDNA та контактами p32, якщо взагалі, кінцем праймера, невідомо, як кожна з окремих субодиниць сама по собі вносить свій вклад у зв'язування ДНК. Тут ми демонструємо, що головним чином субодиниця p70 може самостійно контактувати з ДНК і що контакти p32 доступні лише в комплексі завдяки позиціонуванню субодиницею p70.
2 Матеріали та методи
2.1 Матеріали
Рекомбінантну ДНК-полімеразу ссавців β (pol β) очищали, як описано [4]. РПА було виражено в кишкова паличка і очищений, як зазначено [5, 6]. Маркери молекулярної маси білкового кольору веселки були від Amersham, попередньо забарвлені маркери від New England Biolabs та сходи 10 кДа від Gibco BRL. Полінуклеотидна кіназа Т4 була придбана у New England Biolabs. [γ‐ 32 P] АТФ був від ICN. Синтетичні олігонуклеотиди були отримані від GENSET. Nensorb -20 колони були від Дю Понта. NAB ‐ 4 ‐ dUTP був синтезований згідно з Wlassoff та співавт. [7]. Окремі субодиниці RPA були виражені як злиті білки, що зв’язують мальтозу (MBP), і виділені, як це буде описано в іншому місці.
2.2 Аналізи зсуву смуги
Аналізи зсуву смуги, що містяться у 10 мкл суміші, 20 мМ HEPES-KOH рН 7,8, 5 мМ MgCl2, 1 мМ DTT, 0,1 мМ EDTA, 200 нг (що відповідає 0,083 пмоль) ДНК M13mp18 (Pharmacia) та зазначені кількості RPA або Сублідини RPA MBP злиті білки. Через 30 хв при 37 ° C зразок доповнювали 2 мкл завантажувального буфера (10 мМ HEPES-KOH рН 7,5, 1 мМ EDTA, 25% Ficoll 400, 0,1% бромофенолового синього) та електрофорезували в 1% агарозному гелі в TAE буфер (40 мМ трис-ацетат, 1 мМ ЕДТА). Гель фарбували 0,5 мкг/мл броміду етидію, а ДНК візуалізували на УФ-трансілюмінаторі.
Аналізи зсуву смуги також встановлювали за допомогою 5'-мічених олігонуклеотидів. У цих випадках аналіз містив 2 фмоль (10 000 cpm) зазначеного олігонуклеотиду замість M13mp18 ssDNA. Після інкубації зразки розділяли на 10% поліакриламідних гелях в ТВЕ (89 мМ трис-борат, 89 мМ борна кислота) при 160 В, поки барвник бромофенольного синього не мігрував наполовину в гель. Гель сушили і піддавали дії рентгенівських плівок.
2.3 Радіоактивне мічення олігонуклеотидних праймерів
Дефосфорильовані праймери були 5'-кінцевими фосфорильовані з Т4-полінуклеотид-кіназою, як описано [8]. Непрореаговав [γ‐ 32 P] АТФ видаляли, пропускаючи суміш через колонку Nensorb ‐ 20, використовуючи протокол, запропонований виробником.
2.4 Відпал ґрунтовки-шаблону
Шаблони праймерів відпалювали при молярному співвідношенні 1: 1, спочатку нагріваючи суміш при 90 ° C протягом 1 хв, після чого давали повільно охолонути до кімнатної температури. Послідовності використовуваного праймера та шаблону були такими: 5′ ‐ GGTTCGATATCGTAGTTCTAGTGTATAGCCCCTACC ‐ 3 ′, 3′ ‐ CACATATCGGGGATGG ‐ 5 ′
2.5 Подовження грунтовки у присутності фотореактивних аналогів dNTP
Умови подовження олігонуклеотидів фотореактивними аналогами dNTP були ідентичними умовам, що використовуються для фотосшивання. Синтез ДНК ініціювали додаванням полімерази і проводили протягом 30 хв при 25 ° С. Реакцію припиняли додаванням 10 мкл 90% формаміду, 50 мМ ЕДТА та 0,1% бромофенолового синього. Суміш нагрівали протягом 3 хв при 80 ° С, а продукти аналізували електрофорезом з подальшою авторадиографією.
2.6 Фотохімічне зшивання
RPA та його окремі субодиниці маркували фотореактивним праймером, синтезованим in situ за допомогою NAB ‐ 4 ‐ dUTP в реакції подовження праймера, каталізованого pol β. Реакційні суміші (10 мкл) містили такі стандартні компоненти: 50 мМ Tris-HCl, рН 7,8, 10 мМ MgCl2, 50 мМ KCl, 2 мкМ pol β, 0,8 мкМ шаблон ‐ 5 ′ - [32 P] праймер і 10 мкМ NAB ‐4 ‐ dUTP. Концентрації RPA або окремих субодиниць RPA були такими, як зазначено. Реакційні суміші інкубували при 25 ° С протягом 30 хв, щоб забезпечити подовження праймера. Потім суміші були помічені на парафільмі, який поміщали на лід та ультрафіолетово опромінювали протягом 20 хв монохроматором Baush and Lomb, оснащеним ртутною лампою HBO W надвисокого тиску, що виробляє УФ-світло 315 нм. Реакції зупиняли додаванням буфера Леммлі та нагріванням. Фотохімічно зшиті зразки білка-ДНК відокремлювали електрофорезом додецилсульфат натрію в поліакриламідному гелі (SDS-PAGE) [9] та аналізували за допомогою авторадіографії або за допомогою фосфомагера.
3 Результати
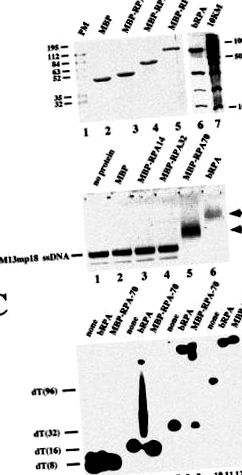
Для того, щоб розкрити ролі окремих субодиниць під час зв'язування ДНК, ми прагнули виразити їх окремо та використати в експериментах зшивання, вилучених з контексту гетеротримерного комплексу. Раніше повідомлялося, що спроби окремо виразити субодиниці RPA у розчинній формі не мали успіху [10]. Для збільшення розчинності субодиниць ми виражали їх як злиті білки MBP (рис. 1А). Ми змогли експресувати всі злиті білки у розчинній формі. Злиті частини цих білків можуть змінювати свої біологічні властивості. Дійсно, злиті субодиниці RPA не можуть асоціюватися в структурі гетеротримерів, але ми припускаємо, що вони зберігають активність зв'язування ДНК. Слід зазначити, що молекулярна маса кожного злитого білка MBP зростає до 48 кДа порівняно з природним.
В експериментах із зсувом смуги ми виявили активність зв'язування ДНК, яка пов'язана зі злитою субодиницею p70, але не з двома іншими субодиницями (рис. 1B). Здавалося, білок MBP-RPA70 менш добре взаємодіє з ssDNA меншої довжини, ніж гетеротримерний білок (рис. 1C). Як і очікувалось, жоден з білків не взаємодіяв з 8-мерним олігонуклеотидом (смуги 2 і 3). Повідомлялося, що такі комплекси у випадку гетеротримеру нестабільні і виявляються лише в аналізах зсуву смуги після зшивання [11]. Однак, тоді як RPA зміг зв’язатися з 16-мерним досить стабільним, злитий білок p70 не був (порівняйте смуги 5 та 6). Мазок нижче зміщеної смуги на смузі 5 повинен бути зумовлений молекулами ДНК, які втратили RPA під час електрофорезу через нестабільне зв'язування RPA. Крім того, зв’язування з 32-мер виявилося менш стабільним у випадку злитого білка p70 (порівняйте смуги 8 та 9). У той час як з гетеротримером виявляється одна зміщена смуга, мазок видно для злитого білка. Тільки з 96-ммерним зв'язуванням здавалося однаково ефективним для обох білків (порівняйте смуги 11 і 12).
Після характеристики властивостей зв'язування ДНК злитих білків MBP ми далі використовували їх у експериментах зшивання. У цьому дослідженні було використано заміщене базою похідне арилазидо dUTP, позначене як NAB ‐ 4-dUTP (рис. 2). Цей аналог є не тільки ефективним субстратом pol β [2], але, крім того, дозволяє проводити УФ-опромінення світлом на довжинах хвиль більше 310 нм, що значно перевищує максимум поглинання нуклеїнових кислот та білків. Ми розробили умови, які дозволили нам ввести одиничний фотореактивний dNMP у 3 ′ кінець праймера, міченого 5′‐ 32 P, використовуючи реакцію подовження праймера, каталізовану pol β [12]. 3 чітко показує, що початковий праймер (доріжка 1) витрачається в реакції, і лише кінцевий продукт отримується в присутності як ТТР (доріжка 2), так і NAB ‐ 4 ‐ dUTP (доріжка 3). Знижена рухливість видовженої грунтовки, яка спостерігається з аналогом (порівняйте смуги 2 та 3), є наслідком громіздкості фотореактивної групи NAB ‐ 4 ‐ dUTP [13] .
Раніше ми показали, що субодиниці p70 та p32 RPA можуть бути зшиті з фотореактивними олігонуклеотидами, синтезованими in situ ДНК-полімеразами з NAB-4-dUTP в якості субстрату. Коли застосовувались часткові дуплекси ДНК з розширеними хвостовими хвостами, більш інтенсивне маркування p32 відбувалося над p70, тоді як навпаки, якщо хвіст матриці був коротким [2, 12]. На відміну від них, за жодних умов не спостерігалося чудового зшивання субодиниці p14. Було висловлено гіпотезу, що субодиниця p70 взаємодіє з одноланцюговим хвостом матриці ДНК і розташовує субодиницю p32 поблизу або від 3'-кінця праймера в залежності від використовуваного одноланцюгового розширення. Субодиниця p14 розташована відносно далеко від 3'-кінця праймера, незалежно від того, який шаблон використовується [2] .
Для експериментів зшивання ми обрали фізіологічно відповідні концентрації (0,4 мкМ) окремих субодиниць RPA та гетеротримеру RPA [1] (рис. 4). Злитий білок субодиниці p70 був зшитий з фотореактивним 5'-32 P-міченим праймером (смуга 2). Збільшення концентрації білка дало більші кількості зшитого продукту (порівняйте доріжку 2 з доріжкою 7). На відміну від цього, додавання тієї ж кількості злиття p32, злиття p14 або MBP самостійно не призводило до їх зшивання (смуги 3, 4 та 5). Зверніть увагу, що кожен білок, ковалентно зв’язаний з праймером, працює з молекулярною масою, яка на 6–8 кДа більша, ніж у немодифікованого білка під час SDS-PAGE, і кожна злита субодиниця MBP-RPA має видиму молекулярну масу на 48 кДа більшу, ніж у рідний. Коли поліпептиди p70, p32 і p14 додавали разом, зшитим знов був лише злитий білок p70. Ефективність зшивання була такою ж мірою, як і ефективність, що спостерігається лише з цією субодиницею (порівняйте смугу 6 - 2). Ми хочемо наголосити на тому, що субодиниці не асоціюються між собою, якщо поєднувати їх окремо (дані не наведені). Справді, раніше було виявлено, що субодиниці повинні бути ко-експресованими для побудови гетеротримерного комплексу [10, 14] .
Якщо ми збільшили концентрацію білка для субодиниць p32 в діапазоні двох порядків, тобто до 50 мкМ, ми спостерігали специфічне зшивання цієї субодиниці настільки, що явно перевищувало зшивання MBP, що послужило негативним контролем (порівняйте смуги 8 та 10). На відміну від цього, не було виявлено маркування над фоном злитого білка p14 (порівняйте смуги 9 та 10). Якщо всі три субодиниці були присутніми у високих концентраціях, мало місце слабке мічення як злитими білками p70, так і p32. Знову ж, не було помічено зшивання з злитим білком p14 (смуга 11). Зверніть увагу, що обидві субодиниці зшиті менш добре, ніж це спостерігається з окремими субодиницями (порівняйте доріжки 7 та 8 до доріжки 11), або у випадку p70, якщо всі три злиті білки були в менших кількостях (порівняйте доріжки 5 та 11). Можливо, це пов’язано з конкуренцією між p70 та p32 за однакові або перекриваються сайти зв'язування.
Загальна інша картина зшивання була виявлена, якщо гетеротримерний комплекс використовується в дослідженнях зшивання (доріжка 1). Тут і субодиниці p70, і p32 були ефективно зшиті, однак, з чітким перевагою до останньої субодиниці. Ефективність зшивання явно перевищувала ефективність, що спостерігається в окремих субодиницях. Це також виявляється завдяки більш ефективній конкуренції pol β гетеротримером у порівнянні з спостереженнями за одиничними субодиницями (порівняйте смугу 1 із смугами 7 та 8).
4 Обговорення
Взаємодія RPA з ssDNA інтенсивно вивчалося за допомогою різних методів, включаючи рентгенівську кристалографію [1]. Було показано, що RPA може приймати різні конфігурації, залежно від доступної довжини ssDNA. Однак одне з важливих питань, що стосуються функції RPA, все ще залишається дослідити, тобто як він взаємодіє зі структурою ДНК, що діє на реплікаційній вилці. У цьому відношенні важливо розкрити спосіб зв'язування RPA з ДНК під час синтезу зароджується ДНК та визначити взаємозв'язок RPA та ДНК-полімераз навколо 3'-кінця зростаючого праймера.
Крок вперед у цьому напрямку було використання методів зшивання [2, 3]. Модель режиму зв'язування RPA з дуплексом ДНК із ланцюжком матриці, розширеним на 3'-кінці, була запропонована нами раніше на основі даних зшивання [2]. У цій моделі субодиниця p70 відповідає за зв'язування з одноланцюговою областю та за позиціонування субодиниці p32 відносно кінця праймера. Орієнтація субодиниці p32 до 3'-кінця праймера сильно залежить від конформації RPA, яка, в свою чергу, модулюється довжиною розширення шаблону [12]. У цьому звіті ми хотіли дослідити властивості зв'язування ДНК одиничних субодиниць, щоб перевірити гіпотезу, що саме субодиниця p70 встановлює найважливіші контакти з ДНК і що завдяки своєму способу зв'язування позиціонує інші субодиниці. Дійсно, отримані раніше експериментальні дані говорять на користь того, що субодиниця p70 головним чином відповідає за зв'язування з ssDNA [1] .
Використовуючи розчинні злиті білки MBP окремих субодиниць RPA, ми показуємо тут, що це переважно субодиниця p70, яка самостійно взаємодіє з ssDNA, хоча, схоже, спорідненість злитого білка p70 до коротших ssDNAs була меншою порівняно з тримерним білком (Рис. 1). Це може бути вплив сплавленої частини MBP ‐ RPA70. Крім того, ми демонструємо, що p70 поодинці або некомплектований з двома іншими субодиницями RPA може взаємодіяти з розширеним хвостом матриці ДНК-дуплекса при фізіологічно важливих концентраціях білка (0,1–1 мкМ) [15], як виявлено зшиванням p70 з фотореактивним dNMP фрагмент, введений у 3′-кінець ґрунтовки (рис. 4).
Зшивання субодиниці p32 з фотореактивним праймером було виявлено лише при дуже високих концентраціях білка (50 мкМ), що могло бути наслідком зв'язування p32 з ДНК його ДНК-зв'язуючим доменом [16, 17]. Ми не можемо остаточно виключити, що спостережуване зшивання p32 відображає лише неспецифічні взаємодії з ДНК. Але ми вважаємо, що це малоймовірніше, ніж конкретна прив'язка. По-перше, маркування було вище фонового рівня, а по-друге, p32 міг би конкурувати з p70, якщо застосовувати його у більш високих концентраціях. Раніші звіти показали, що ця активність зв'язування ДНК виявляється лише в тому випадку, якщо p32 знаходиться в комплексі з двома іншими субодиницями або якщо він усічений [18, 19]. Таким чином, здається ймовірним, що ДНК-зв'язуюча активність субодиниці p32 важко доступна в одній субодиниці і стає доступною в тримерному білку лише після того, як p70 пов'язаний з ДНК.
Ми не отримали жодної зшивки вище фонових рівнів для злитого білка p14, навіть коли ми використовували підвищені концентрації білка. Ми прийшли до висновку, що субодиниця p14 не бере участі в прямій взаємодії з ДНК, і припускаємо, що її роль полягає у складанні олігомеру RPA.
Наші дані дозволяють припустити, що найбільша субодиниця RPA головним чином відповідає за зв'язування ssDNA і що ця подія призводить до належної орієнтації інших поліпептидів RPA щодо з'єднання матриці-праймера ДНК. Якщо p32 контактує лише з праймером або, крім того, залишається визначити ssDNA.
Подяка
Ця робота була підтримана частково грантом INTAS N 96‐1778 та грантом Російського фонду фундаментальних досліджень (98‐04‐49718).
- 8 березня День богині схуднення краса Tmall Taobao шаблон домашньої сторінки електронної комерції Електронна комерція PSD
- 12-дюймовий шаблон лінійки для великого друку Завантажте PDF-шаблон Templateroller для друку
- Кето Топ китайські дієтичні таблетки для схуднення - журнал Salon
- Як схуднути, як цей хлопець, який втратив 66 кг при переривчастому голодуванні; вносячи 2 зміни у свій
- Втрата ваги дитини, чому перший рік після народження має найбільше значення; Вагітність у блозі Baby2Body;