Втручання з цитрусовими флавоноїдами зменшує ожиріння та покращує метаболічний синдром та атеросклероз у ожирілих мишей Ldlr -/- [S]
Емі К. Берк
Молекулярна медицина * Університет Західного Онтаріо, Лондон, Онтаріо, Канада, N6A 5B7
Науково-дослідний інститут Робартса, Факультети біохімії † Університет Західного Онтаріо, Лондон, Онтаріо, Канада, N6A 5B7
Брайан Г. Сазерленд
Молекулярна медицина * Університет Західного Онтаріо, Лондон, Онтаріо, Канада, N6A 5B7
Світанок Е. Телфорд
Молекулярна медицина * Університет Західного Онтаріо, Лондон, Онтаріо, Канада, N6A 5B7
Медицина, § Університет Західного Онтаріо, Лондон, Онтаріо, Канада, N6A 5B7
Маріса Р. Морроу
Молекулярна медицина * Університет Західного Онтаріо, Лондон, Онтаріо, Канада, N6A 5B7
Синтія Г. Соєз
Молекулярна медицина * Університет Західного Онтаріо, Лондон, Онтаріо, Канада, N6A 5B7
Медицина, § Університет Західного Онтаріо, Лондон, Онтаріо, Канада, N6A 5B7
Джейн Ю. Едвардс
Молекулярна медицина * Університет Західного Онтаріо, Лондон, Онтаріо, Канада, N6A 5B7
Медицина, § Університет Західного Онтаріо, Лондон, Онтаріо, Канада, N6A 5B7
Марія Дрангова
Лабораторії досліджень зображень, ** Університет Західного Онтаріо, Лондон, Онтаріо, Канада, N6A 5B7
Мюррей В. Хафф
Молекулярна медицина * Університет Західного Онтаріо, Лондон, Онтаріо, Канада, N6A 5B7
Науково-дослідний інститут Робартса, Факультети біохімії † Університет Західного Онтаріо, Лондон, Онтаріо, Канада, N6A 5B7
Медицина, § Університет Західного Онтаріо, Лондон, Онтаріо, Канада, N6A 5B7
Пов’язані дані
Анотація
У цьому дослідженні ми показали, що у мишей Ldlr -/- з попередньо встановленим ожирінням, спричиненим дієтою, порушенням регуляції метаболізму та атеросклерозом середньої стадії, те, що втручання шляхом додавання нарінгеніну або нобілетину до дієти HFHC не тільки запобігало ожирінню та погіршення симптомів метаболічного синдрому, але також помітно зменшило масу жирової тканини, нормалізувало гомеостаз глюкози та послабило як гіперліпідемію, так і стеатоз печінки. Корекція метаболічних показників супроводжувалася зменшенням циркулюючих моноцитів крові. У сукупності ці метаболічні поліпшення не дозволили визначити розмір атеросклеротичних уражень синуса аорти, але бляшки у мишей, які отримували флавоноїди, характеризувались зниженим вмістом макрофагів та холестерину, що відповідає регресії ураження (21, 22).
МАТЕРІАЛИ І МЕТОДИ
Тварини та дієти
Збір крові та тканин
Метаболічні клітини
Мікрокомп’ютерна томографія
Тести на толерантність до глюкози та інсуліну
Тест на толерантність до глюкози проводили після 6 год швидкого внутрішньочеревного введення з 15% глюкози в 0,9% NaCl (1 г/кг маси тіла) (15). Зразки крові для вимірювання глюкози (система контролю рівня глюкози в крові Bayer; Bayer Healthcare) відбирали до 120 хв після ін’єкції. Тест на толерантність до інсуліну проводили після 5-годинного швидкого внутрішньочеревного введення інсуліну (0,6 МО/кг маси тіла; Novolin GE Toronto, Novo Nordisk, Cooksville, ON, Канада) (15). Зразки крові для вимірювання глюкози отримували до 60 хв після ін'єкції. Толерантність до глюкози та інсуліну розраховували як процентну зміну рівня глюкози в крові від вихідного рівня.
Тканинні ліпіди
Ліпіди з печінки, квадрицепсів, шлунково-кишкових та солених кісток та аорти повної довжини, розсічені без жиру та сполучної тканини, витягувались методом Фольча із зразків, що зберігались при −80 ° C, як описано раніше (14, 25). Для оцінки відновлення додавали [холестерил-1,2–3 H (N)] холестерилолеат (PerkinElmer, Guelph, Canada; # NET746L). Комбінований стандарт 200 мкг/мл тріолеїну та 200 мкг/мл холестерину готували в ізопропанолі та розподіляли аликвотами для стандартних кривих (0–20 мкг). Зразки та стандарти висушували під N2 та додавали 1% розчин Triton X-100 у хлороформі та залишали при кімнатній температурі на 1 год для солюбілізації. Зразки та стандарти висушували під N2 з подальшим додаванням деіонізованої води та інкубацією при 37 ° С протягом 15 хв. Зразки аналізували з використанням ферментативних реагентів для тригліцеридів (TG) (Roche Diagnostics, Лаваль, Канада; TG/гліцерин, нульовий, # 11877771 216), загального холестерину (TC) (WAKO Diagnostics, Річмонд, штат Вірджинія; холестерину E (метод CHOD-DAOS), # 439-17501), та вільного холестерину (WAKO Diagnostics; метод вільного холестерину (COD-DAOS), No 435-35801). Ефір холестерилу (СЕ) визначали як різницю між ТК та вільним холестерином.
Вимірювання плазми
TG та TC плазми вимірювали на автоаналізаторі Cobas Mira S (Roche Diagnostics), використовуючи калібратори та засоби управління від Roche Diagnostics (15). Використовували ферментативні реагенти для ТГ (Roche Diagnostics; ТГ/гліцерин, порожній, # 11877771 216) та холестерину (Roche Diagnostics; Холестерин CHOD-PAP, No 11491458-216). Свіжу ЕДТА-плазму (50 мкл) відокремлювали за допомогою швидкодіючого білка LC (FPLC), використовуючи очищувач AKTA та колонку Superose 6 (14). Для збору фракцій 500 мкл використовували постійну швидкість потоку 0,4 мл/хв. Аліквоту кожної фракції використовували для ферментативного вимірювання холестерину та TG у обох зразках та стандартах на мікротитраційній пластинці з додаванням ферментативних реагентів [TG: Roche Diagnostics, TGs/глицерин, порожній, # 11877771 216 та TC: WAKO Diagnostics, холестерин E: ( Метод CHOD-DAOS), № 439-17501]. Глюкозу в крові вимірювали в цільній крові за допомогою системи контролю глюкози в крові Bayer (Bayer Healthcare, Етобіко, Канада) (15). Інсулін у плазмі (ALPCO Diagnostics, Salem, NH; миша ультрачутливий ІФА # 80-INSMSU-E01) визначали у зразках плазми EDTA, що зберігаються при -80 ° C, специфічним для мишей ІФА. Оцінка моделі гомеостазу на інсулінорезистентність (HOMA-IR) була розрахована за такою формулою, як описано раніше для мишей: HOMA-IR = 26 × рівень інсуліну натще (нг/мл) × рівень глюкози натще (мг/дл)/405 ( 26).
Бета-окислення печінки
Для окислення печінкової жирної кислоти свіжу печінку (250 мг) гомогенізували в 0,1 М фосфатному буфері (рН 7,2), що містить 0,25 М сахарози, 1 мМ ЕДТА, 1 мМ дитиотреїтолу та 10 мкл/мл інгібітора протеази (Sigma-Aldrich; # P8340). Гомогенати центрифугували при 1000 g при 4 ° C протягом 10 хв. Двадцять мікролітрів супернатанту інкубували протягом 30 хв при 37 ° С при постійному струшуванні в 0,1 М фосфатному буфері (рН 7,2), що містить 150 мМ KCl, 10 мМ HEPES, 5 мМ трина малонату, 10 мМ MgCl2, 1 мМ карнітину, 5 мМ АТФ, і 2 мкКі [9,10-3 Н (N)] пальмітинової кислоти (PerkinElmer; # NET043001MC) на 50 мкМ неміченої пальмітинової кислоти в комплексі з 0,15% безжирної BSA без жирних кислот. Реакції зупиняли за допомогою 200 мкл 0,6 N хлорної кислоти та прореагували жирних кислот, екстрагованих гексанами. 3 H2O у водній фазі вимірювали методом рідинного сцинтиляційного підрахунку (15, 27).
Експресія гена
Гістологія тканин та імуногістохімія
Морфометричний аналіз області ураження, некротичної зони ядра, CD68, α-актину гладкої мускулатури та колагену у місцях ураження мишей від кожної групи проводили на серійних зрізах. Відносна площа атеросклеротичної бляшки, позитивної для CD68, α-актину гладких м’язів або колагену, визначалася як площа позитивного фарбування, поділена на площу відповідної бляшки. Кількість визначали за допомогою програмного забезпечення ImageJ 1.50 (Національний інститут охорони здоров’я) для CD68, α-актину гладких м’язів та колагену, або програмного забезпечення AxioVision для площі ураження та розміру некротичного ядра. Для визначення відносної активації каспази-3 кількість клітинних ядер, імунозабарвлених для активованої каспази-3, виражали у відсотках від загальної площі ураження. Щоб забезпечити вимірювання стандартної області у кожної миші, аналізи уражень розпочали у джерела аортальних клапанів. Всі кількісні оцінки проводились незалежно від трьох людей.
Проточна цитометрія
Аналіз крові та кісткового мозку проводили в окремому експерименті на Ldlr -/- мишах (n = 8 на групу), використовуючи той самий протокол індукції та втручання, описаний вище.
Лейкоцити крові.
Кровотворні стовбурові клітини.
Проточну цитометрію проводили за допомогою LSRII (для аналізу) з використанням програмного забезпечення FACS DiVa. Всі дані проточної цитометрії аналізували за допомогою програмного забезпечення FlowJo (Tree Star Inc.)
Статистичний аналіз
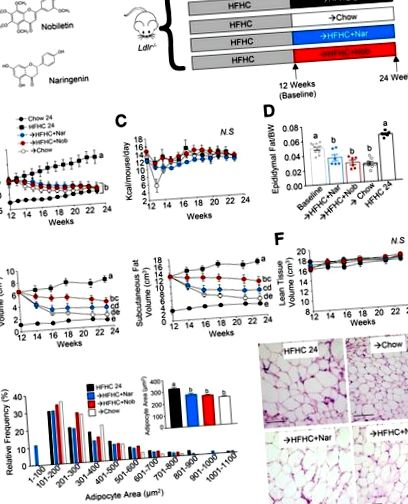
Дані представлені як середнє значення ± SEM. Статистичний аналіз проводили за допомогою Sigma Plot версії 14.0. Для перевірки відмінностей між групами використовували односторонній ANOVA з пост-спеціальним тестом Тукі, за винятком випадків маси тіла та ожиріння, виміряних у часі, коли застосовували двосторонні повторні вимірювання ANOVA із пост-специфічним тестом Тукі. Порогові значення значимості були Р Рис. 1А ). Згодом мишей розподілили між чотирма групами лікування протягом наступних 12 тижнів: одна група залишалася на дієті HFHC; друга група отримувала втручання за допомогою звичайної миші; третя група отримувала втручання з дієтою HFHC, доповненою 3% нарінгеніном; а четверта група отримувала втручання з дієтою HFHC, доповненою 0,3% нобілетину (рис. 1А).
Складів жиру придатків яєчка збільшували під час індукції дієтою HFHC (рис. 1D). Порівняно з базовим рівнем, втручання з нарінгеніном або нобілетином зменшило епідидимальний жир відповідно на 29% та 44%, подібно до втрати жиру у мишей, втручених у чау (рис. 1D). Навпаки, у мишей, які залишались лише на дієті HFHC, жирова маса епідидимуму зросла на 28%. Ті самі тенденції спостерігалися для пахової жирової тканини (додатковий рис. S2A). В окремому дослідженні ми підтвердили зменшення жирової тканини, спричинене втручанням, за допомогою флавоноїдів за допомогою мікро-КТ (рис. 1E, додатковий рис. S2B). Мікро-КТ показала, що обсяг вісцерального жиру зменшився на 38–53%, а об’єм підшкірного жиру зменшився на 23–43% за допомогою втручання флавоноїдів (рис. 1Е, додатковий рис. S2B). Важливо, що об’єм м’язової тканини істотно не змінювався протягом 12 тижнів втручання (рис. 1F), що вказує на те, що спричинена втручанням втрата ваги зумовлена зменшенням ожиріння.
Втручання флавоноїдів зменшує запалення жирової тканини
Втручання флавоноїдів збільшує витрати енергії
Втручання з цитрусовими флавоноїдами збільшує окислення печінкової жирної кислоти та зменшує стеатоз печінки. Ldlr -/- мишей годували HFHC дієтою протягом 12 тижнів. Згодом тих самих мишей обробляли флавоноїдами, доданими до дієти HFHC, протягом додаткових 12 тижнів. В: Печінкові ТГ (n = 7–8 на групу). B: CE печінки (n = 7–8 на групу). С: Вільний у печінці холестерин (n = 7–8 на групу). D: Ex vivo окислення печінкової жирної кислоти (n = 7–10 на групу). E: Експресія печінкових генів (n = 12 на групу). F: Вага печінки (n = 22 на групу). Дані представляють середнє значення ± SEM. Різні літери статистично відрізняються за допомогою ANOVA при пост-хок тесті Тукі (P -/- миші розвинули гіперхолестеринемію та гіпертригліцеридемію ( Рис. 5А–G). Втручання з додаванням нарінгеніну або нобілетину до дієти HFHC протягом 12 тижнів знижує рівень холестерину в плазмі крові (> 50%) і TG (> 50%) (рис. 5А, Б). Зниження рівня ліпідів у плазмі крові, опосередковане флавоноїдами, обмежувалось холестерином ЛПНЩ та ЛПНЩ без зміни рівня холестерину ЛПВЩ (рис. 5C – H). Більше зниження рівня ЛПНЩ- і ЛПНЩ-холестерину спостерігалося при втручанні чау (рис. 5F, G).
Втручання з цитрусовими флавоноїдами не зменшує розмір ураження, але сповільнює накопичення холестерину в аорті. Ldlr -/- мишей годували HFHC дієтою протягом 12 тижнів. Згодом тих самих мишей обробляли флавоноїдами, доданими до дієти HFHC, протягом додаткових 12 тижнів. Аорти розсікали, анус аорти розрізали та гістологічно аналізували. В: Репрезентативні ділянки синуса аорти, пофарбовані масляним червоним О та гематоксиліном та кількісне визначення кількості (n = 12–21 на групу). Шкала шкали становить 500 мкм. B: Загальний холестерин (TC), холестериловий ефір CE та вільний холестерин (FC) у цілих аортах (n = 6–8 на групу). C: Експресія генів у цілих аортах (n = 6–8 на групу). Дані представляють середнє значення ± SEM. Різні літери статистично відрізняються за допомогою ANOVA за допомогою спеціального тесту Тукі (P Рис. 6A, B). Після індукції через 12 тижнів бляшки складалися переважно з макрофагів (~ 66%) ( Рис. 7А, Н). Вміст макрофагів уражень зменшували за допомогою втручання нарінгеніном (-47%), нобілетином (-50%) та чау (-69%) (рис. 7А, Н), що відповідає концепції, що виснаження макрофагів характерно для регресуючого наліт (21). Хоча відсоток площі ураження, зайнятої макрофагами, також був меншим у мишей, які продовжували лікування HFHC (-23%), зменшення було більшим при втручанні флавоноїдів або чау (рис. 7А, Н). Порівняно з ураженнями на початковому рівні, продовження дієти HFHC збільшило некротичну область ядра (з 6% до 14%), збільшило відсоток апоптотичних клітин (з 0,2% до 1,0%), зменшило ураження гладком'язових клітин (SMC) (з 3,5 % до 1,8%) та збільшення колагену ураження (з 20% до 35%) (Рис. 7B – F, Додаткова Рис. S5). Втручання з нарінгеніном, нобілетином або чау зупинило збільшення розміру некротичного ядра, пригнітило збільшення апоптозу, послабило зменшення SMC і підтримало збільшення колагену ураження (рис. 7B-F, додатковий рис. S5). У сукупності ці зумовлені втручанням зміни складу ураження характерні для більш стабільних уражень (рис. 7G).
У цьому дослідженні ми протестували один протокол індукції та часу втручання, індукцію 12 тижнів за допомогою дієти HFHC з наступним втручанням 12 тижнів або цитрусовим флавоноїдом, доповненим до дієти HFHC. Ці терміни були обрані на основі регресійних моделей атеросклерозу в літературі та подібні до інших термінів дієтичного втручання флавоноїдів (21, 36, 37). Дванадцять тижнів індукції HFHC було достатнім часом, щоб викликати помірне ожиріння, значну гіперліпідемію, помірну резистентність до інсуліну, стеатоз печінки та проміжний атеросклероз. Дванадцятитижневого втручання було достатньо для повного поліпшення ожиріння та інсулінорезистентності, але помірна гіперліпідемія та стеатоз печінки зберігалися, що призвело до поліпшення морфології уражень, але відсутність регресії розміру нальоту. Це створює інтригуючу можливість того, що більша тривалість втручання флавоноїдів призведе до більшого вирішення цих розладів. Було б цікаво перевірити різну тривалість втручання та потенційно довші періоди індукції, щоб перевірити межі втручання флавоноїдів на вирішення ожиріння, спричиненого дієтою, метаболічного синдрому та атеросклерозу.
Ряд досліджень на людях із використанням очищених цитрусових флавоноїдів продемонстрував поліпшення рівня ліпідів у плазмі крові, метаболізму глюкози та ожиріння [оглянуто в (11)]. Однак результати були помірними, і спостерігались невідповідності між дослідженнями та значні відмінності між пацієнтами. Біодоступність флавоноїдів низька, особливо у людей; Метаболізм флавоноїдів різниться у суб’єктів, і відмінності в кишкової мікрофлорі можуть бути причиною значної міжособистісної мінливості в абсорбції та фармакокінетичних параметрах (11). Для оцінки дози, біодоступності, ефективності та безпеки терапевтичного розвитку необхідні більш контрольовані дослідження на людях.
Підводячи підсумок, ми показали, що втручання шляхом додавання будь-якого з цитрусових флавоноїдів, нарінгеніну або нобілетину до дієти з високим вмістом жиру у мишей, що страждають ожирінням, зменшує збільшення ваги та ожиріння, подібне до втручання з чау, без зменшення споживання їжі. Миші, оброблені нарінгеніном або нобілетином, споживають більше калорій, але витрачають більше енергії без підвищеної амбулаторної активності. Миші, які отримували флавоноїди, повністю відновлюють чутливість до інсуліну і зворотну гіперінсулінемію. Зменшується вміст ліпідів у плазмі та збільшується окислення жирних кислот у печінці, що призводить до зменшення печінкових ліпідів. У сукупності ці вдосконалення атерогенних факторів ризику не призвели до скорочення ураження, але покращили морфологію ураження, особливо помітно зменшивши вміст макрофагів в ураженні, що відповідає раннім стадіям регресії атеросклерозу. Ці дослідження підкреслюють потенційну терапевтичну корисність нарінгеніну або нобілетину, особливо в контексті існуючого ожиріння та метаболічної дисфункції.
- Метаболічний ефект ожиріння на синдром полікістозу яєчників у підлітків, Мета-аналіз журналу
- Гіперурикемія та метаболічний синдром у дітей із зайвою вагою та ожирінням Endocrinología y
- Дієта з високим вмістом цукру та масла (HSB) викликає ожиріння та метаболічний синдром із зниженням регуляторних показників
- Метаболічний синдром, ожиріння та камені в нирках - ScienceDirect
- L-карнітин частково покращує симптоми метаболічного синдрому, але не змінює збурену сперму