Втрата ваги, дисфагія та прийом добавок у пацієнтів з бічним аміотрофічним склерозом (АЛС): вплив на якість життя та терапевтичні можливості
Анотація
Передумови
Втрата ваги - часта характеристика хвороби рухових нейронів Аміотрофічний бічний склероз (БАС). У цьому дослідженні ми досліджували можливі причини втрати ваги при БАС, її вплив на настрій/якість життя (QOL) та користь висококалорійних харчових/інших дієтичних добавок та черезшкірної ендоскопічної гастростомії (ПЕГ).
Методи
Проведено опитування 121 пацієнта з БАС та відповіді на стандартизовані анкети (опис депресії Бека - II, опитувальник SF36 Health Survey, переглянута шкала функціональних оцінок ALS). Через два роки після первинного опитування ми провели подальше інтерв'ю.
Результати
У нашій когорті ALS 56,3% пацієнтів страждали від втрати ваги. Втрата ваги негативно вплинула на якість життя і була пов’язана з меншим виживанням. Пацієнти, які приймали висококалорійні харчові добавки, відповідно, мали ПЕГ, зазначили велику користь щодо стабілізації ваги та/або якості життя.
38,2% наших пацієнтів мали значну втрату ваги, не страждаючи від дисфагії. Щоб з’ясувати причини втрати ваги у цих пацієнтів, ми порівняли їх із пацієнтами без втрати ваги. Ці дві групи не відрізнялись за ступенем тяжкості захворювання, депресії, лобно-скроневої деменції або фасцикуляцій, однак пацієнти із втратою ваги частіше заявляли про посилення дихальної роботи.
Висновки
Втрата ваги є серйозною проблемою при БАС і не завжди може бути пов’язана з дисфагією. Симптоматичне лікування схуднення (висококалорійні харчові добавки та/або ПЕГ) слід пропонувати частіше.
Передумови
Аміотрофічний бічний склероз (БАС) є найпоширенішим нейродегенеративним розладом рухової системи у дорослих. Характеризується втратою верхніх і нижніх рухових нейронів у первинній руховій корі, стовбурі головного мозку та спинному мозку. Паралічі, що виникають, швидко прогресують і призводять до смерті через дихальної недостатності протягом 2–5 років [1]. Втрата ваги є частим явищем при БАС. Це відбувається не лише у поєднанні з дисфагією, але й через ще не повністю зрозумілі причини захворювання. Гіпотези для пояснення втрати ваги при БАС включають більшу втрату енергії через м’язові фасцикуляції, збільшення дихальних зусиль, гіперметаболізм та зменшення споживання їжі через депресію [2–4]. У будь-якому випадку загальновідомо, що втрата ваги та нижчий індекс маси тіла (ІМТ) є негативними прогностичними факторами виживання при БАС [5–8]. Високоенергетична дієта тривалого виживання у трансгенних мишей ALS [9]. Однак введення висококалорійних харчових добавок або черезшкірної ендоскопічної гастростомії (ПЕГ) у разі схуднення не розглядається на ранніх термінах і досить часто.
На відміну від цього, самолікування іншими дієтичними добавками, які також називають «нутрицеутиками» або «функціональною їжею», набуває все більшої популярності серед хворих на БАС, і згідно з літературою їх використовують до 80% з них [7, 10]. Дієтичні добавки повинні впливати на різні механізми, що призводять до загибелі рухових нейронів, або пом'якшувати симптоми БАС, часто на основі теоретичних переваг або анекдотичних повідомлень [7]. Часто вони призначаються самостійно, і пацієнти приймають кілька дієтичних добавок одночасно.
Метою цього дослідження було дослідити ступінь втрати ваги при БАС та проаналізувати вплив втрати ваги на настрій, якість життя (ЯО) та виживання хворих на БАС. Крім того, слід оцінити потенційні основні причини втрати ваги за межами дисфагії. Крім того, нас цікавила частота та користь введення ПЕГ, висококалорійної добавки (наприклад, калорійно щільні коктейлі/напої) та інших харчових добавок (наприклад, вітамінів, гомеопатичних препаратів) у пацієнтів з БАС.
Методи
У опитуванні взяли участь 121 пацієнт з БАС з амбулаторно-поліклінічної клініки медичної школи в Ганновері. Дослідження було схвалено етичним комітетом Ганноверської медичної школи, і всі суб'єкти дали інформовану згоду на участь. Усі пацієнти відповідали переглянутим критеріям Ель Ескоріал щодо ймовірного або певного БАС. Тільки у одного пацієнта були виражені тонкі клінічні ознаки лобно-скроневої деменції (FTD). FTD був недостатньо представлений у нашій популяції, оскільки ці пацієнти менш мотивовані та менш придатні брати участь у цьому типі дослідження. Пацієнти заповнили три стандартизовані опитувальники (опис депресії Бека - II (BDI), опитувальник SF-36 Health Survey (SF-36) та переглянуту шкалу функціональних оцінок ALS (ALS-FRS-R)) та були додатково опитані щодо втрати ваги, дисфагії, харчові звички та споживання ними харчових добавок. Було задокументовано, якщо пацієнти страждали на фасцикуляції або дихальний дистрес (так чи ні).
Через два роки після первинного опитування 61,2% пацієнтів або їх родичів були готові провести коротке подальше телефонне опитування, щоб з'ясувати, чи живий пацієнт, і чи все ще пацієнт вживав дієтичні добавки.
ALSFRS_R - це добре встановлена та широко використовувана оцінка функціонального стану пацієнтів з ALS [11]. Він базується на 12 пунктах, кожен з яких оцінений за шкалою 0–4. Рівень функціональної інвалідності коливається від 0 (максимальна інвалідність) до 48 (нормальна) балів. Три пункти ALSFRS_R оцінюють залучення бульбари (мова, слиновиділення, ковтання), які, таким чином, можуть бути оцінені від 0 (максимальне залучення бульбари) до 12 (відсутність залучення бульбари).
BDI - це 21 запитання з кількома варіантами самозвітів та загальновживаний інструмент для кількісного визначення рівня депресії. Кожен з 21 пункту оцінюється за шкалою від 0 (симптом відсутній) до 3 (симптом дуже інтенсивний), що приводить до загального діапазону 63. Використані граничні значення - 0–8: відсутність депресії, 9–13: мінімальна депресія, 14–19: легка депресія, 20–28: помірна депресія, 29–63 важка депресія [12].
Анкета SF36 - це багатоцільове коротке опитування щодо здоров’я, яке включає 36 питань. Це самоконтрольна система оцінки ЯО, яка включає вісім незалежних шкал: 1. фізичне функціонування (обмеження у фізичних навантаженнях), 2. фізична роль (обмеження у звичайних рольових діях через проблеми із фізичним здоров’ям), 3. тілесний біль, 4. Загальне сприйняття здоров’я, 5. Життєздатність (енергія та втома), 6. соціальне функціонування (обмеження в соціальній діяльності через фізичні чи емоційні проблеми), 7. Емоційна роль (обмеження у звичайній рольовій діяльності через емоційні проблеми), 8. Психічне здоров’я (психологічний дистрес та добробут) [13]. Анкета SF-36 широко застосовується та підходить для пацієнтів з БАС [14].
Тести та анкети, використані у цьому дослідженні, коротко зведені в таблиці 1.
Пацієнтів розподілили на такі групи: «втрата ваги» (визначена як> 3 кг з моменту початку захворювання), знову поділена на «втрату ваги без/з дисфагією» та «відсутність втрати ваги», а для другого аспекту дослідження: “З прийомом добавки” та “без прийому добавки” (добавка, визначена тут як харчові добавки (наприклад, вітаміни)). Групи не мали різниці щодо статі та місця початку захворювання. Тяжкість захворювання (ALSFRS_R), ступінь депресії (BDI) та якість життя (SF36) порівнювали між цими групами пацієнтів (склад груп, див. Таблицю 2), використовуючи t-тести для незалежних зразків. Для виявлення кореляційних зв'язків між втратою ваги або споживанням добавки та якістю життя незалежно від тяжкості захворювання (ALSFRS-R) ми провели багаторазовий регресійний аналіз (залежна змінна: субмасштаб SF-36, змінні предиктора: ALSFRS-R та втрата ваги або споживання добавки). Статистичний аналіз проводили з використанням програмного забезпечення SPSS V. 19 (SPSS, Чикаго, Іллінойс), значення р у таблиці 2 Груповий склад та характеристики пацієнтів з прийомом БД/втратою ваги та без нього
Результати
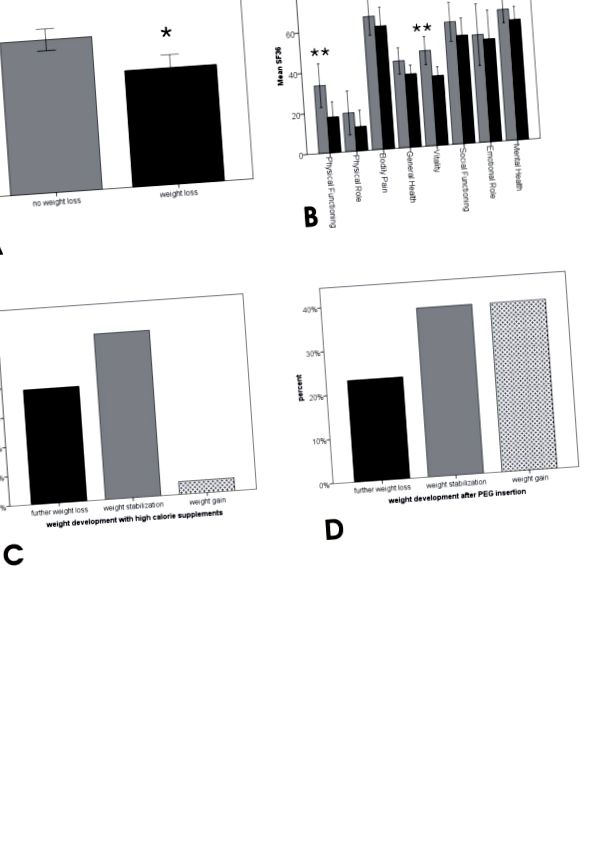
56,2% (n = 68) пацієнтів у нашій когорті повідомили про втрату ваги. Втрата ваги була пов’язана із значно гіршим показником ALSFRS_R, а також з вищою депресією (BDI, не значущою) та значно нижчими показниками ЯО (SF36) щодо підміру “фізичне функціонування” та “життєва сила” (Малюнки 1A та B). Багаторазовий регресійний аналіз визначив оцінку ALSFRS_R як незрозумілий фактор, показуючи, що відмінності в BDI та "фізичному функціонуванні", ймовірно, були спричинені розбіжністю в ALSFRS_R. Але різниця в «шкалі життєвих сил» під шкалою SF36 між пацієнтами із втратою ваги та без неї залишається дуже значною (табл. 3А), що означає, що пацієнти із втратою ваги частіше почуваються виснаженими, втомленими та бездуховними незалежно від стадії захворювання. Багаторазовий регресійний аналіз показав, що цей вплив втрати ваги на життєвий тонус не залежав від дихальних розладів, які також мали значний вплив на життєвий тонус (Таблиця 3B).
33,8% (n = 23) пацієнтів із втратою ваги споживали висококалорійні добавки, а 60,8% (n = 14) з них повідомили про подальшу стабілізацію ваги або навіть збільшення ваги (Рисунок 1C). 25,5% (n = 13) пацієнтів з дисфагією перенесли ПЕГ; 76,9% (n = 10) з цих пацієнтів заявили про стабілізацію ваги або збільшення маси тіла (малюнок 1D), а 84,6% (n = 11) заявили про поліпшення якості життя після введення ПЕГ. Примітно, що жоден пацієнт не вказував на погіршення ЯЖ після введення ПЕГ (хоча це часто підозрюють пацієнти та родичі до процедури).
38,2% (n = 26) пацієнтів із втратою ваги не страждали дисфагією (згідно із заявою, про яку повідомляється самостійно, та ALSFRS_R). Ця група пацієнтів не відрізнялася від пацієнтів без втрати ваги щодо ALSFRS_R (загальна та бульбарна) та депресії (BDI), а також не повідомляла про зміни у своїх харчових звичках. Пацієнти з дисфагією, з іншого боку, продемонстрували значно нижчі показники ALSFRS_R, головним чином, завдяки бульбарному підрахунку (рис. 2А). Поширеність фасцикуляцій у пацієнтів із втратою ваги без дисфагії дорівнювала пацієнтам без втрати ваги. Однак вони частіше заявляли про посилення дихальних зусиль порівняно з пацієнтами без втрати ваги (Рисунок 2B).
Порівняння пацієнтів із втратою ваги з/без дисфагії та пацієнтів без втрати ваги. Пацієнти із втратою ваги та дисфагією суттєво відрізнялись від пацієнтів без втрати ваги за показниками BDI та ALSFRS_R (загальний та бульбарний). Натомість у пацієнтів із втратою ваги без дисфагії не було вищих показників BDI/нижчих показників ALSFRS_R, ніж у пацієнтів без втрати ваги (A). Тому втрата ваги у пацієнтів без дисфагії, схоже, не пов'язана безпосередньо з більш запущеною стадією захворювання або підвищеною депресією. Пацієнти з втратою ваги та дисфагією значно частіше заявляють про посилену дихальну роботу, ніж пацієнти без втрати ваги. Пацієнти з втратою ваги без дисфагії виявляли тенденцію до посилення дихальної роботи порівняно з пацієнтами без втрати ваги (р = 0,12). Не було відмінностей щодо частоти фасцикуляцій між групами (B). Повторне спостереження за телефоном через два роки після первинного опитування підкреслило прогностичне значення втрати ваги: Аналіз виживання Каплана-Мейєра для пацієнтів з БАС із втратою ваги та без виявив значно коротше виживання хворих на БАС із втратою ваги (log rank p = 0,001) (C.).
Телефонне опитування через два роки показало, що втрата ваги є сильним негативним прогностичним фактором: криві виживання Каплана-Мейєра у пацієнтів із втратою ваги та без неї показали значно коротше виживання пацієнтів із втратою ваги (log rank p = 0,001) (Рисунок 2C).
Обговорення
Частка пацієнтів, які приймають інші, не калорійні дієтичні добавки, такі як вітаміни, була нижчою в нашій когорті (54,5%), ніж у літературі, якщо відсоток споживання добавок серед пацієнтів з БАС оцінюється приблизно у 80% [7, 10 ].
Спостережувані відмінності у тяжкості захворювання, депресії та якості життя, швидше за все, не є прямим впливом цих різноманітних харчових добавок. Хоча потрібно брати до уваги певний плацебо-ефект, найбільш вірогідним поясненням є те, що пацієнти, які займаються самолікуванням з дієтичними добавками, імовірно, представляють більш надійну та оптимістичну підгрупу. Це припущення підтверджується тим фактом, що вони мали вищі показники “соціального функціонування” SF36, тобто відчували себе меншими впливами у взаємодії з членами сім'ї, друзями та сусідами. Більш активне соціальне життя також могло забезпечити посилення стимулів до випробування альтернативних підходів до лікування. Припинення прийому дієтичних добавок з часом (як виявило наше дворічне подальше інтерв'ю), мабуть, є результатом втрати надії, як правило, пов'язаного з подальшим прогресуванням захворювання.
Незважаючи на відсутність доказів будь-якої відповідної переваги дієтичних добавок, поки немає чітких протипоказань і поки не виявлені ефективні нейропротективні препарати, крім рилузолу, самолікування БАД може представляти надію та впевненість для деяких пацієнтів і тим самим позитивно впливає на перебіг захворювання та якість життя.
Висновок
Значимість цього дослідження обмежена, оскільки воно є ретроспективним та базується на суб’єктивних даних самих пацієнтів. Проте він надає цінну інформацію, яка може бути використана як відправна точка для подальших перспективних розслідувань.
Незважаючи на те, що недоїдання є важливим та незалежним прогностичним фактором виживання, воно часто неадекватно вирішується в клінічній практиці. Згідно з нашими результатами ефект висококалорійних харчових добавок та ПЕГ часто вищий, ніж очікувалося. Тому пацієнтам, вихователям та лікарям слід заохочувати розглянути ці заходи. Однак їх користь все ще вимагає подальшого підтвердження проспективними дослідженнями.
Для оцінки причин втрати ваги поруч із дисфагією буде проведений подальший проспективний аналіз пацієнтів без втрати ваги порівняно з пацієнтами, які страждають від втрати ваги, не пов’язаного з дисфагією, порівняння клінічних параметрів, таких як фасцикуляція, спастичність та когнітивні або поведінкові відхилення, а також РЗЕ та FVC. безумовно, дають більш ґрунтовне розуміння цього явища. У будь-якому випадку існування цих різних фенотипів ще раз підкреслює неоднорідність клінічних проявів БАС.
Що стосується дієтичних добавок, необхідні подальші дослідження, щоб оцінити безпеку та ефективність численних дієтичних добавок та дати відповідні рекомендації.
- Чи стане втрата ваги майбутнім лікуванням гепатоцелюлярної аденоми у пацієнтів із ожирінням PubMed
- ТВЦ Продукти для схуднення Доповнення Кето дієта Втрата ваги Менопауза Велотренажер Втрата ваги
- Огляд пластиру для схуднення та дієти; Трансдермальні добавки з клінічно доведеним активом
- УЗД коліна у хворих на ожиріння з артрозом колінного суглоба; Втрата ваги - Повний текст
- Напої для схуднення можуть значно зменшити споживання калорій