Вплив перорального введення синтетичного фрагмента гормону росту людини на ліпідний обмін
Кафедра біохімії та молекулярної біології Університету Монаш, Клейтон, Вікторія 3148; і
Кафедра біохімії та молекулярної біології Університету Монаш, Клейтон, Вікторія 3148; і
Медичний факультет, Королівська лікарня Мельбурна, Парквілл, Вікторія 3050, Австралія
Кафедра біохімії та молекулярної біології Університету Монаш, Клейтон, Вікторія 3148; і
Анотація
ожиріння є основною проблемою охорони здоров'я в більшості розвинених країн. Наприклад, в Австралії майже кожен п'ятий дорослий страждає ожирінням, що робить їх дуже сприйнятливими до діабету, ішемічної хвороби серця та високого кров'яного тиску, а також знижує психологічне здоров'я (1). Ожиріння, як правило, лікується дієтою та фізичними вправами, але спроби підтримати значну втрату ваги дієтами та фізичними вправами майже завжди зустрічаються з невдачею (6). Існує велика потреба у розробці кращої фармакотерапії ожиріння (18). Тут ми розпочинаємо оцінку потенційного використання AOD-9401, фрагмента гормону росту людини (hGH), для лікування ожиріння.
Це дослідження має на меті розширити ці висновки, дослідивши, чи може пероральне введення цього фрагмента гормону росту збільшити масу тіла та вплинути на ліпідний обмін. Це дослідження складалося з трьох частин. Спочатку ми досліджували ефективність перорального введення AOD-9401 щодо зменшення маси тіла, енергетичного балансу, ліполізу та ліпогенезу при ожирінні C57BL/6J (об/об) миші. Потім ми дослідили антиліпогенну, ліполітичну та жироокислювальну активність AOD-9401 у периферичних жирових тканинах гризунів із ожирінням in vitro. Нарешті, для оцінки доцільності лікування людини досліджували дію AOD-9401 in vitro на ліполіз та ліпогенез у жировій тканині із жирової жирової тканини людини, що страждає ожирінням.
Хімічний синтез функціонального домену hGH (AOD-9401).
AOD-9401, синтетичний фрагмент гормону росту, що складається з амінокислотних залишків 177–191, був приготований за твердофазною процедурою синтезу та очищений методом зворотної фази ВЕРХ у наших лабораторіях університету Монаша (9). Структуру пептидного аналога перевіряли за допомогою мас-спектрометрії та аналізу амінокислот.
Тести in vitro на неферментну та ферментативну деградацію AOD-9401.
AOD-9401 тестували на стійкість in vitro проти потенційної деградації шлунково-кишкового тракту, згідно зі стандартними протоколами перетравлення ферментів для білка (26). Процедура De Laureto та співавт. (4) використовували для оцінки швидкості деградації шляхом вимірювання залишкового пептиду за допомогою методів RP-HPLC, а також аналізу амінокислот.
Експериментальні тварини та пероральне лікування.
Вісімнадцять чоловіків C57BL/6J (об/об) у цьому дослідженні використовували мишей віком 10–12 тижнів та вагою 46,4 ± 1,1 (SE) г. Тварин поділяли на сольові розчини (n = 8) або групи лікування AOD-9401 (n = 10) і відповідали вазі тіла та статі. Тварин поселяли у звичайному 12: 12-годинному циклі світло-темряви при постійній кімнатній температурі 23 ° C у Департаментському будинку для тварин при Університеті Монаша. Тварин годували за бажанням стандартною лабораторною неочищеною дієтою (Кларк Кінг, Мельбурн, Австралія), і їм завжди дозволявся вільний доступ до води. Мишам давали щоденні пероральні дози або AOD-9401 (500 мкг/кг маси тіла), розчиненого в 0,3 мл фізіологічного розчину, або лише фізіологічного розчину з еквівалентним об'ємом протягом 30 днів. Точному дозуванню сприяла голка з нержавіючої сталі (діаметр 7,5 × 0,1 см). Дозу вводили повільно, щоб уникнути рефлюксу.
Вимірювання збільшення маси тіла, споживання їжі, витрат енергії та фізичної активності.
Вагу тіла мишей вимірювали перед лікуванням, а потім кожні 2 дні до кінця дослідження. Споживання їжі вимірювали кожні 2 дні після початку лікування та усереднювали для щоденного вимірювання. Грами спожитої неочищеної дієти множили на 2,85, щоб отримати споживання калорій в кілокалоріях на день, а потім помножили на 4,184, щоб перетворити на кілоджоулі на день. Витрати енергії вимірювали в кінці періоду обробки непрямим калориметром (Columbus Instruments, Columbus, Ohio).
Гравіметрично визначені стандартні газові суміші 20,48% O2 та 0,5% CO2 використовували для калібрування машини перед використанням (BOC Gases Australia, Preston, Victoria, Australia). Після пробірки мишей голодували протягом 2 год, а потім поміщали в коробку Perspex розміром 20 × 13 × 11 см, через яку всмоктували свіже повітря зі швидкістю 0,65 л/хв. Середні норми виробленого СО2 та спожитого O2 розраховували кожні 3 хв протягом 30-хвилинного періоду. Норми витрат енергії (ккал/хв) були розраховані на основі даних за останні 15 хв, припускаючи екскрецію азоту з сечею 0,84 мг · хв −1 · кг маси тіла −1 (27). Протягом останніх 3 днів періоду лікування у цих мишей також вимірювали добровільний рівень фізичної активності за допомогою бігових коліс діаметром 15 см. Постійний цілодобовий моніторинг використання ходових коліс проводився за допомогою комп'ютеризованого лічильника (7).
Гострий вплив AOD-9401 на окислення жиру in vivo.
Гострий вплив AOD-9401 на швидкість окислення жиру та глюкози оцінювали в кінці 30-денного періоду перорального лікування страждають ожирінням об/об миші після прийому їжі, фізичної активності та споживання енергії в стані спокою були завершені. Вранці останнього дня дослідження групу з трьох мишей, оброблених сольовим розчином, та чотирьох мишей, оброблених AOD-9401, позбавляли їжі протягом 1 години; потім вимірювали базальне окиснення жиру, окислення глюкози та витрати енергії протягом 10 хв за допомогою процедури непрямої калориметрії, описаної раніше. Потім мишам робили внутрішньочеревну ін’єкцію фізіологічного розчину (у групі, обробленій фізіологічним розчином) або AOD-9401 (250 мкг/кг у групі, яка отримувала АОД), і вимірювали швидкість окислення жиру, окислення глюкози та енергетичні витрати ще 18 хв.
Виділення жирових тканин.
Групи мишей вбивали летальною дозою пентобарбітону (0,2 мл) через 24 год після останньої обробки пероральним AOD-9401 на день 30. Вимірювання енергетичних витрат після внутрішньочеревного дозування AOD-9401 на цих мишах не проводили. Епідидимальні жирові прокладки від мишей-самців були виділені, як і в наших попередніх дослідженнях (14). Тканини промивали сольовим розчином кімнатної температури перед зважуванням на шматочки ∼ 200 мг для аналізів ex vivo. Для аналізів in vitro, чоловіки C57BL/6J (об/об) використовували мишей. Самців щурів Цукерів (200–300 г, вік 12 тижнів) використовували для оцінки швидкості окислення жиру в жировій тканині in vitro у відповідь на AOD-9401. Підшкірну жирову тканину черевної порожнини людини було отримано за згодою пацієнта із надмірною вагою (вік: 42 роки; індекс маси тіла: 28,4), який не мав інших відомих медичних ускладнень і який переніс операцію зі зменшення жиру з косметичних причин.
Аналіз ліпогенної активності в жировій тканині.
Швидкість включення екзогенної [14 С] глюкози в загальний ліпід у жировій тканині використовували як показник ліпогенної активності. Тканини поміщали в 2 мл бікарбонатного буфера Кребса-Рінгера (KRB) (pH 7,4), що містить 2% знежиреного BSA і 0,1 мг/мл глюкози, а потім обгазували 95% O2-5% CO2 на струшуючій водяній бані з температурою контролюється при 37 ° C. Після 30 хв попередньої інкубації тканини переносили в ще 2 мл свіжого середовища, що містить [14 C] глюкози (кінцева питома активність 0,05 мкКі/мкмоль), протягом наступних 90 хв (ті ж умови, що і вище). Потім тканини видаляли і ретельно промивали сольовим розчином, а ліпіди екстрагували сумішшю хлороформ-метанол (2: 1). Радіоактивність 14 С підраховували на рідинному сцинтиляційному лічильнику Wallac 1410 (Турку, Фінляндія). Швидкості загального синтезу ліпідів виражали у вигляді пікомолей глюкози, включеної в жир на міліграм тканини на годину.
Аналіз ліполітичної активності в жировій тканині.
Швидкість ліполітичної активності вимірювали вивільненням гліцерину в інкубаційне середовище. Шматочки тканини поміщали в 2 мл KRB-буфера з 2% BSA та 0,1 мг/мл глюкози та інкубували протягом 60 хв (ті ж умови, що і вище). Потім тканини видаляли і викидали, а кількість гліцерину, присутнього в інкубаційному середовищі, ферментативно аналізували з використанням реакцій гліцеролфосфатоксидази (Sigma Diagnostics, каталог № GPO-337; St Louis, MO). Гліцерин визначали спектрофотометром і перетворювали на мікромолі гліцерину, що виділяється на грам тканини за годину.
Вимірювання плазми.
Зразки крові відбирали з хвостової вени знеболених тварин у капілярних трубках після хронічного лікування. Плазму зберігали при -20 ° C до використання. Глюкозу вимірювали за допомогою аналізатора глюкози 2300 STAT. Вільні жирні кислоти (ВЖК) визначали методом, розробленим з Noma (15). Тригліцериди (ТГ) вимірювали за допомогою набору відповідно до рекомендацій виробника (Sigma).
Аналіз окислення FFA in vitro.
Статистичний аналіз.
Студенти т-тест використовувався для аналізу результатів. Усі дані виражаються як середні значення ± SE. P значення 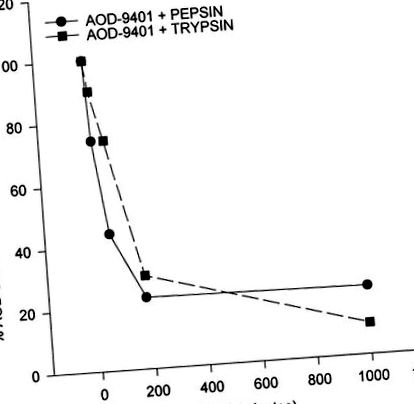
Рис. 1.Результати перетравлення in vitro AOD-9401 у присутності трипсину та пепсину. Умови травлення описані Стоуном та Вільямсом (26).
Вплив In vivo AOD-9401 на енергетичний баланс у мишей із ожирінням (ob/ob).
На малюнку 2 показано зміну маси тіла після того, як мишей перорально обробляли AOD-9401 або фізіологічним розчином протягом 30 днів. Швидкість збільшення ваги була на 58% нижчою у мишей, які отримували AOD-9401 віддень 16 лікування далі (від 0,33 до 0,14 г/добу,P
Рис.2.Вплив AOD-9401 на сукупний приріст маси тіла (означає ± SE) ожиріння (об/об) миші протягом 30-денного періоду лікування. Тваринам щодня давали 0,3 мл фізіологічного розчину (●) (n = 8) або AOD-9401 (500 мкг · кг маси тіла −1 · день −1, ○) (n = 10) за допомогою голкової голки (* P
Зменшення приросту маси тіла у мишей, що страждали ожирінням AOD-9401, не відбулося через зменшення споживання їжі. На малюнку 3 видно, що середньодобове споживання калорій від день 2 до день 30 був однаковим у групах, які отримували фізіологічний розчин та AOD-9401. Також зменшення приросту маси тіла не корелювало зі збільшенням витрат енергії в стані спокою, виміряних через 2 години після обробки соновими дозаторами (0,00525 ± 0,00028 проти 0,00518 ± 0,00042 ккал/хв у мишей, оброблених AOD-9401 та сольовим розчином, відповідно). Витрати енергії в стані спокою були однаковими у мишей, оброблених AOD-9401 та сольовим розчином, навіть коли нормалізували показники маси тіла (0,103 ± 0,004 проти 0,101 ± 0,009 ккал · хв −1 · кг −1 у мишей, оброблених AOD-9401 та сольовим розчином відповідно). AOD-9401 не збільшив активність ходових коліс у людей із ожирінням об/об миші (дані не відображаються). Штам миші дуже неактивний у порівнянні з іншими штамами мишей і залишається таким навіть після обробки AOD-9401.
Рис.3.Середнє щоденне споживання їжі (кДж/день) ожиріння (об/об) миші протягом 30-денного періоду лікування після введення фізіологічного розчину (●) або AOD-9401 (○). Результати виражаються як середнє значення ± SE. Протягом усього періоду лікування статистичної значимості не спостерігалося.
Ефект ex vivo AOD-9401 на ліпогенез та ліполіз.
Дані на рис.4A показують, що AOD-9401 збільшував швидкість ліполітики з 0,63 ± 0,20 мкмоль · г тканини –1 · год −1 у контрольних тварин до 1,02 ± 0,25 мкмоль · г тканини –1 · год -1 (P −1 · h −1, P 14 С] глюкози в ліпіди. Ці зміни обміну ліпідів узгоджуються із спостережуваним зменшенням сукупного приросту маси тіла оброблених тварин.
Рис.4.Ліпогенна активність ex vivo (A) та ліполітична активність (B) в жировій тканині ожиріння (об/об) миші після 30-денного перорального введення AOD-9401. Дані виражаються як середні значення ± SE контролю (n = 10) та оброблений (n = 10) тканини. * P
На додаток до цих спостережень також було відзначено вплив на метаболіти плазми (табл. 1). Результати показують, що після хронічного введення AOD-9401 можна зафіксувати значне збільшення плазмових FFA. Рівні глюкози та TG трохи нижчі у оброблених тварин, але суттєво не відрізняються від контролю.
Таблиця 1. Вплив лікування AOD-9401 на глюкозу та ліпіди у плазмі крові
Значення глюкози та ліпідів у плазмі тут показано як середнє значення ± SE контролю (n = 5) та обробленого AOD-9401 (n = 7) об/об миші після хронічного перорального прийому (* P
Рис.5.Вимірювання базальних витрат енергії (A), окислення жиру (B), і окислення глюкози (C.) до та після ip ін’єкції AOD-9401 (250 мкг/кг,n = 4) або фізіологічний розчин (n = 3) з ожирінням (об/об) миші. Результати виражаються як середнє значення ± SE (* P
Вплив AOD-9401 in vitro на ліпогенез, ліполіз та окислення жиру.
Вплив AOD-9401 на ліпогенез та ліполіз також виявляється in vitro. На рисунку 6 показано чіткий залежний від дози ефект AOD-9401 на ліпогенез (рис. 6A) та ліполізу (рис. 6B). Периферична епідидимальна жирова тканина чоловічої статі C57BL/6J (об/об) мишей інкубували у присутності AOD-9401 протягом 1 години.
Рис.6.Ліпогенез in vitro (A) та ліполіз (B) в епідидимальної жирової тканини від ожиріння (об/об) миші у присутності сольового розчину (контроль) або різних концентрацій AOD-9401. Кожен стовпчик означає середнє значення ± SE 6 визначень (* P
Також було виміряно вплив AOD-9401 на окислення жиру, цього разу на самців щурів із цукером із ожирінням. AOD-9401 впливав на дозу залежно для збільшення швидкості окислення жиру (рис. 7), зі значним збільшенням окислення жиру на 25%, що спостерігається при концентраціях 1,0 мкМ AOD-9401 (P
Рис.7.Швидкість окислення жиру in vitro у жировій тканині епідидимальної тканини самців щурів Цукера, інкубованій у присутності різних концентрацій AOD-9401. Стовпчики виражають значення ± SE 6 визначень. (* P
Вплив AOD-9401 in vitro на жирову тканину людини.
AOD-9401 та синтетичні аналоги можуть бути розроблені для терапевтичного застосування, включаючи лікування ожиріння людини. Таким чином, ми також оцінили вплив AOD-9401 на підшкірну жирову тканину людини. Таблиця 2 вказує, що AOD-9401 посилює ліполіз в жировій тканині людини, що призводить до триразового збільшення вивільнення гліцерину та зниження ліпогенної активності на 50%, подібно до наших результатів in vitro у об/об тканини миші.
Таблиця 2. Ліполіз in vitro та антиліпогенез у підшкірній жировій клітковині людини за AOD-9401
- Терапія гормоном росту Елькхарта, ін’єкції гормону росту - лікарі проти старіння гормону людського росту в Індіані; Клініки ЗГТ
- Ефективний безпечний людський соматропін Jintropin Гормон росту людини для схуднення
- Оральне застосування Cytomel, побічні ефекти, взаємодія, зображення, попередження; Дозування - WebMD
- Haldol пероральне застосування, побічні ефекти, взаємодія, зображення, попередження; Дозування - WebMD
- Темрява має значення вплив світла вночі на обмін речовин