Вплив ожиріння та фізичних вправ на передачу сигналу лептину яєчка та біосинтез тестостерону у мишей-самців
Кафедра кінезіології, Університет спорту Шеньяна, Шеньян, Ляонін, Китай;
Кафедра кінезіології, Університет спорту Шеньяна, Шеньян, Ляонін, Китай;
Кафедра фізичного виховання, Університет штату Міннан, Чжанчжоу, Фуцзянь, Китай; і
PE коледж Пекінського нормального університету, Пекін, Китай
Кафедра кінезіології, спортивний університет Шеньяна, Шеньян, Ляонін, Китай;
Кафедра кінезіології, спортивний університет Шеньяна, Шеньян, Ляонін, Китай;
Кафедра кінезіології, спортивний університет Шеньяна, Шеньян, Ляонін, Китай;
Кафедра кінезіології, спортивний університет Шеньяна, Шеньян, Ляонін, Китай;
Адреса для запитів на передрук та іншої кореспонденції: Б. Чанг, департамент кінезіології, Спортивний університет Шеньяну, № 36, Цзіньцянсон Е. Р., Суцзятунь, Шеньян, Ляонін, Китай (електронна пошта: [електронна пошта захищена] ).
Анотація
Тварини.
Для цього дослідження було отримано 45 нещодавно відлучених 4-7-тижневих самців мишей C57BL/6J (маса тіла: 15,10 ± 0,32 г) від Beijing Vital River Laboratory Animal Technology (Пекін, Китай) за дозволом SCXK (Пекін) 2014 -0001. Експерименти на тваринах проводили відповідно до Поводження та використання експериментальних тварин, проголошеного Міністерством охорони здоров’я Китайської Народної Республіки у 1998 р. Всі експерименти у цьому дослідженні були схвалені комітетом з етики Спортивного університету Шеньяна. Були зроблені всі зусилля, щоб мінімізувати кількість використаних тварин та їх страждання. Тварин утримували при кімнатній температурі (22 ± 5 ° C), відносній вологості 50 ± 10%, циклі світла і темряви 12/12 год, і їм забезпечували їжу та воду за бажанням. У кожній клітці містилося не більше п’яти мишей, а питну воду та підстилку міняли двічі на тиждень.
Харчовий вміст нормальної дієти з низьким вмістом жиру (НД) та СНВ був описаний раніше (24). Коротко кажучи, ND з низьким вмістом жиру містив 6% олії ріпаку та 30,5% пшеничного крохмалю за вагою, а HFD містив 21% освітленого вершкового масла та 15,5% пшеничного крохмалю за вагою. Інший харчовий вміст двох дієт був однаковим; перетравна енергія для ND з низьким вмістом жиру та HFD становила 16,1 та 19,4 МДж/кг відповідно. Дієти були отримані від Цзяньміна (Шеньян, Китай).
Встановлення індукованої HFD моделі ожиріння миші.
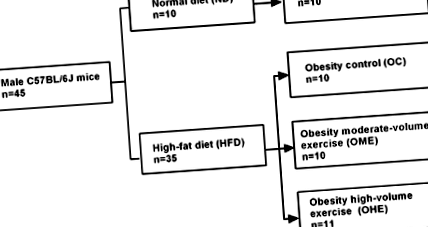
З 45 самців мишей C57BL/6J 10 випадково відібраних тварин були позначені як група ND і годувались ND, а решта 35 мишей були визначені групою HFD і годувались HFD. Через 10 тижнів, за винятком чотирьох мишей, у яких не було ожиріння, середня вага інших мишей становила> 120% від маси нормальної контрольної групи (NC), що відповідає стандарту для моделі ожиріння тварин (6). Далі мишей у групі HFD розподілили випадковим чином на наступні три групи: 10 мишей у групі контролю ожиріння (OC), 10 мишей у групі вправ із середнім обсягом ожиріння (OME) та 11 мишей у великих обсягах ожиріння ( OHE). Вага мишей у трьох групах суттєво не відрізнявся (P > 0,05). Миші в групі ND складали групу NC (рис. 1).
Рис. 1.Групування тварин. Для цього дослідження миші-самці C57BL/6J від 4 до 5 тижнів (n = 45) були випадковим чином розділені на звичайний раціон (ND; n = 10) та дієта з високим вмістом жиру (HFD; n = 35) групи. Після 10 тижнів дієтичного втручання 4 миші, у яких не розвинулося ожиріння, були виключені з групи HFD, а решта 31 миша була додатково розподілена на контроль ожиріння (OC; n = 10), ожиріння вправи середнього обсягу (ОМЕ; n = 10) та великі фізичні навантаження на ожиріння (ОГЕ; n = 11) групи.
Фізичне втручання (плавання).
Протягом 2 днів мишам в групах OME та OHE спочатку давали 10 хвилин тренувань з плавання для адаптації, а потім почали фактичні тренування. Це втручання базувалося на попередньому звіті з невеликими змінами (23). Коротше кажучи, мишей у попередньому дослідженні піддавали двом 60-хвилинним сеансам плавання/день протягом 5 днів/тиждень протягом 18 тижнів, що розглядалось як поміркована програма тренувань (23). Для порівняння, мишей у групі OME цього дослідження вправляли один раз на день (вранці), 6 днів/тиждень загалом 8 тижнів; у перший день їм було дозволено 20 хв вільного плавання, яке було збільшено на 10 хв/день, поки час вправ не досяг 120 хв/день наприкінці другого тижня, після чого цей обсяг підтримувався протягом решти 6 тижнів . Мишей у групі OHE вправляли двічі на день (один раз вранці та один раз вдень із 6-годинним розривом між ними), 6 днів/тиждень загалом 8 тижнів; тривалість часу та інтенсивність кожного тренування були такими ж, як і в групі OME, але загальний обсяг вправ був удвічі більший, ніж у групі OME. Мишам дозволялося вільно плавати без втручання в пластиковому басейні довжиною 45 см і глибиною 60 см з температурою води 32 ± 1 ° C.
Збір зразків.
Через 36–48 год після останньої вправи групами OME та OHE мишей голодували протягом 12 год та знеболювали внутрішньочеревною ін’єкцією етилкарбамату (5 мг/кг маси тіла). Кров відбирали з орбітального венозного сплетення, а сироватку відокремлювали і зберігали при -80 ° C до тестування. Одночасно яєчка, епідидиміди та насінні бульбашки швидко ізолювались та зважувались, підраховували сперму в епідидимісі та оцінювали їх рухливість (24, 34). Ізольований яєчко швидко охолоджували, помістивши в рідкий азот, а потім зберігали в морозильній камері -80 ° C. Нарешті, жирову тканину, що оточує яєчко, нирки та брижу, зважували як вміст жиру в черевній порожнині.
Вимірювання кількості та рухливості сперматозоїдів Cauda epididymis.
Від кожної миші отримували по одному придатку яєчка і поміщали в 1,0 мл буфера HEPES. Потім епідидим розрізали в місці з'єднання епідидиму тіла і хвоста, і хвост поміщали в лунку з 1,0 мл буфером HEPES. За допомогою ножиць епідідіміс хвоста розрізали на сегменти і обережно застосовували тиск, щоб сперма всередині сім’явивідної протоки звільнилася і змішалася з буфером.
Кількість та рухливість сперми оцінювали відповідно до рекомендацій Світової організації охорони здоров’я (34) (≥200 сперматозоїдів, врахованих для кожної проби). Кількість сперми (у клітинах/мкл) визначали за допомогою гемоцитометра (15 мкл/бік). Рухливість сперми оцінювали наосліп під світловим мікроскопом, класифікуючи 200 сперматозоїдів/тварину як прогресивно рухливу, непрогресивну рухливу або нерухому. Потім рухливість виражалася у відсотках від загальної кількості рухомих (прогресуюча рухова та непрогресуюча рухома сперма) (24).
Вимірювання гормону.
Виділення РНК та ПЛР-аналіз у реальному часі.
Вестерн-блот-аналіз.
Статистичний аналіз.
Дані виражаються як середні значення ± SE. Порівняння кількох груп проводили за допомогою одностороннього аналізу ANOVA з подальшим спеціальним тестом Стьюдента-Ньюмена-Кілса для проведення кількох порівнянь. Дані про кореляцію визначали за кореляцією Пірсона. Результати вважалися значущими для P значення
Рис.2.Збільшення або зменшення маси тіла до та після втручання. Усі дані виражаються як середні значення ± SE. A: збільшення маси тіла в періоди до втручання. n = 45. B: збільшення або зменшення маси тіла в періоди після втручання. n = 41. а P b P c P d P e P f P
Рис.3.Маса тіла, маса жиру в животі та відношення маси жиру в животі до збільшення або зменшення маси тіла до та після втручання. Дані виражаються як середні значення ± SE; n = 41. а P b P c P d P e P f P
Вплив HFD та фізичних вправ на гормономіри.
Рівні лептину та E2 у сироватці крові у групі мишей із ожирінням, індукованим 18 тижнів HFD, були значно підвищені (P 0,05; 4) і, таким чином, залишався значно нижчим за рівні в групі ОМЕ (кожен P
Рис.4.Вплив HFD та фізичних вправ на сироваткові гормони. Усі дані виражаються як середні значення ± SE; n = 41. а P b P c P d P e P f P
Рис.5.Кореляція рівня лептину в сироватці крові з тестостероном, рівнями естрадіолу та співвідношенням тестостерону до естрадіолу. У сироватці крові рівень лептину позитивно корелював з рівнем естрадіолу і негативно корелював із співвідношенням тестостерону до естрадіолу (P = 0,039 і P = 0,048, n = 41).
Вплив HFD та фізичних вправ на масу репродуктивних органів чоловіків.
Абсолютні маси репродуктивних органів суттєво не відрізнялися між групами мишей (P > 0,05; 6); однак відносна маса яєчок та насінних бульбашок мишей у групі ОК була значно нижчою, ніж у групі НК (P 0,05; 6). Ці вимірювання суттєво не відрізнялися між групами OHE та OME (P > 0,05; 6).
Рис.6.Вплив HFD та фізичних вправ на абсолютні та відносні маси репродуктивних органів. Усі дані виражаються як середні значення ± SE; n = 41. а P b P c P d P
Вплив HFD та фізичних вправ на параметри якості сперми.
У порівнянні з NC-групою миші з OC-групи демонстрували суттєво знижений вміст і рухливість сперми (P
Рис.7.Вплив HFD та фізичних вправ на параметри сперми. Усі дані виражаються як середні значення ± SE; n = 41. а P b P c P d P e P f P
Вплив дієти та вправ з високим вмістом жиру на експресію мРНК сигнального шляху LEP-JAK-STAT у яєчку.
У порівнянні з рівнем у групі NC рівень мРНК лептину був значно підвищений у групі OC (P 0,05; Рис.8).
Рис.8.Вплив HFD та фізичних вправ на рівні мРНК шляху лептину (LEP) -JAK-STAT у яєчках миші. Усі дані виражаються як середні значення ± SE; n = 41. а P b P c P d P
Вплив HFD та фізичних вправ на експресію мРНК сигнального шляху SF-1, StAR та P450scc у яєчку.
У порівнянні з такою у групі NC, експресія мРНК SF-1, StAR та P450scc була значно знижена в групі OC (P 0,05; Рис.9).
Рис.9.Вплив HFD та фізичних вправ на рівні мРНК стероїдогенного фактора-1 (Sf-1), стероїдогенного гострого регуляторного білка (StAR) та P-450 ферментів розщеплення бічного ланцюга (P450scc) в яєчку миші. Усі дані виражаються як середні значення ± SE; n = 41. а P b P c P d P e P f P
Вплив HFD та фізичних вправ на експресію білка сигнального шляху LEP-JAK-STAT у яєчку.
У порівнянні з таким у групі NC рівень експресії білка лептину в групі OC був значно підвищений (P 0,05; Рис.10).
Рис.10.Вплив HFD та фізичних вправ на рівень білка шляху LEP-JAK-STAT у яєчках миші. Усі дані виражаються як середні значення ± SE; n = 41. а P b P c P d P e P f P
Вплив HFD та фізичних вправ на експресію білка SF-1, StAR та P450scc у яєчку.
Порівняно з такою у групі NC, експресія білка SF-1, StAR та P450scc у групі OC значно зменшилась (кожна P 0,05; 11); таким чином, експресія цих білків у групі OHE була значно знижена порівняно з експресією в групі OME (кожна P
Рис.11.Вплив HFD та фізичних вправ на рівень білка SF-1, StAR та P450scc у яєчках миші. Усі дані виражаються як середні значення ± SE; n = 41. а P b P c P d P e P f P
У цьому дослідженні 4-тижневих мишей годували HFD протягом 18 тижнів, що призводило до збільшення маси їх тіла та жиру в животі на коефіцієнти 1,49 та 2,28 відповідно, порівняно з показниками групи ND, що вказує на те, що миші досягли серйозне ожиріння. Одночасно вони розвивали такі симптоми, як резистентність до лептину, зниження відносної ваги репродуктивних органів, порушення регуляції секреції статевих гормонів та зниження репродуктивної здатності, що узгоджується з попередніми повідомленнями (10, 28), але механізм яких чітко не вивчений. Раніше було продемонстровано, що високі концентрації сироваткового лептину чинять інгібуючу дію на репродуктивні функції у самців гризунів (2, 40) і що лептин і тестостерон негативно корелюють у чоловіків. Ці результати зумовлені взаємодією між чоловічими статевими гормонами та лептином, що виділяється жировою тканиною (8, 31). Це дослідження також виявило, що лептин у сироватці крові позитивно корелює з сироваткою Е2 і негативно корелює із співвідношенням тестостерону до Е2 у мишей-самців, що страждають ожирінням, викликаних дієтою, припускаючи, що зміни в репродуктивній функції чоловіків, спричинені ожирінням, тісно пов'язані з лептином у сироватці крові.
Лептин у сироватці крові може перетнути бар’єр крові-яєчка та зв’язатися з рецепторами на клітинах Лейдіга яєчка, регулюючи біосинтез тестостерону (13). Дослідження in vitro та in vivo показали, що підвищений рівень лептину може зменшити регуляцію експресії його рецептора (LepR) у тканині яєчка (5, 13). Однак про ефекти підвищеного сироваткового лептину, спричиненого ожирінням на ранніх стадіях, на сигналізацію лептину яєчка ще не повідомляється. Це дослідження вперше продемонструвало, що 18 тижнів HFD значно збільшували концентрацію лептину в сироватці крові та рівень мРНК та білка лептину в тканині яєчка. І навпаки, рівень мРНК та білка LepR, JAK2 та STAT3 у тканині яєчка значно зменшився. Ці висновки свідчать про те, що підвищений вміст лептину в сироватці крові, спричинений ожирінням, може погіршити передачу сигналу LEP-JAK2-STAT3 в яєчку.
Відповідно, оцінювали рівні експресії генів і білків, пов'язаних із синтезом тестостерону. Результати показали, що фізичні вправи середнього обсягу можуть ефективно регулювати експресію мРНК та білків ферментів синтезу тестостерону SF-1, StAR та P450scc, що відповідає зміні сигнального шляху лептину; однак великі фізичні вправи не мали значного ефекту. Для порівняння, експресія гена 17α-монооксигенази, пов’язаного із синтезом тестостерону (Cyp17a1) в тканинах яєчок було показано, що значно більший показник у мишей, які отримували фізичні вправи, порівняно з сидячими контрольними мишами (1). Крім того, Zhao et al. (42) виявили, що помірні фізичні навантаження (15 хв плавання щодня протягом 5 днів на тиждень) ефективно підвищують експресію білка StAR та P450scc в яєчках миші та підвищують рівень тестостерону в сироватці та яєчках на різних різних етапах життя. Таким чином, підсумовуючи, пропонується, що фізичні вправи з помірними обсягами можуть ефективно полегшити стійкість до лептину в тканинах яєчок, а також пригнічення синтезу тестостерону, викликане стійкістю до лептину.
Однак результати не стосуються того, чому великі фізичні вправи не дали такого ефекту. Слід зазначити, що довготривала, інтенсивна, велика фізична підготовка зменшує проліферацію імунних клітин у крові після стимуляції ліпополісахаридів та синтезу запальних цитокінів (14, 22). Крім того, запальні цитокіни, такі як TNF-α та IL-1β, здатні обмежувати синтез тестостерону, пригнічуючи експресію мРНК та білка P450scc, 17α-гідроксилази/С17,20 ліази (P450c17) та 3β-HSD в клітинах міжклітинних яєчок миші (36). Крім того, тривала фізична підготовка великих обсягів індукує посилений синтез АФК, зниження антиоксидантної здатності та посилення перекисного окислення, спричиняючи знижену експресію мРНК ферментів 3β-HSD та 17β-гідроксистероїддегідрогенази, пов’язаних із синтезом тестостерону, та зниження експресії білка StAR у яєчках. тканини, що призводить до зниження синтезу тестостерону, порушення сперматогенезу та зменшення кількості та рухливості сперми (17). З цих причин пропонується, щоб ці негативні ефекти великих фізичних вправ нівелювали позитивний полегшуючий ефект на сигнальний шлях лептину, хоча точний механізм вимагає подальших досліджень.
Перспективи та значення
На закінчення це дослідження показало, що ожиріння на ранніх стадіях пригнічує біосинтез тестостерону, гальмує статевий розвиток та знижує репродуктивну здатність чоловіків, порушуючи шлях трансдукції лептину яєчка. Тривалі вправи середнього обсягу ефективно зменшували жир в організмі, полегшували блокування передачі сигналу лептину яєчка, сприяли біосинтезу тестостерону та зменшували негативний вплив ожиріння на репродуктивну функцію чоловіків; навпаки, хоча тривалі вправи з великими обсягами ефективно зменшували жирові відкладення та зменшували стійкість до лептину, вони не полегшували негативний вплив ожиріння на яєчка. Отже, це дослідження показує один із можливих механізмів, що лежить в основі втручання, що покращує гіпогонадизм мишей-самців із ожирінням, проте майбутні дослідження на людях ще не потрібні, щоб визначити, чи призведуть подібні результати.
Ця робота фінансувалась Фондом природничих наук Китаю, грантами 81273096 та 81472992.
- Дієта та фізичні вправи при лікуванні ефекту ожиріння від 3 втручань на резистентність до інсуліну -
- Вплив голодування та фізичних вправ на чергування на метаболізм холестерину у людей із зайвою вагою та ожирінням
- Вплив фізичних вправ на концентрацію біологічних мікроелементів та експресію селенопротеїну Р у
- Вплив фізичних вправ на лімфоцити та цитокіни Британський журнал спортивної медицини
- Вплив дієтичної лактози на довготривале ожиріння, викликане дієтами, у щурів - PubMed