Вплив кави без кофеїну на функцію та метаболізм нуклеотидів у нирках
І. М. Рибаковська
1 Кафедра біохімії та клінічної фізіології Медичного університету Гданська, Дебінки 1, 80-211, Гданськ, Польща
Р. Мільчарек
2 Кафедра фармацевтичної біохімії, Медичний університет Гданська, Гданськ, Польща
Є. М. Сломінська
3 Кафедра біохімії, Медичний університет Гданська, Гданськ, Польща
Р. Т. Смоленський
3 Кафедра біохімії, Медичний університет Гданська, Гданськ, Польща
Анотація
Мало відомо про вплив кави, який не пов’язаний з наявністю кофеїну. Метою дослідження було проаналізувати зміни функції нирок та метаболізму нуклеотидів, пов'язані з високим споживанням кави без кофеїну. Миші споживали екстракт кави без кофеїну протягом двох тижнів. Діяльність AMP-дезамінази, екто5'-нуклеотидази, аденозин-дезамінази, пуринових нуклеозид-фосфорилаз вимірювали в корі нирки та мозковому мозку аналізом перетворення субстратів у продукти за допомогою ВЕРХ. Концентрацію нуклеотидів у корі нирки, довгастому мозку та сироватці оцінювали за допомогою ВЕРХ. Активність екто5'-нуклеотидази зросла з 0,032 ± 0,006 до 0,049 ± 0,014 нмоль/мг тканини/хв у корі нирок мишей, яким вводили високу дозу безкофеїнової кави (HDC), разом із підвищенням концентрації аденозину в корі та зменшенням концентрації креатиніну в плазмі. HDC призводить до підвищеної активності екто5′-нуклеотидази в корі нирки, що в результаті збільшує концентрацію аденозину. Дивно, що це спричинило покращення функції виведення нирок.
Вступ
За підрахунками, понад 59% дорослих у Сполучених Штатах п’ють кавові напої, а також в інших розвинених країнах [1]. Хоча споживання кави є переважаючим, приблизно 15% населення США взагалі перестали пити каву, посилаючись на занепокоєння щодо здоров'я, зменшення кількості кави було стратегією запобігання таким симптомам сечовивідних шляхів, як синдром болю в сечовому міхурі [1]. Є повідомлення про рандомізовані контрольовані дослідження хронічного споживання кави, які підтвердили незначне, але статистично значуще підвищення систолічного артеріального тиску та діастолічного артеріального тиску [2].
Хоча споживання кофеїну в діапазоні 200–300 мг збільшує рівень кальцію в сечі як у молодих, так і у людей старшого віку, переважання даних свідчить про те, що кофеїн має більший вплив на метаболізм кальцію та кістки у людей похилого віку [3]. Хоча споживання кофеїну може збільшити виведення кальцію з сечею, кофеїнсодержащі напої асоціюються з меншим ризиком розвитку нефролітіазу. Споживання кофеїну пов'язано з меншим ризиком виникнення каменів у нирках [4].
Також досліджували вплив кави на метаболізм та генотоксичність харчового канцерогену. Кава збільшила експресію CYP1A2 у 16 разів у групі, яка отримувала 5% кави, і приблизно половина цього індуктивного ефекту була приписана кофеїну. Кава також збільшила експресію ферментів, що беруть участь у детоксикації дієтичних канцерогенів, таких як глутатіон S-трансфераза альфа [5]. Існує кілька доказів того, що кофеїн незначно підвищує ризик раку в основних органах [6], але є також дані, що кава може надавати захисний ефект проти раку прямої кишки [7–9]. Є також деякі докази того, що кава призводить до збільшення деяких маркерів запалення.
Прийом кави без кофеїну асоціювався з невеликим і клінічно нерелевантним зниженням середнього діастолічного артеріального тиску [10]. Кава та кава без кофеїну мають здатність покращувати продуктивність під час протоколу вправ на опір [11]. Інші сполуки замість кофеїну, включаючи поліфеноли або інші, можуть бути корисними чи шкідливими [12]. Через наявність у каві та чаї численних природних поліфенольних антиоксидантів, ці напої привернули увагу як можливий безпечний засіб захисту від активних форм кисню [13]. Ряд продуктів харчування та напоїв містять ізотіоціанати, поліфеноли, дитерпени та інші компоненти, які, як повідомляється, індукують глутатіон S-трансферази, ферменти, що детоксикують широкий спектр дієтичних та екологічних забруднень [14–16]. Необхідно враховувати вплив активних сполук кави без кофеїну на роботу нирок.
Нуклеотиди будують ДНК, РНК та інші важливі молекули, такі як коферменти, АТФ, з високими енергетичними зв'язками. Фізіологічна роль реакції, що каталізується ферментами нуклеотидного метаболізму AMP-дезамінази (AMPD) та екто5'-нуклеотидази (e5NT), аденозин-дезамінази (ADA) у нирках, полягає головним чином у регулюванні пулів нуклеотидних аденинів у клітині та контролі концентрації аденозину. Добре доведено, що кофеїн може впливати на аденозинові рецептори як його антагоніст, а також інгібує фосфодіестеразу, відповідальну за трансформацію цАМФ в АМФ. cAMP, зокрема, регулює гормоночутливу до триацилгліцерину ліпазу в жировій тканині [17, 18]. Факти свідчать, що аденозинові рецептори пригнічують ліполіз, зменшуючи активність аденилатциклази, що робить аденозинові рецептори потенційною мішенню при ожирінні та діабеті [17]. Рецептори аденозину розташовані у всьому тілі, але в основному їх можна знайти в мозку, серці, судинах, нирках та жировій тканині. На відміну від ефекту кави, пов’язаного з кофеїном, мало відомо про дію сполук, крім кофеїну, присутніх у каві.
Метою даного дослідження було оцінити вплив кави без кофеїну на ферменти перетворення нуклеотидів, рівень аденозину та енергетичну рівновагу в нирках та її відношення до основних аспектів функції нирок.
Матеріали і методи
Приготування кави
Кавовий еспресо готували з 7 г порошку без кофеїну в 25 мл води за допомогою кавової машини високого тиску. 0,33 мл кофеїнової кави та 0,33 мл безкофеїнової кави розводили у 5 мл води для щоденної дози відповідно кофеїну (Caff) та низької дози безкофеїнової кави (LDC) для мишей. 3,3 мл екстракту кави без кофеїну розбавляли в 5 мл води, що було приблизною добовою високою дозою для мишей - HDC.
Тварини
Дослідження було схвалено Гданським комітетом з питань етики для експериментів на тваринах - 29/2012. Тримісячних мишей C57/BL-6 обробляли протягом двох тижнів без обмежень (близько 5 мл/день/миша) водою або розчином кофеїнової кави (Caff), низькодозованою кавою без кофеїну (LDC) та високими дозами екстракт кави без кофеїну (HDC). Кавовий екстракт містив від 0,68 до 6,8 мг розчиненої кави на мл відповідно для Caff, LDC та для HDC. Через цей час мишей знеболювали 2,5 мкг ксилазину і 43 мкг кетаміну/г ваги мишей і збирали органи. Кров збирали з кавальної вени. Для визначення нуклеотидів одну нирку заморозили щипцями, попередньо охолодженими в рідкому азоті, а для визначення активності нирку розділили на кору і довгастий мозок, а потім заморозили.
Вимірювання концентрацій нуклеотидів
Нирки ліофілізували, розділяли на кору та мозковий мозок, а потім екстрагували 25-кратним об'ємом 0,4 М HClO4. Після цього зразки центрифугували протягом 5 хв при 14000 об/хв при 4 ° С. Надосадову рідину нейтралізували 2 М КОН, а потім інкубували протягом 10 хв на льоду. Супернатант, отриманий після 5 хв центрифугування при 14000 об/хв при 4 ° C, аналізували за допомогою ВЕРХ. Сироватку екстрагували в тому ж обсязі 1,3 М HClO4, потім центрифугували і надосадову рідину нейтралізували 3 М K3PO4. Після центрифугування супернатанти аналізували за допомогою ВЕРХ.
Вимірювання активності ферментів метаболізму нуклеотидів
Діяльність AMP-дезамінази (AMPD), екто5-нуклеотидази (e5NT), аденозин-дезамінази (ADA), пуринових нуклеозид-фосфорилаз (PNP) вимірювали шляхом визначення продуктів реакції з ВЕРХ, як описано раніше [19].
Нирки гомогенізували при 4 ° С у 9 обсязі буфера (150 мМ KCl, 20 мМ Трис, 1 мМ ЕДТА, 1 мМ дитиотреїтолу, рН 7,0). Частину сирого гомогенату відбирали для визначення 5NT через 1 год при 4 ° C. Залишок гомогенату центрифугували при 3400 об/хв при 4 ° С протягом 10 хв, а потім додавали в обсязі 50 мкл до специфічного для конкретного ферментного буфера і інкубували з 50 мкл відповідного субстрату для ферментного буфера при 37 ° С. Буфер для визначення AMPD складався з 20 мМ TRIS, 150 мМ KCl, 1 мМ дитиотреїтолу, для визначення 5NT складався з 50 мМ TRIS, 5 мМ MgCl2, 10 мМ β гліцеролфосфату, 0,1% TRITON X-100. Буфер для визначення ADA складався з 50 мМ TRIS, а для PNP - 50 мМ NaH2PO4. Концентрації субстрату становили 25 мМ AMP для AMPD, 1 мМ аденозину для ADA, 1 мМ інозину для PNP та 0,2 мМ AMP для 5NT. Реакцію припиняли додаванням 100 мкл 1,3 М HClO4 і після центрифугування нейтралізували до рН 6–7 3 М K3PO4. Центрифуговані екстракти аналізували за допомогою ВЕРХ [20].
Статистичний аналіз
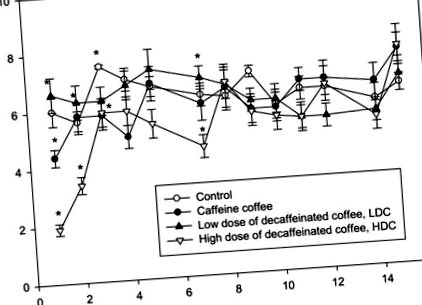
Дані виражаються як середнє значення ± стандартне відхилення (SD). Значення порівнювали з однофакторною дисперсійною ановою (ANOVA). Post-hoc тест Тукі використовувався для подальшого визначення значущості відмінностей, які вважалися значущими на с. 1). Концентрація пулу нуклеотидів аденіну не змінювалася між групами в корі нирки та довгастому мозку (рис. 2, а). Концентрація аденозину (Ado) зросла вдвічі у мишей кори нирок, які пили каву без кофеїну з високою дозою (HDC), і також зросла, але вона була меншою у групах Caff та LDC. Такі зміни концентрації аденозину не спостерігались у мозковій речовині нирки (рис. 2, б). Більш того, концентрація ІМП та інозину не змінювалась у групі HDC, але зростала у групі Caff у мозковому мозку (рис. 2 c, d). Ми відзначили збільшення концентрації інозину в Caff та LDC-групі в корі та вдвічі більше у Caff-групі в мозковому мозку (рис. 2, г).
Об’єм рідини, що потрапляє в С (воду), кофеїнову каву, низькодозова кава без кофеїну ЛДГ або групи високої дози кави без кофеїну HDC. Значення є середніми ± SD, n = 6, * p # p # p 3 a). Ми помітили збільшення екто 5′-нуклеотидази (e5NT) у корі нирок мишей HDC та більший приріст групи Caff та LDC та зворотний зв’язок у довгастому мозку: приблизно в два рази зменшення мозкового мозку нирок досліджуваних мишей порівняно з контрольними мишами (рис. 3 б). Активність аденозиндезамінази (АДА) збільшилась у корі кори Caff та групах НРС (рис. 3 в). Ми також спостерігали збільшення активності пуринової нуклеозидфосфорилази (PNP) у мишей Caff у мозковій речовині відповідно до групи НРС та HDC (рис. 3, d).
Концентрації a нуклеотид аденіну, b аденозин, c інозин, d гіпоксантин, e ксантин f сечова кислота, g креатинін у сироватці крові; C-контрольна миша пила воду, Caff-миші пили кофеїнову каву, LDC-миші, що отримували низькодозова кава без кофеїну, миші HDC, отримували високу дозу кави без кофеїну. Значення є середніми ± SD, n = 6, b * p # p # p # p ([ATP] + 1/2 [ADP])/([ATP] + [ADP] + [AMP]) потенціал фосфорилювання ([ATP]/([ADP] × [Pi]) ) та гідроліз вільної енергії АТФ [20, 22]. У нирках пуриновий нуклеотидний цикл відіграє фундаментальну роль у захисті пуринового кільця від деградації. Він також відповідає за утворення аміаку та фумарату, що підвищує ефективність та взаємозв'язок між гліколізом та циклом Кребса. Більше того, він регулює рівень АМФ, який є основним джерелом аденозину в нирках [23]. Концентрація нуклеотидів аденіну (АТФ + АДФ + АМФ) не змінювалась в корі та довгастому мозку, але змінювала активність АМФД у Caff та LDC групі в корі in vivo після вживання кави.
Активність PNP, ферменту, який метаболізує інозин до гіпоксантину, дещо знизилась у мишах кори нирки та мозолі HDC, що відображається у тенденції до збільшення концентрації інозину та зниження гіпоксантину. Однак ми помітили тенденцію до збільшення активності PNP у корі та збільшення групи Caff із збільшенням концентрації гіпоксантину порівняно з групою HDC. Збільшення активності PNP у групі Caff у нирках не відповідало змінам концентрації інозину, які зростали. Однак це може бути результатом вищої активності ADA.
Раніше дослідження показало, що гіперфільтрація, яка є раннім маркером діабетичної нефропатії, пов'язана з більшою здатністю нирок виробляти та виводити аденозин [24, 25]. Гіперфільтрація - це дія натрійуретичного фактора передсердь (ANF) та глюкагону. Були дослідження, в яких використовується аденозиндезаміназа, яка перетворює аденозин в інозин, для усунення ефекту внутрішньониркового аденозину на гломерулярну гіперфільтрацію. Результати показали, що у щурів, які отримували ADA, ANF та глюкагон, різко збільшували клубочкову фільтрацію (GFR), тоді як лікування лише ADA не виявляло змін у ШКФ та нирковому плазмовому потоці. Вважається, що ендогенний нирковий аденозин запобігає гіперфільтрації, спричиненій АНФ та глюкагоном [16]. Можливо, кава без кофеїну та кофеїну спричиняє збільшення фільтрації та вироблення аденозину (рис. 2, б). Більш низька концентрація аденозину в Caff та нирковій корі нирок, ніж у HDC, може бути результатом більш високої активності ADA, що спричиняє збільшення інозину в групі Caff. Аденозин швидко метаболізується, тому його сироваткові концентрації (рис. 4, б) можуть не відображати його концентрацію in vivo в циркулюючій крові.
Результати цього дослідження продемонстрували, що велике споживання кави без кофеїну збільшує утворення аденозину в корі нирки по шляху екто5'-нуклеотидази. Це було пов'язано зі збільшенням виведення креатиніну.
Подяки
Цю роботу підтримав Гданський медичний університет (грант № ST-534).
- Вплив ожиріння на гострі зміни функції функції дихальних шляхів, реактивності та запалення, спричинені озоном
- Кава та хвороби нирок Чи безпечно це Національний фонд нирок
- Вплив харчових мінеральних поживних речовин та вітамінів на метаболізм щурів, які харчуються з високим вмістом жиру - PubMed
- Вплив екстракту лушпиння цибулі на функцію ендотелію та клітини-попередники ендотелію при надмірній вазі
- Чи погіршує довгострокові добавки креатину функцію нирок у осіб, які тренуються на стійкість