Вплив ізоенергетичної традиційної середземноморської дієти на кінетику аполіпопротеїну A-I у чоловіків з метаболічним синдромом
Анотація
Передумови
Вплив середземноморської дієти (MedDiet) на кінетику ліпопротеїнів високої щільності (ЛПВЩ) до сьогодні не вивчався. Таким чином, метою цього дослідження було дослідити вплив MedDiet за відсутності змін маси тіла на кінетику аполіпопротеїну (апо) A-I у чоловіків із метаболічним синдромом (MetS).
Методи
Двадцять шість чоловіків із MetS (NCEP-ATP III) були набрані із загальної спільноти. У цьому дослідженні з фіксованою послідовністю дієта учасників вперше була стандартизована до контрольної дієти, що відображає поточні середні показники споживання макроелементів у чоловіків Північної Америки, причому всі продукти та напої надаються в ізоенергетичних умовах протягом 5 тижнів. Потім учасників годували ізоенергетичним MedDiet протягом наступних 5 тижнів, щоб підтримувати свою вагу постійною. Протягом останнього тижня кожної дієти учасники отримували разову болюсну дозу [5,5,5-2 H3] L-лейцину, і зразки крові натщесерце збирали у визначені моменти часу. Кінетику ApoA-I визначали багатокомпонентним моделюванням із використанням даних про ізотопне збагачення з часом. Дані аналізували за допомогою змішаних моделей.
Результати
Реакція ЛПВЩ-холестерину (С) на MedDiet була неоднорідною, так що середніх змін не було порівняно з контрольною дієтою. Концентрація apoA-I у плазмі (-3,9%) та розмір басейну (-5,3%, обидва P
Передумови
Низькі концентрації ліпопротеїдів-холестерину високої щільності (HDL-C) та високі концентрації тригліцеридів (TG) у плазмі є двома діагностичними критеріями метаболічного синдрому (MetS) [1]. Надмірна секреція ліпопротеїнів-аполіпопротеїнів дуже низької щільності (VLDL-apoB) та прискорений кліренс частинок ЛПВЩ, здається, є основними механізмами підтримки фенотипу високого рівня ТГ/низького рівня ЛПВЩ у MetS [2].
Попередні дослідження продемонстрували, що коли маса тіла підтримується постійною, дієти з низьким вмістом насичених жирів і високим вмістом вуглеводів (СНО) мають ефект зниження рівня ЛПВЩ та підвищення рівня ТГ [3]. З іншого боку, кілька епідеміологічних досліджень показали, що дотримання дієти середземноморського типу (MedDiet), яка характеризується серед інших факторів великим споживанням мононенасичених жирних кислот (MUFA) та низьким споживанням насичених і трансжирів, пов'язана з знижений ризик загальної смертності та смерті від серцево-судинних захворювань [4]. Однак ступінь, до якого це пов’язано зі сприятливими змінами концентрацій ЛПВЩ та функцій MedDiet, невідома. Нещодавній мета-аналіз 50 досліджень показав, що прихильність препарату MedDiet було пов'язано зі значним зменшенням маси тіла та окружності талії [5]. Таким чином, незрозуміло, чи сприятливе підвищення концентрації ЛПВЩ у плазмі крові, яке часто спостерігається при застосуванні MedDiet, зумовлене різницею у складі дієти як такі або одночасним зменшенням маси тіла. Краще розуміння того, як змінюється метаболізм ЛПВЩ у відповідь на MedDiet, як такі, вирішальне значення має допомогти визначити оптимальні дієтичні втручання для управління низькою концентрацією ЛПВЩ у осіб з високим ризиком.
Метою цього дослідження було дослідити вплив MedDiet, за відсутності зміни ваги, на кінетику аполіпопротеїну (апо) A-I у чоловіків із MetS. Ми висунули гіпотезу, що на відміну від попередніх даних, що задокументували комбінований ефект MedDiet та втрати ваги, короткочасне споживання традиційного MedDiet за відсутності втрати ваги не впливає на катаболічний рівень apoA-I і, отже, на ЛПВЩ у плазмі крові. -С концентрації.
Методи
Населення та дизайн дослідження
Деталі проекту дослідження були описані раніше [6]. Коротко кажучи, 26 чоловіків (від 18 до 65 років) діагностували MetS (NCEP-ATP III [1]), і які не курили, не маючи в анамнезі ішемічної хвороби серця (ІХС) або діабету 2 типу і не використовували ліпідних для дослідження були залучені ліки, що знижують або антигіпертензивні засоби. Для включення в дослідження чоловіки також мали мати стабільну вагу принаймні за 6 місяців до початку дослідження, не вживати вітамінних добавок або натуральних оздоровчих продуктів і не мати відрази до певних компонентів MedDiet. Процедури дослідження були затверджені Комітетом з етики досліджень Університету Лаваль, і письмова інформована згода була отримана від усіх учасників перед тим, як бути зарахованими до дослідження.
Ізоенергетичні експериментальні дієти
Дієта учасників вперше була стандартизована до контрольної дієти, що відображає поточні середні показники споживання макроелементів у чоловіків Північної Америки [7]. Харчування забезпечувалося в ізоенергетичних умовах протягом 5-тижневого періоду для підтримки постійної маси тіла. Цей контрольований період годування був включений до протоколу, щоб мінімізувати між-індивідуальні зміни, що приписуються звичному раціону кожного учасника. Потім учасникам був наданий MedDiet (5 тижнів), який був сформульований таким чином, щоб відповідати характеристикам традиційного режиму харчування в Середземномор’ї знову в ізоенергетичних умовах для підтримки постійної маси тіла [8]. Для дослідження були розроблені семиденні меню та щоденні порції різних категорій їжі для контрольної дієти та MedDiet, які були описані раніше [6]. Середній харчовий склад контрольної дієти та MedDiet представлений у таблиці 1.
Всі страви, продукти харчування та напої, включаючи червоне вино, були надані учасникам відділу клінічного дослідження (CIU) Інституту харчування та функціональних продуктів харчування (INAF). Для більшості чоловіків обід (40% від щоденного споживання енергії) їли в КІУ, а вечері та сніданки вдома. Чоловікам було наказано споживати лише передбачену їжу та повідомляти про будь-які відхилення від встановленого протоколу в контрольних списках. Вживання вітамінних добавок, протизапальних препаратів (НПЗЗ) та натуральних продуктів для здоров'я було суворо заборонено протягом усього експериментального періоду. Випробовуваним було наказано підтримувати звичний рівень фізичної активності, за винятком 3 днів, що передували періодам забору крові, протягом яких їм пропонувалось утримуватися від інтенсивних фізичних вправ.
Кінетичний протокол
Всі учасники пройшли кінетичне дослідження протягом останнього тижня контрольної дієти та MedDiet. Кожного разу після 12-годинного голодування учасники отримували по одній i.v. болюс [5,5,5-2 H3] L-лейцину (11 мг/кг) та зразки крові натще (20 мл) збирали у заздалегідь визначені моменти часу протягом 96 годин (0, 0,5, 1, 2, 4, 6, 8, 10 год). Додаткові дванадцятигодинні зразки крові натще збирали вранці наступних 4 наступних днів (24, 48, 72, 96 год). Учасники залишались на дослідних дієтах протягом кінетичного дослідження (5 днів).
Оцінка ліпідів та ліпопротеїдів у плазмі крові
Ліпіди плазми вимірювали ферментативно на модулі Roche/Hitachi Modular, використовуючи реагенти Roche Diagnostics (Roche diagnostics GmbH, Мангейм, Німеччина) відповідно до стандартизованих процедур [9]. Вміст холестерину та тригліцеридів у субфракціях HDL2 та HDL3 визначали після послідовного осадження сульфатом декстрану, як описано раніше [10]. Концентрації апоА-I у плазмі вимірювали за допомогою нефелометрії (Дейд Берінг, Міссісога, Онтаріо, Канада). Концентрацію глюкози в крові натще визначали методом гексокінази-глюкоза-6-фосфатдегідрогенази [11], а концентрацію інсуліну натще - радіоімуноаналізом [12].
Кількісне визначення та ізотопне збагачення аполіпопротеїну A-I
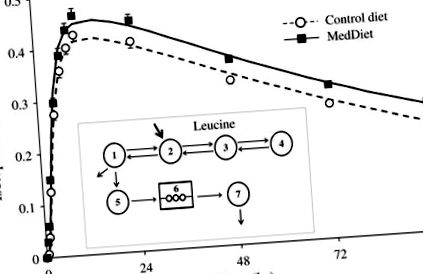
ApoA-I в г Рисунок 1
Ізотопне збагачення з часом та багатокомпонентна модель, що використовується для отримання внутрішньосудинної кінетики аполіпопротеїну A-I (apoAI). Середнє ізотопне збагачення з часом apoA-I плазми для 26 чоловіків за допомогою MetS (символи), прогнозовані значення моделі (лінії) та багатокамерна модель, що використовується для визначення кінетичних параметрів apoA-I (вставка). Відділення 1–4 відображають кінетику лейцину в плазмі. Відділ 5 являє собою внутрішньоклітинний пул лейцину (печінкової та інших тканин), з якого синтезується апоАІ і з’являється в циркуляції (відсік 7) після затримки (відсік 6).
Статистичний аналіз
Дані подаються як середнє значення ± SD та відсоток зміни від контрольної дієти, якщо не вказано інше. Дані аналізували, використовуючи процедуру PROC MIXED для повторних вимірювань при САС з дієтою (MedDiet проти контрольної дієти) як основного повторного ефекту (v9.2, Cary, NC). Індивідуальна відповідь ХС ЛПВЩ на MedDiet була неоднорідною, і “відповіді” та “невідповідачі” на MedDiet були визначені на основі довільно визначеної зміни рівня плазмового ЛПВЩ як позитивного (≥ 0,05 ммоль/л) або негативного (≤ 0,05). ммоль/л). Суб'єкти, коли варіації рівня ЛПВЩ були близькі до 0, були виключені, щоб максимізувати відмінності між групами. Дві групи порівнювали за допомогою непараметричного тесту Вілкоксона-Манна-Уітні, тоді як парні підписані ранги використовувались для оцінки змін у групі. Одновимірні кореляційні аналізи Пірсона, скориговані з урахуванням віку, використовувались для вивчення асоціації між зміною рівня ЛПВЩ-ЛПВЩ, спричиненою дієтою, та іншими параметрами. Змінні з косим розподілом перетворювали log-10 перед статистичним аналізом. Відмінності в P ≤ 0,05 (двосторонні) вважалися значущими.
Результати
Характеристики скринінгу 26 учасників з MetS наведені в таблиці 2 [6]. На підставі контрольного списку продуктів харчування середня відповідність склала 98,0 ± 5,3% для обох ізоенергетичних експериментальних дієт і була однаковою для обох дієт (не показано). Ліпідний профіль та кінетичні дані апоА-I після контрольної дієти та MedDiet представлені в таблиці 3 [6]. Вага тіла зменшилась на 1,2 ± 0,9 кг (P Таблиця 2 Фізичні характеристики та метаболічний профіль 26 суб'єктів чоловічої статі при скринінгу
Індивідуальна реакція HDL-C на MedDiet була дуже неоднорідною (рис. 2, панель A). Учасники, серед яких концентрації ЛПВЩ-C були збільшені за допомогою MedDiet (відповіді: середнє значення ∆ HDL-C: 9,9 ± 3,2%, N = 11), продемонстрували значно більші зниження рівня apoA-I FCR та концентрації apoB та VLDL-TG (усі P Малюнок 2
Обговорення
Чоловіки з MetS споживали заздалегідь визначений MedDiet у ретельно контрольованих ізоенергетичних умовах годування, після стандартизації дієти учасників на контрольній дієті, щоб мінімізувати варіації між індивідуальними варіаціями базової кінетики apoA-I. Ми показали, що короткочасне споживання MedDiet протягом 4-5 тижнів суттєво знижувало концентрацію апоА-I у плазмі та розмір басейну, але не впливало в середньому на концентрацію HDL-C у плазмі крові. Це суперечить даним досліджень, які показали, що дотримання принципів MedDiet було пов’язано із поліпшенням концентрацій ЛПВЩ [15, 16]. Однак прихильність до MedDiet також була пов'язана зі значно нижчою масою тіла [15, 16], що, ймовірно, змішало вплив дієти на концентрації ЛПВЩ [17, 18]. Хоча споживання MedDiet не впливало на середні концентрації apoA-I FCR та концентрації VLDL-TG у плазмі крові, індивідуальна відповідь HDL-C на MedDiet у чоловіків із MetS, як видається, головним чином визначалася тим, як були концентрації apoA-I FCR та VLDL-TG модифікований дієтою у кожної людини.
Кілька попередніх досліджень показали, що концентрації TG позитивно корелюють з катаболізмом apoA-I [31, 32]. Наші дані узгоджуються з цією концепцією. Зниження рівня VLDL-TG зменшує гетерообмін нейтральних ліпідів за допомогою CETP, що призводить до менш збагаченого TG частинок HDL [33]. Показано, що ЛПВЩ, бідний на TG, є більш стабільним і, отже, менш швидко виводиться з кровообігу [34]. Ми припускаємо, що збільшення споживання алкоголю за допомогою MedDiet може бути частково відповідальним за неоднорідну реакцію TG у цих суб'єктів із MetS. Дійсно, недавнє дослідження показало, що вживання алкоголю з великою кількістю може призвести до високих або низьких концентрацій VLDL-TG [35]. Нарешті, дієти з низьким вмістом вуглеводів та жирів мають ефект підвищення рівня ЛПВЩ та зниження рівня ТГ порівняно з дієтами з високим вмістом вуглеводів та жирів [36]. Можливо, відносно високий вміст вуглеводів MedDiet у нашому дослідженні, можливо, послабив його вплив на концентрацію ЛПВЩ в плазмі крові. Дійсно, було показано, що MedDiet з високим вмістом жиру, доповнений горіхами, зменшує ТГ і збільшує концентрацію ЛПВЩ у порівнянні з дієтою з низьким вмістом жиру [37].
Наскільки нам відомо, це перше дослідження, яке задокументувало вплив MedDiet на кінетику apoA-I у чоловіків із MetS. Ретельно контрольована особливість годування у цьому дослідженні, висока відповідність заздалегідь визначеним дієтам та відносно велика кількість учасників, які розглядають кінетичне дослідження, є важливими сильними сторонами, на яких слід наголосити. Обмеження поточного дослідження стосуються того факту, що не було контрольної групи, незалежної від втручання, і що учасники не були рандомізовані до двох експериментальних дієт у цьому дослідженні з фіксованою послідовністю. Однак стандартизація базової дієти з контрольною північноамериканською дієтою до споживання MedDiet дозволила нам мінімізувати міжособистісні коливання базової кінетики apoA-I, і кожен учасник діє як власний контроль. Тривалість сортування дослідження виключає будь-яке офіційне тлумачення щодо більш тривалого впливу MedDiet на ЛПВЩ та кінетику apoA-I. Незважаючи на те, що MedDiet не впливав на ЛПВЩ, деякі функції частинок ЛПВЩ все ще можуть бути корисно змінені дієтою, але це ще слід дослідити.
Висновки
Дані цього дослідження контрольованого годування свідчать про те, що гетерогенна відповідь HDL-C на традиційний MedDiet у чоловіків із MetS, незалежно від зміни ваги, в основному визначається індивідуальними реакціями в концентраціях apoA-I FCR та TG. Зниження PRA apoA-I з MedDiet, мабуть, не впливає на відповідь ЛПВЩ на дієту, і, ймовірно, це пов'язано зі зменшенням кількості SFA та одночасним зниженням концентрацій LDL-C.
- ВПЛИВ ДІЄТИКИ НИЗЬКОГЛІКЕМІЧНОГО ІНДЕКСУ НА РОЗМІР АПОЛІПОПРОТЕІНУ В І ЛПНЩ - Срічайкул - 2015 -
- Вплив середземноморської дієти з втратою ваги та без неї на серцево-судинні фактори ризику у чоловіків
- Вплив генотипу аполіпопротеїну Е та дієти на ліпідацію аполіпопротеїну Е та амілоїдні пептиди
- Вплив дієти з високим вмістом жиру на кількісні особливості адипоцитів у сальнику експериментальний,
- Вплив 6-місячної веганської дієти з низьким вмістом вуглеводів («Еко-Аткінс») на серцево-судинні фактори ризику та