Вплив хронічної травми спинного мозку на масу тіла та склад тіла у щурів, яких годували стандартною дієтою чау
Анотація
втрата ваги після травми є загальним наслідком будь-якої хірургічної процедури або серйозної аварії, включаючи пошкодження спинного мозку. На ранніх стадіях SCI відразу відзначаються зменшення енергетичних витрат, збільшення швидкості катаболізму та великі втрати азоту, які можуть тривати від тижнів до декількох місяців (29, 30, 43). Втрати азоту внаслідок ДЗЗ ускладнюються раптовою і повною атрофією м’язів, що не застосовуються, нижче рівня травми, і ці втрати зберігаються, незважаючи на парентеральне введення. Парентеральні харчові розрахунки при лікуванні гострих ІМС у людей є переважно неадекватними, якщо базуватися на загальновживаному рівнянні Гарріса-Бенедикта (29, 43). Наприклад, ця неадекватність у прийомі добавок призвела до поганого харчового статусу у пацієнтів з параплегією та квадриплегією протягом 2 тижнів спостереження (29).
Взагалі, клінічні звіти вказують на те, що особи, хворих на ІХС, ризикують протягом життя нездатністю підтримувати нейтральний енергетичний баланс (наприклад, посилання 7, 29, 30, 47, 48). Харчовий дефіцит, що призводить до недостатньої маси тіла при ІМС, представляє ряд факторів ризику для людини як у гострій, так і в хронічній фазі травми. Низька маса тіла збільшує ризик розвитку інфекції та подовжує процес відновлення після великих травматичних ушкоджень (13, 14). Крім того, недостатня маса підшкірного жиру збільшує ризик розвитку виразки тиску (1, 45). Виявлення рецидивів виразки тиску, в свою чергу, є супутнім захворюванням, яке викликає прозапальний викид цитокінів, що може посилити кахексичний стан пацієнта (8).
Нашою метою було перевірити пошкодження жирової та нежирної маси та пов'язаний з цим ризик розвитку або надмірної втрати жирової маси (недостатня вага), або пов'язаного з ожирінням метаболічного синдрому через надмірне ожиріння у тварин з хронічним перерізом спинного мозку на рівні Т3. Зокрема, ми проаналізували загальну масу жиру в організмі in vivo за допомогою ЯМР для порівняння з вагами жирових прокладок ex vivo та вагою всього тіла після високої грудної транзакції хребта. Крім того, ми проаналізували добову норму споживання калорій хронічними тваринами з ІМС, базальну глюкозу, толерантність до глюкози, інсулін у плазмі та лептин, а також післязабійні рівні відчеплення білка-1 (UCP1) як маркера для термогенезу в коричневій жировій тканині. Ця остання міра послужила опосередкованою мірою термогенезу в обох групах тварин.
Всі процедури виконувались відповідно до керівних принципів Національного інституту охорони здоров’я та були схвалені Інституційним комітетом з догляду та використання тварин при Біомедичному дослідницькому центрі Пеннінгтона. Самки щурів Вістар (n = 16; Harlan) знаходились у приміщенні з контрольованою температурою протягом 12: 12-годинного циклу світло-темно з необмеженим доступом до їжі та води. Тварин розміщували в парі до операції, яка відбулася у віці 12 тижнів, після чого тварин поселяли поодиноко і спостерігали щодня. Одна група щурів була випадковим чином призначена для отримання трансекції спинного мозку з центром у Т2-Т3 (n = 10), а решта щурів (n = 6), які були обрані для оперативного контролю. Вагу тіла перед операцією реєстрували та тестували, щоб переконатися, що між групами не існує значної різниці у вазі.
Хірургічні процедури та догляд за тваринами.
Хронічний догляд як за підставними, так і за постраждалими тваринами застосовував процедури, описані раніше (6). Післяопераційно тварин утримували в теплому середовищі і отримували підшкірно додаткову рідину (5–10 куб.см лактатний рингер), анальгетики (карпрофен, 5 мг/кг внутрішньовенно; внутрішньовенно Pfizer Animal Health, Lititz, PA) один раз на день протягом 3 днів та антибіотики (Baytril, 2,5 мг/кг) двічі на день протягом 5 днів після операції. Вага тіла та залишкова маса чау реєструвались щоранку для всіх тварин, а експресію сечового міхура та очищення задніх кінцівок проводили щонайменше двічі на день у тварин із трансекційною ІМК до повернення спонтанного порожнечі. Вентральний отвір підставних тварин щодня оглядався без необхідності ручного стискання сечового міхура. Після повернення спонтанного порожнечі у щурів з ІМС всі тварини оглядали лише один раз на день після зважування. За необхідності тваринам вводили додаткові знеболюючі засоби, щоб мінімізувати біль та дискомфорт, а також антибіотики протягом 5 днів після ознак інфекції сечового міхура. Двох щурів, які отримали переріз спинного мозку, вилучили з дослідження після розвитку хронічного дерматиту.
Тестування на толерантність до глюкози та збір крові.
Внутрішньочеревинний тест на толерантність до глюкози (IPGTT) проводили 24-годинним голодуючим тваринам. Кожна тварина (n = 16) отримували внутрішньочеревно 2 г/кг маси тіла 5% розчину глюкози. Зразки крові (0,3 мл) відбирали з хвоста злегка стриманих тварин і аналізували за допомогою комерційного глюкометра (Therasense Freestyle, Abbott Laboratories). Зразки відбирали за 10 хв до ін'єкції глюкози (базовий рівень натощак, FB) та з інтервалом у 15 хвилин протягом 75 хв після ін'єкції. Площа під кривою тесту на толерантність до глюкози була розрахована для ІПГТТ за допомогою трапецієвого методу.
Аналіз інсуліну.
Під час забору крові в FB, через 15, 45 та 75 хв після глюкози, відбирали додаткові 100 мкл проби та зберігали на льоду в 600 мкл мікроцентрифужних пробірках. Коагульовані зразки центрифугували при 4 ° С (5 хв при 2100 g), сироватку крові збирали у свіжі пробірки для мікроцентрифуги, зберігали (−20 ° C), а потім аналізували на концентрацію інсуліну в сироватці в кожен момент часу за допомогою ІФА (набір ELISA для ультрачутливого інсуліну для щурів/мишей, Crystal Chem, Downers Grove, IL).
Аналіз складу тіла in vivo.
Пробуджених неможливих щурів поміщали в утримувальну трубку аналізатора ЯМР Bruker minispec LF90 у часовій області (Bruker Optics, Billerica, MA). Утримуюча трубка була відрегульована так, щоб звести до мінімуму рух тварини, не погіршуючи дихання. Пробірку поміщали з твариною на горизонтально орієнтовану вісь у LF90, а жирову масу, знежирену масу та рідину аналізували у трьох примірниках. Вся тривалість триразового аналізу зайняла 4 хв, після чого щура витягли з утримуючої трубки і повернули в домашню клітку.
Рейтинг локомоторів Basso, Beattie, Bresnahan.
Рухові характеристики оцінювали за допомогою локомоції на відкритому грунті, використовуючи стандартну шкалу рейтингу локомоторів Basso, Beattie, Bresnahan (BBB) (5). Тести вводили через 72 год після операції та з інтервалом один раз на тиждень протягом експерименту.
Посмертний аналіз тканини та ПЛР у реальному часі.
Тварин швидко евтаназували шляхом обезголовлення. Були видалені та зважені міжлопаткова коричнева жирова тканина (IBAT) та двосторонні заочеревинні та статеві жирові прокладки. IBAT негайно поміщали в поліетиленову пробірку для центрифуги, заморожували на сухому льоду, зберігали (-80 ° C), а пізніше аналізували на наявність мРНК UCP1 за допомогою ПЛР у режимі реального часу.
Статистичний аналіз проводили за допомогою SPSS для Windows (SPSS Inc, Chicago, IL). Дані щодо зміни маси тіла між групами та з часом аналізували за допомогою двостороннього дослідження ANOVA. Дані щодо ВВВ аналізували за допомогою одноразового повторного вимірювання ANOVA, після чого проводили пост-хок-тест Тукі. Калорійність, глюкоза в основному натщесерце, інсулін, криві толерантності до глюкози, склад тіла ЯМР, жирова подушечка, коричнева жирова тканина та експресія UCP1 аналізували т-тест. Значимість була встановлена P 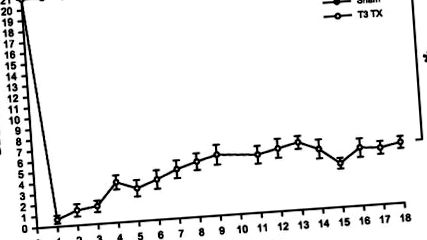
Рис. 1.Середній рейтинг локомоторних показників ВВВ ± SE щурів, випробуваних до операції (позначається як тиждень 0) через 18 тижнів після операції. Показники опорно-рухового апарату були значно нижчими у групі пошкодження спинного мозку (ІМС) (*P
ТЗМ змінює здатність підтримувати вагу тіла.
Щоденна вага тіла всіх експериментальних тварин будується в тижневих інтервалах як зміна ваги від передопераційної ваги (рис. 2). Хірургічні контрольні щури, які отримували лише ламінектомію (n = 6) відображається значне зменшення [F(18 240) = 7,546, P 0,05], а після цього залишається постійною (NS, P > 0,05). Після хірургічного втручання маса тіла тварин Т3 ТХ залишалася значно нижчою, ніж підставних тварин на час експерименту [F(1,12) = 21,026, P 0,05).
Рис.2.Зміна маси тіла після ІМВ виражається як різниця від маси пошкодження. Контрольні тварини (Шам) не втрачали вагу після операції, тоді як щури, пересічені спинним мозку (Т3 ТХ), демонстрували значне зниження ваги відразу після операції і не поверталися до передопераційної маси до 5 тижнів після операції (*P
Калорійність споживання підвищена у хронічних тварин з ІМС.
Під час тижні 16–18, коли вага тіла стабілізувався, вимірювали добову норму калорій стандартної лабораторної чау-їжі (рис. 2, затінена сірим кольором область). Наприкінці 2-тижневого періоду моніторингу сукупне споживання калорій (рис. 3A) був значно більшим у групі T3 TX (т = 2,254, df = 12, P 0,05). Середнє споживання енергії (MEI) являє собою середньодобове споживання кілокалорій на 100 г ваги тіла за кожен тиждень контрольованого годування. MEI для контрольних тварин становив 20,69 ± 1,0 ккал · день -1-100 г -1, порівняно з тваринами Т3 ТХ, який становив 30,94 ± 0,91 ккал · день -1-100 г -1 тиждень 1. Для тиждень 2, MEI становив 20,26 ± 0,90 та 29,65 ± 1,60 для контрольних та Т3 ТХ тварин відповідно. Як видно на рис. 3B, MEI тварин Т3 ТХ був значно вищим для обох тиждень 1 (т = 5,64, df = 12, P
Рис.3.Вплив хронічної травми на споживання калорій стандартної лабораторної чау (Purina # 5001). A: тварини з Т3 ТХ споживали більшу кількість калорій за ніч. Ця різниця у споживанні калорій значно відрізнялася від контрольних тварин день 14 (*P
Толерантність до глюкози та чутливість до інсуліну при хронічних ІМС.
Базальний рівень глюкози в крові вимірювався через 4 години світлового циклу через 1 тиждень до операції та після операції тижні 1 і 16 не показали значної різниці в рівні глюкози в крові між групами за будь-який момент часу (Таблиця 1, P > 0,05). Рівень глюкози в крові до хірургічного втручання протягом ІПГТТ не суттєво відрізнявся у тварин, віднесених до будь-якої хірургічної групи (дані не наведені). Через 1 тиждень після операції не було різниці між групами глюкози в крові (рис.4A) або в області під кривою (AUC) IPGTT (рис. 4C., P > 0,05). Під час тесту IPGTT, що проводився через 16 тижнів після операції, щури T3 TX демонстрували нижчий рівень глюкози в крові до 30-хвилинної точки часу, який залишався нижчим протягом решти періоду тестування (рис. 4B). Згодом AUC була значно нижчою у щурів T3 TX (т = 2,55, df = 12, P 0,05). Реакція інсуліну на IPGTT була нижчою у всі моменти часу у щурів T3 TX (рис. 5A), а AUC інсуліну протягом усього періоду відбору проб була значно нижчою (т = 3,13, df = 12, P
Рис.4.Вплив хронічного пошкодження на рівень глюкози IPGTT у сироватці крові на початковому рівні (B) безпосередньо перед ін’єкцією глюкози (2 мг/кг внутрішньовенно) і через 15-хвилинні інтервали після ін’єкції. A: протягом 1 тижня після SCI тварини з T3 TX не виявляли різниці в толерантності до глюкози порівняно з контрольними тваринами (P
Рис.5.Вплив хронічної травми на рівень інсуліну в сироватці IPGTT у тварин на 16 тижд. Після ДТЗ. A: тварини з Т3 ТХ мали нижчі показники інсуліну в сироватці порівняно з контрольними тваринами. B: інсулін у сироватці крові був значно нижчим (*P
Таблиця 1. Базальний глюкоза натощак у контрольних і спінально пересічених щурів
Значення виражаються як середні значення ± SE. Значення глюкози на базах натощак подано в міліграмах на децилітр.
Склад тіла та експресія РНК UCP1 після ДЗЗ.
Вимірювання сухої маси тканини in vivo було значно нижчим у щурів T3 TX, як вимірювали за допомогою ЯМР на завершення моніторингу споживання їжі (т = 5,54, df = 12, P 0,05). Відповідне співвідношення жирової маси до нежирної тканини ще більше знизилось у тварин Т3 ТХ порівняно з контролем (т = 4,40, df = 12, P 0,05). Нарешті, рівень експресії мРНК UCP1 у IBAT від щурів групи T3 TX (0,55 ± 0,06, означає ± SE, AU) був значно нижчим, ніж рівень хірургічного контролю (1,09 ± 0,08, означає ± SE, AU; т = 5,91, df = 12, P
Рис.6.Вплив хронічної травми на склад тіла, як визначається ЯМР in vivo, та маса тканини після забою внутрішньолопаткової коричневої жирової тканини (IBAT), білої жирової жирової тканини гонад (gWAT) або ретроперитонеальної білої жирової жирової подушки (rWAT). A: маса нежирної тканини (LM), визначена за допомогою ЯМР in vivo, значно зменшується у тварин T3 TX порівняно з підставними. B: співвідношення маси жиру до нежирної маси (FM/LM), визначене ЯМР in vivo, значно нижче у тварин при 16 тижнях після ДТЗ. C.: як післязабійні gWAT, так і rWAT були значно меншими у тварин з T3 TX, ніж у контрольних, різниця у вазі IBAT не досягла статистичної значущості (*P
У цьому дослідженні ми це демонструємо 1) хронічна низька маса тіла, як це спостерігається в підгрупі популяції ВНЗ у людини, зустрічається на моделі гризунів хронічної ІМС; 2) незважаючи на збільшення кумулятивного споживання калорій при хронічних ІМС, у постраждалих тварин зберігається низька маса тіла; 3) маса білого жирового жиру нижча при ІСН; 4) базальний рівень глюкози залишається незмінним, проте толерантність до глюкози значно підвищується у хронічних тварин з ТЗ ТЗ; 5) базальний рівень інсуліну нижчий у хронічних тварин з ТЗ ТЗ; і 6) термогенез, виміряний за допомогою РНК UCP1, був нижчим у тварин з ТНВ. Ці дані дають перші прямі докази того, що високий торакальний ІМС спровокував тривалу посттравматичну втрату маси тіла, включаючи жирову масу, що не пов'язано з гіпофагією або збільшенням симпатично опосередкованого термогенезу, але існує, незважаючи на значну гіперфагію постраждалих тварин.
Наші щотижневі дані про масу тіла демонструють, що розбіжність у вазі між щурами SCI та не-SCI продовжувала зростати протягом експерименту. Це відображало швидкість приросту у контрольних тварин, які не належали до ІСЗ, оскільки маса тіла ДЗЗ не суттєво відрізнялася від рівня попередження травми, починаючи з 5 тижнів після операції. Наші спостереження дозволяють припустити, що щури SCI захищають встановлену масу тіла. Зокрема, ми спостерігали, що щури SCI, які голодували протягом ночі для тестування базальної глюкози, поверталися до попередньої маси тіла з тією ж швидкістю, що і настільки ж голодний контроль. Таким чином, хоча щури SCI підтримували нижчу масу тіла, вони були здатні швидко компенсувати зменшене споживання енергії, накладене голодуванням. Цей ефект узгоджується з попередніми повідомленнями про те, що спричинені голодуванням втрати ваги у нервово інтактних тварин швидко відміняються після відновлення годування (26).
Докази з наших даних, що складають графік сукупного споживання калорій T3 TX та контрольних тварин протягом 2 тижнів, вказують на те, що тварини, які довго постраждали, споживали більшу кількість калорій, ніж контрольні. Попереджувальна атрофія м’язів, продемонстрована раніше (20, 24, 34, 44) і підтверджена нашими власними даними ЯМР, що поєднується зі зменшенням енерговитрат (31), передбачала б пропорційне зменшення кількості годування ad libitum; проте під час моніторингу годування ми спостерігали протилежне. Це збільшення споживання калорій було чіткіше очевидним при середньому споживанні енергії, оскільки довго травмовані тварини споживали більше калорій, незважаючи на меншу масу тіла. В окремих дослідженнях на тваринах, проведених у нашому лабораторному моніторингу гострих ІЧС щурів, споживання калорій при дозвільному вигодовуванні у щурів з трансекцією Т3 повертається до рівнів, порівнянних з хірургічними обманами протягом 1 тижня після операції. Як і у наших сучасних даних, маса тіла у цих гострих тварин з ІМС до кінця 3-тижневого періоду спостереження залишалася нижчою за травму і була на 20% нижчою за когорту хірургічних контролів (G. M. Holmes, неопубліковані спостереження).
Наші показники толерантності до глюкози та чутливості до інсуліну дозволяють припустити високоефективний вуглеводний гомеостаз, який можна було б очікувати від худих пацієнтів (18, 23). Проведений нами аналіз складу тіла in vivo за 16 тижнів після операції та післязабійних ваг гонадних та заочеревинних жирових прокладок показав, що жирова маса хронічних щурів з ІМС значно зменшилась. Коли доступні вуглеводи не відповідають енергетичним потребам, тригліцериди, що зберігаються в білій жировій тканині, перетворюються у вільні жирні кислоти, і жирова маса може швидко виснажуватися протягом періоду голодування (4). Дивно, але спостережуване нами зменшення жирової маси щурів з ІМС відбулося, незважаючи на більший кумулятивний рівень споживання калорій. У нервово інтактних тварин мобілізація ліпідів у білій жировій тканині опосередковується симпатичною іннервацією білого жиру (3), тоді як денервація білого жиру зменшує мобілізацію жиру (21, 46). Голодування збільшує як оборот норадреналіну (37), так і норадренергічну іннервацію білої жирової тканини (22). Оскільки симпатичний відтік до білого жиру, імовірно, буде зменшений після ІХС, можна було очікувати, що біла жирова тканина збільшиться в розмірі після травми, але це не було так.
Цю роботу підтримали NINDS 49177 (GMH), S. Primeaux та Лабораторія дієтичного ожиріння за підтримки NIDDK 32089 (присуджена Г.А. Брей) та Pennington Medical Foundation.
СНОПКИ
Витрати на публікацію цієї статті були частково сплачені за рахунок оплати сторінок. Тому стаття має бути позначена цим «реклама”Відповідно до 18 U.S.C. Розділ 1734 виключно для зазначення цього факту.
Автори хочуть подякувати Г. А. Брею з Лабораторії дієтичного ожиріння за коментарі щодо підготовки цього звіту та за доступ до ресурсів РТ-ПЛР у своїй лабораторії, К. Моррісону за цінні пропозиції та поради. Ми вдячні доктору Баррі Роберту, Синтії Клостер та Сіну (Френку) Хсу за технічну допомогу.
- Вплив однакової втрати ваги на склад тіла та особливості резистентності до інсуліну при ожирінні
- Вплив аурикулярного акупресури на параметри маси тіла у пацієнтів з хронічною шизофренією
- Вплив добавок CLA на масу тіла та окислення жиру - Повний текст
- Вплив пари електронних сигарет на масу тіла, споживання їжі та склад тіла - Breit -
- Дізнайтеся, як скоротити жир на тілі, не втрачаючи ваги, Майкл Гуляс Медіум