Внутрішня аеробна здатність впливає на сприйнятливість до гострого стеатозу печінки, спричиненого дієтою
Е. Метью Морріс
Кафедра 1 медицини - гастроентерології та гепатології, і
Метью Р. Джекман
6 кафедр фізіології та біофізики, медицини - ендокринології, діабету та метаболізму, Медичний факультет Університету Колорадо, Аврора, Колорадо
Джинджер К. Джонсон
6 кафедр фізіології та біофізики, медицини - ендокринології, діабету та метаболізму, Медичний факультет Університету Колорадо, Аврора, Колорадо
Цзу-Вень Лю
2 Кафедра харчування та фізіології фізичних вправ, Університет Міссурі, Колумбія, Міссурі;
Джордан Л. Лопес
6 кафедр фізіології та біофізики, медицини - ендокринології, діабету та метаболізму, Медичний факультет Університету Колорадо, Аврора, Колорадо
Моніка Л. Кірні
2 Кафедра харчування та фізіології фізичних вправ, Університет Міссурі, Колумбія, Міссурі;
Джастін А. Флетчер
2 Кафедра харчування та фізіології фізичних вправ, Університет Міссурі, Колумбія, Міссурі;
Грейс М. Е. Мірс
Кафедра 1 медицини - гастроентерології та гепатології, і
Лорен Г. Кох
4 кафедра анестезіології Мічиганського університету, Ен-Арбор, штат Мічиган;
Стівен Л. Бріттон
4 кафедра анестезіології Мічиганського університету, Ен-Арбор, штат Мічиган;
Ректор Р. Скотт
Кафедра 1 медицини - гастроентерології та гепатології, і
2 Кафедра харчування та фізіології фізичних вправ, Університет Міссурі, Колумбія, Міссурі;
3 Лікарня-служба досліджень меморіалу Гаррі С. Трумена, Колумбія, штат Міссурі;
Джамал А. Ібда
Кафедра 1 медицини - гастроентерології та гепатології, і
2 Кафедра харчування та фізіології фізичних вправ, Університет Міссурі, Колумбія, Міссурі;
3 Лікарня-служба досліджень меморіалу Гаррі С. Трумена, Колумбія, штат Міссурі;
Пол С. Маклін
5 Оздоровчий та оздоровчий центр Anschutz, Аврора, Колорадо; і
6 кафедр фізіології та біофізики, медицини - ендокринології, діабету та метаболізму, Медичний факультет Університету Колорадо, Аврора, Колорадо
Джон П. Тифол
Кафедра 1 медицини - гастроентерології та гепатології, і
2 Кафедра харчування та фізіології фізичних вправ, Університет Міссурі, Колумбія, Міссурі;
3 Лікарня-служба досліджень меморіалу Гаррі С. Трумена, Колумбія, штат Міссурі;
Анотація
низька аеробна здатність або придатність є потужним предиктором серцево-судинної та смертності від усіх причин, незалежно від інших факторів ризику, включаючи куріння, ожиріння, попередні серцево-судинні захворювання та діабет (18, 19). Важливо те, що покращення фізичної форми також суттєво збільшує виживання у осіб, які раніше були в низькій формі (19). Аеробна здатність також є незалежним предиктором розвитку метаболічного синдрому та діабету 2 типу (12, 34). Низька аеробна здатність також є потужним предиктором поширеності неалкогольної жирової хвороби печінки (НАЖХП) (2) і негативно впливає на лікування НАЖХП на основі способу життя (16). Однак механізм (и), що пов'язує низьку аеробну здатність із процесами метаболічних захворювань, залишається невідомим. Зокрема, є обмежені дані, що документують фенотипи енергетичного обміну всього організму та печінки, що існують між групами різних аеробних можливостей, і те, як ці різні фенотипи можуть модулювати сприйнятливість до НАЖХП.
МАТЕРІАЛИ І МЕТОДИ
Тварини.
Модель HCR/LCR для щурів була розроблена і охарактеризована, як описано раніше (17, 27, 39, 42). У віці 25–30 тижнів тварини поодиноко розміщувались і пристосовувались до дієти з низьким вмістом жиру (D12450B, 10% ккал жиру; Research Diets, Нью-Брансвік, Нью-Джерсі) протягом ≥7 днів до початку 3-денного лікування HFD (D12451, 45% ккал жиру; Дієти дослідження). Споживання їжі контролювали щодня протягом ≥3 днів до та під час 3-денного ВЧС. Протоколи тварин були схвалені Інституційними комітетами з догляду та використання тварин при Університеті Міссурі та Медичної школи Університету Колорадо та Підкомітетом з питань безпеки тварин у лікарні Меморіалу Гаррі С. Трумена.
Аналіз складу тіла.
Склад тіла вимірювали за допомогою МРТ за допомогою EchoMRI-900 (EchoMRI, Houston, TX). Відсоток жиру в організмі розраховували як масу жиру, поділену на вагу тварини. Нежирна маса - це величина, аналітично визначена приладом. Маса без жиру (FFM) - це різниця між масою тіла та масою жиру. Склад тіла визначали безпосередньо перед евтаназією.
Аналіз стеатозу.
Метаболічний моніторинг.
Двадцятичотиригодинний дієтичний індикатор вільних жирних кислот.
Для оцінки дієтичного окислення жирних кислот, затримки тканин і обігу харчового жиру та ліпогенезу de novo було проведено дослідження in vivo, 24 години, подвійне індикаторне дослідження, як описано раніше (15, 38). На 2-й день 3-денного HFD тварини отримували внутрішньочеревну ін’єкцію 3 H2O (200 мкл, 1 мКі/мл) за 1 год до початку темного циклу, що дозволяє врівноважити індикатор із загальною кількістю води в організмі та виміряти Включення тритію в екстрагований ліпід служить оцінкою чистого утримання вуглецю через ліпогенез de novo. Співвідношення 4: 1 олеату [1- 14 C] та [1- 14 C] пальмітату було змішано як з нежирною дієтою (LFD), так і з HFD, що призвело до специфічної активності 0,45 та 0,92 мкКі/г дієти (4,48 та 2,04 мкКі/г харчового жиру) відповідно. Позначена дієта була дана на початку останнього темного циклу. Кожні 3 год СО2 з кожної камери збирали в аликвотах по 3,0 мл суміші метанолу та гідроксиду метилбензетонію 2: 1 (№ B2156; Sigma Chemical). Потім вміст 14 C у цих зразках вимірювали за допомогою сцинтиляційного лічильника Beckman LS6500. Наприкінці 24-годинного дослідження на щурах щурам знеболювали ізофлураном та евтаназували знекровленням під час вилучення тканин.
Аналіз ліпідів у харчових продуктах.
Для визначення загального вмісту ліпіду в тканинах 14 C та 3 H включали загальну кількість ліпідів за допомогою екстракції Dole (4). Двісті міліграмів печінки та шлунково-кишкового тракту та 100 мг жирових прокладки (заочеревинної, придаткової, сальникової, брижової та пахової) гомогенізували в ізопропанол-гептан-1 N H2SO4 (40: 10: 1). Фази відокремлювали звичайним сольовим розчином, верхню фазу збирали і сушили під газом N2, і 14 C і 3 H визначали за допомогою рідинного сцинтиляційного підрахунку. 14 С на зразок переводили в міліграми харчового жиру і нормалізували до маси зразка в грамах. Загальний жировий жир і харчовий жир печінки визначали як грами харчового жиру на грам тканини, помножений на масу тканини в грамах. Загальний харчовий жир скелетної м’язової тканини визначали як грами дієтичного жиру на грам шлунково-кишкового тракту, помножений на приблизну масу скелетних м’язів для кожної щури (∼38% маси тіла) (13). Підрахунок 3 Н на зразок нормалізували до маси зразка в грамах.
Мітохондріальна ізоляція.
Мітохондрії були виділені з тканини печінки щурів, як описано раніше (25). Коротко кажучи, тканину гомогенізували (тефлон на склі) в холодному буфері ізоляції мітохондрій (220 манітолу, 70 сахарози, 10 мМ трис та 1 мМ ЕДТА, доведені до рН 7,4 за допомогою КОН) і центрифугували (1500 г, 10 хв, 4 ° В). Надосадову рідину послідовно центрифугували (8000/6000/4000 г, 10 хв, 4 ° C), гранулу ресуспендували (склянка на склі) в мітохондріальному буфері для виділення печінки після кожного центрифугування. Концентрацію білка визначали за допомогою аналізу BCA.
Виділення гепатоцитів, посів та лікування ліпідів.
Мітохондріальне дихання.
Споживання мітохондріального кисню вимірювали за допомогою електродної системи Кларка (Strathkelvin Instruments, Північний Ланаркшир, Шотландія), як було описано раніше (24). Інкубації проводили в кінцевому обсязі 0,5 мл, підтримуваному при 37 ° C, що містив (у ммоль/л) 220 манітолу, 70 сахарози, 10 KH2PO4, 5 MgCl2, 2 HEPES, 1 EGTA, 10 глюкози та 0,2% бичачої сироватки альбумін, рН 7,4. Митохондріальне дихання субстратів контролювали за таких концентрацій: 1 мМ малату, 10 мМ глутамату та 10 мМ сукцинату. Додавали мітохондрії та субстрати, і сполучену максимальну частоту дихання (стан 3) ініціювали додаванням аденозин 5′-дифосфату (АДФ; 200 мкМ). Дихання через комплекс I вимірювали за допомогою глутамату (+ малат), тоді як конвергентне дихання через комплекси I та II глутамату досліджували за допомогою додавання сукцинату. Максимальне незчеплене дихання визначали титруванням карбонілціаніду 4- (трифторметокси) фенілгідразону (1 мкМ). Споживання кисню в наномолях за хвилину нормалізувалось до мітохондріального білка в клітці респірометра.
Окислення пальмітату гомогенатом печінки та ізольованими мітохондріями.
Окислення [1- 14 C] пальмітату вимірювали у свіжих гомогенатах печінки та ізольованих мітохондріях, як описано раніше (25). Окислення жирних кислот оцінювали шляхом вимірювання вироблення 14 СО2 (повна ФАО) та [14 С] розчинних у кислоті метаболітів (АСМ) у герметичному пристрої для уловлювання при 37 ° С, що містить 200 мкМ пальмітату, [1- 14 С] пальмітату, зразок тканини та реакційний буфер [100 мМ сахарози, 10 мМ Трис · HCl, 10 мМ KPO4, 100 мМ KCl, 1 мМ, 4 MgCl2 · 6H2O, 1 мМ л-карнітину, 0,1 мМ малату, 2 мМ АТФ, 0,05 мМ CoA і 1 мМ DTT (рН 7,4)]. Для оцінки індукції повної FAO в ізольованих мітохондріях печінки у відповідні лунки додавали АДФ (2,5 мМ). Індукція ADP повного FAO в ізольованих мітохондріях була зображена як різниця між базальним повним FAO та стимульованим ADP повним FAO.
Первинне окислення жирних кислот гепатоцитів.
Швидкість окислення FFA первинними гепатоцитами визначали, як описано раніше, з незначними модифікаціями (25). Після сироваткового голодування 12-лункові планшети промивали теплим PBS і клітини інкубували з реакційним середовищем [14 C] FFA FAO при 37 ° C протягом 3 годин у трьох примірниках. Через 3 год середовище з кожної лунки відбирали, і аликвоту середовища розподіляли в герметичний уловлювач. [14 С] СО2 виганяли з аликвоти середовища додаванням хлорної кислоти і потрапляли в NaOH. NaOH збирали та аналізували за допомогою рідинного сцинтиляційного підрахунку для визначення повної кількості FAO до CO2. Підкислене середовище збирали, охолоджували та центрифугували при 16000 g (4 ° C). Аліквоту аналізували за допомогою рідинного сцинтиляційного підрахунку для визначення ASM ФАО. Клітини три рази промивали крижаним буфером Кребса-Генселейта і лізували буфером для лізису SDS. Концентрацію білка в лізаті визначали за допомогою аналізу BCA.
Статистичний аналіз.
Використання субстрату всього тіла.
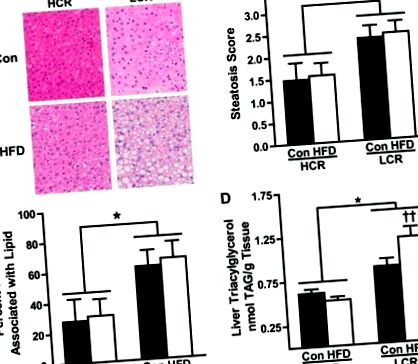
RQ та небілковий RQ (NPRQ) використовувались для оцінки використання субстрату (рис. 3, A та B). Ніяких відмінностей у RQ або NPRQ між штамами на CON не спостерігалося. Як і очікувалось, 3-денний HFD збільшив залежність від використання ліпідів (нижчий RQ) в обох групах (P Рисунок 3D підкреслює ці відмінності, показуючи зникнення субстрату як відсоток EI. Дуже мало різниці спостерігається в розподілі EI в HCR/LCR щурів на CON. Однак 3-денний HFD призводив до ∼20-кратного збільшення викиду жиру в HCR, тоді як LCR демонстрував мінімальне збільшення (Furthermore35%). Крім того, LCR, що харчувався HFD, демонстрував ∼10-кратне збільшення у відсотках ЕІ, призначених для зберігання, тоді як HCR, що харчується HFD, збільшує зберігання лише в 2,5 раза. Примітно, що підвищений стан позитивної енергії під час HFD робить можливим, що метаболічні шляхи, такі як ліпогенез, впливають на розрахунок питомого окислення макроелементів;, дані про зникнення субстрату представлені лише якісно, щоб забезпечити основу для оцінки використання макроелементів.
В рамках використання субстрату також були виявлені ключові відмінності в схемах накопичення енергії. Хоча ми спостерігали збільшення накопичення енергії як у щурів HCR, так і у LCR під час переходу на 3-денний HFD, розрахункова швидкість зберігання в LCR була вдвічі вищою, ніж у HCR. Це підтверджується ще більшим збільшенням ваги за 3 дні та збільшенням відсотка жиру в організмі в LCR порівняно з HCR після виклику HFD. Крім того, хоча не було різниці в кількості харчових ліпідів, що утримуються в печінці, у щурів LCR спостерігалося значне збільшення зберігання ліпідів в їжі в метаболічно неактивних жирових прокладках. Це суперечить спостережуваному зберіганню харчових ліпідів у сильно окислювальних скелетних м’язах у щурів HCR. Ці протилежні дієтичні способи обігу ліпідів відповідають спостережуваним відмінностям у окисленні жирних кислот у всьому організмі та раніше виділеним різницям у метаболічній ефективності, пов’язаних з різними аеробними можливостями. Підсумовуючи, ці дані підкреслюють, що відмінності у власній аеробній здатності суттєво впливають на схеми накопичення енергії після переходу від НЧ до ВЧД, фактори, що відслідковують різницю у сприйнятливості до стеатозу.
Підводячи підсумок, ми демонструємо, що знижена аеробна здатність в LCR призводить до підвищеної сприйнятливості до посиленого стеатозу після гострого ВЧС, ефекту, пов’язаного з більшим збільшенням споживання енергії, зменшенням РЕЕ з урахуванням ваги, збільшенням енергетичного балансу, різкою нездатністю адаптуватися до утилізація ліпідів на рівні всього тіла та печінки, а також збільшення зберігання харчового жиру в жировій тканині. На відміну від цього, щури HCR із внутрішньо підвищеною аеробною здатністю захищені від HFD-індукованого стеатозу, захист, який пов’язаний із збільшенням відносних витрат енергії та використанням жиру як in vivo, так і в печінці. Що цікаво, подібний захищений метаболічний фенотип спостерігався у людей, стійких до розвитку ожиріння (8), головного коваріанту НАЖХП. На закінчення ці результати підкреслюють складну взаємодію між внутрішньою аеробною здатністю та енергетичним метаболізмом всього тіла та печінки та їх вплив на сприйнятливість до НАЖХП.
ГРАНТИ
Цю роботу частково підтримали гранти Національного інституту охорони здоров’я (NIH) DK-088940; (J. P. Thyfault), 5-T32-AR-48523-8; (E. M. Morris) та DK-038088 (P. S. MacLean) та Veteran Affairs (VA) Grant VA-CD2 BX001299 (R. S. Rector). Підтримку цій роботі також надав Лабораторія енергетичного балансу в Колорадо, Центр досліджень ожиріння з питань харчування (DK-48520). Модель LCR-HCR на щурах фінансувалася Управлінням програм дослідницької інфраструктури/OD Grant ROD012098A від NIH (L. G. Koch та S. L. Britton) та NIH Grants RO1-DK-077200; та R01-GM-104194 (S. L. Britton). Ця робота була підтримана ресурсами та використанням приміщень у лікарні Гаррі С. Трумена, Меморіал, штат Колумбія, Міссурі.
РОЗКРИТТЯ
Автори не мають конфлікту інтересів, фінансового чи іншого, щоб розкрити для цього дослідження.
- Печінкова генна терапія врятовує відповіді на дієти з високим вмістом жиру у мутантних мишей добового годинника - ScienceDirect
- Кефірні пептиди полегшують атеросклероз, спричинений дієтою, з високим вмістом жиру - Блог Healthspan - TruDiagnostic
- Втрата нирково-канальцевого PGC-1α посилює індукований дієтою нирковий стеатоз та віковий сечовий процес
- Печінковий стеатоз, споживання вуглеводів та харчовий коефіцієнт у пацієнтів з НАЖХП
- Низька властивість бігу пов'язана зі зменшенням окислення субстрату скелетних м'язів і