Візуалізаційний фіброгенез у дієтичній моделі неалкогольного стеатогепатиту (NASH)
С. В. Хартімат
1 Сінгапурський консорціум біовізуалізації, Агентство з наукових технологій та досліджень (A ∗ STAR), 11 Biopolis Way, # 01-02 Helios, Сінгапур 138667, Сінгапур
Р. Бумінатан
1 Сінгапурський консорціум біовізуалізації, Агентство з наукових технологій та досліджень (A ∗ STAR), 11 Biopolis Way, # 01-02 Helios, Сінгапур 138667, Сінгапур
В. Сох
1 Сінгапурський консорціум біовізуалізації, Агентство з наукових технологій та досліджень (A ∗ STAR), 11 Biopolis Way, # 01-02 Helios, Сінгапур 138667, Сінгапур
П. Ченг
1 Сінгапурський консорціум біовізуалізації, Агентство з наукових технологій та досліджень (A ∗ STAR), 11 Biopolis Way, # 01-02 Helios, Сінгапур 138667, Сінгапур
X. Денг
1 Сінгапурський консорціум біовізуалізації, Агентство з наукових технологій та досліджень (A ∗ STAR), 11 Biopolis Way, # 01-02 Helios, Сінгапур 138667, Сінгапур
Ю. С. Чонг
1 Сінгапурський консорціум біовізуалізації, Агентство з наукових технологій та досліджень (A ∗ STAR), 11 Biopolis Way, # 01-02 Helios, Сінгапур 138667, Сінгапур
Ф. Ф. Йонг
1 Сінгапурський консорціум біовізуалізації, Агентство з наукових технологій та досліджень (A ∗ STAR), 11 Biopolis Way, # 01-02 Helios, Сінгапур 138667, Сінгапур
П. В. Тан
1 Сінгапурський консорціум біовізуалізації, Агентство з наукових технологій та досліджень (A ∗ STAR), 11 Biopolis Way, # 01-02 Helios, Сінгапур 138667, Сінгапур
В. Хань
1 Сінгапурський консорціум біовізуалізації, Агентство з наукових технологій та досліджень (A ∗ STAR), 11 Biopolis Way, # 01-02 Helios, Сінгапур 138667, Сінгапур
Е. Г. Робінс
1 Сінгапурський консорціум біовізуалізації, Агентство з наукових технологій та досліджень (A ∗ STAR), 11 Biopolis Way, # 01-02 Helios, Сінгапур 138667, Сінгапур
2 Дослідницький центр клінічної візуалізації (A * STAR – NUS), Медичний факультет Йонг Лоо Лін, Національний університет Сінгапуру, Сінгапур 117599, Сінгапур
Дж. Л. Годжі
1 Сінгапурський консорціум біовізуалізації, Агентство з наукових технологій та досліджень (A ∗ STAR), 11 Biopolis Way, # 01-02 Helios, Сінгапур 138667, Сінгапур
Пов’язані дані
Набори даних, використані та/або проаналізовані під час поточного дослідження, доступні у відповідного автора на обґрунтований запит.
Анотація
Призначення
Фіброз печінки є ознакою хронічного неалкогольного стеатогепатиту (НАСГ) і характеризується надмірним відкладенням білків позаклітинного матриксу. Раннє виявлення та точна постановка фіброзу печінки є критично важливими для ведення пацієнта. Одним з найбільш ранніх патологічних маркерів у NASH є активація зірчастих клітин печінки (HSC), які можуть бути використані як маркер фіброгенезу. Активовані фактори секреції HSC, такі як інтегрин αvβ3, поширюють фіброз. Метою поточного дослідження було оцінити корисність агента візуалізації інтегрину αvβ3 [18 F] FtRGD для раннього виявлення фіброзу на дієтичній моделі NASH, поздовжньо використовуючи ПЕТ-візуалізацію.
Процедури
Мишей годували або стандартною дієтою чау (SD), дієтою з високим вмістом жиру (HFD), або дефіцитом холіну, L-амінокислотою, з високим вмістом жиру, фіброгенною дієтою (CDAHFD) для імітації клінічної патології захворювань печінки і дотримання поздовжньо протягом 10 тижнів для оцінки розвитку фіброзу печінки за допомогою візуалізації [18 F] позитронно-емісійної томографії FTRGD (ПЕТ). Для кількісної оцінки інтегрину αvβ3, актину гладкої мускулатури та колагену 1 і 6 типів використовували стандартну біохімію крові, гістологічні вимірювання та qPCR для оцінки ступеня патології NASH та точної стадії фіброзу печінки.
Результати
Фіброгенна дієта CDAHFD, як передбачалося, розвинула запалення печінки та стеатоз протягом 10 тижнів, вивчених з незначною патологією NASH, виявленою у тварин, які отримували дієту з високим вмістом жиру. Фіброз 1 стадії був виявлений на початку гістологією на 21 день і просунувся до 2 стадії до 35 дня та 3 стадії до 56 дня у мишей, які отримували лише дієту CDAHFD. Неінвазивна візуалізація з [18 F] FtRGD добре корелювала з інтегрином αvβ3 і змогла розрізнити ранній легкий фіброз 2-ї стадії у тварин CDAHFD порівняно зі стандартними тваринами, що годувались дієтою, на 35-й день. У порівнянні з тваринами, що харчувалися дієтою, [18 F] FtRGD вдалося розрізнити пізніше помірний фіброз 2 стадії у тварин CDAHFD на 49 день.
Висновки
Індукований дієтою прогресування фіброзу печінки було підтверджено за допомогою гістології та добре корелювало з мРНК інтегрину αvβ3 та експресією білка позаклітинного матриксу. [18 F] FtRGD продемонстрував дуже хорошу кореляцію між поглинанням печінки та експресією αvβ3 інтегрину та подібною чутливістю виявлення до сучасних клінічних стандартів золота для стадії фіброзу печінки.
1. Вступ
Зв’язуючі речовини αvβ3 інтегрину (125 I та 99m мічений Tc cRGD) раніше використовувались для виявлення фіброзу печінки на хімічно індукованих моделях тварин [5–11]. Однак хімічно індуковані моделі NASH дуже швидко розвивають фіброз і не повторюють клінічного прогресування захворювання. Крім того, ці моделі серйозно пошкоджують гепатоцити, паренхіму печінки та клітини Купфера протягом декількох днів. При патології NASH запалення відбувається набагато повільніше, а HSC активуються на дуже ранній стадії фіброзу. У цьому дослідженні ми досліджували взаємозв'язок між поглинанням [18 F] FtRGD печінкою, селективним зондом інтегрину αvβ3 та розвитком фіброзу за допомогою ПЕТ-візуалізації в індукованій дієтою моделі NASH, низькому вмісті метіоніну та дефіциту холіну дієта з високим вмістом жиру (CDAHFD). Дієта CDAHFD більш достовірно відтворює клінічну патологію від неушкодженої паренхіми до стеатозу та НАСГ, де печінковий стрес, спричинений потоком жирних кислот з жирової тканини до печінки, а також підвищене зберігання тригліцеридів призводить до фіброзу та дисфункції печінки [12–14].
2. Матеріали та методи
2.1. Тварини та дієта
Самці мишей C57/BL6 були придбані у InVivos (Сінгапур). Мишей C57/BL6 було обрано в якості штаму гризунів, оскільки було показано, що вони розвивають патологію печінки за обраною дієтою. Мишей годували або стандартною дієтою чау (n = 5), дієтою з високим вмістом жиру (HFD), очищеною від гризунів дієтою з/60% енергії від жиру (HFD: 58Y1, n = 5) або високожировою фіброгенною дієтою (AA визначається дієта з високим вмістом жиру без вмісту холіну та 0,1% метіоніну; CDAHFD із 60% енергії з жиру; 9 ГКВ було придбано у Test Diet, Річмонд, Індіана, США, (n = 5) протягом десяти тижнів.
2.2. Біохімічні аналізи та гістопатологічна оцінка
За всіма тваринами проводили моніторинг і вимірювали масу тіла двічі на тиждень. Кров відбирали з орбітального сплетення та відокремлювали плазму (200 мкл) для аналізу тригліцеридів (TG) (ab65336, Abcam). Тварин приносили в жертву, а печінку збирали на 21, 28, 42, 56 та 70 дні лікування CDAHFD та HFD. Печінку зважували і частину швидко заморожували для аналізу гідроксипроліну (ab222941, Abcam) або кількісного визначення мРНК. Інші тканини печінки фіксували у 10% нейтральному забуференному формаліні для гістологічного дослідження.
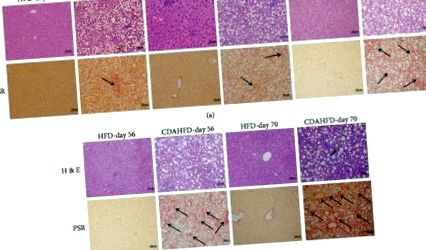
Тканини, закріплені формаліном, розрізали (4 мкм) і фарбували Picro Sirius Red (PSR) або гематоксилін-еозином (H&E). Зразки печінки мікроскопічно оцінювали на наявність запальних клітин, гепатоцелюлярне балонування, зміни жиру (стеатоз), фіброз та інші ураження відповідно до класифікаційної практики, описаної раніше [12]. Патологічна оцінка для різних стадій фіброзу базується на тяжкості та класифікується наступним чином: для запальної інфільтрації клітин, ступінь 0: немає; ступінь 1: 1-2 вогнища; ступінь 2: 3-4 вогнища; і ступінь 3: більше 4 вогнищ, що спостерігаються при 200x. Для гепатоцелюлярного балонування та дегенерації, ступінь 0: відсутність; ступінь 1: мало повітряних кульок; і ступінь 2: клітини/помітні повітряні кулі. При жирових змінах (стеатоз), ступінь 0, відсутність стеатозу; 1 ступінь, 70% уражених гепатоцитів. Для фіброзу печінки (на основі фарбування PSR), стадія 0: відсутність; стадія 1: легка, перисинусоїдальна або перипортальна; 2 стадія: помірна, перисинусоїдальна та перипортальна; стадія 3: мостовидний фіброз; і стадія 4: цироз.
2.3. Отримання [18 F] FtRGD
Всі комерційні хімікати та розчинники, отримані комерційно, були аналітичного класу та використовувались безпосередньо без подальшого очищення. [18 F] FtRGD готували як реакцію з двома горщиками, як описано раніше [15], на основі модифікованого методу Бежо та співавт. [16]. Коротко, азеотропний висушений [18 F] фторид реагував з 2-азидоетил-4-толуолсульфонатом (2 мкл) у сухому ацетонітрилі (0,5 мл), отримуючи 2- [18 F] фтороетил азиду ([18 F] FEA) [17 ]. Кон'югація 2- [18 F] фтороетилазиду з функціонованим алкіном c (RGDyK) пептидом через Cu (I) -каталізований диполярний циклоприєднання Huisgen 1, -3. Після реакції [18 F] FtRGD очищали за допомогою напівпрепаративної ВЕРХ з наступною екстракцією легкого картриджа з твердофазним C18 і переформулювали у фосфатному сольовому розчині (pH = 7,4). Індикатор стерилізували, пропускаючи через 0,22 мкм фільтр Millex GV перед використанням на тваринах. Радіохімічна чистота> 98%.
2.4. Зображення ПЕТ
Всім тваринам (n = 5 на групу) знімали поздовжньо від 3 до 10 тижнів після початку режиму дієти. Тваринам вводили розчин [18 F] FtRGD (~ 10 МБк в 0,2 мл) через бічну хвостову вену. Через 60 хв після ін’єкції тварин знімали за допомогою ПЕТ-КТ Siemens Inveon (Сіменс, Німеччина) із статикою 10 хв із подальшим стандартним протоколом сканування КТ, як описано раніше [16]. Дані ПЕТ отримували в режимі списку, а зображення генерували з даних синограм, з подальшою тривимірною реконструкцією максимізації очікуваних підмножин (OSEM-3D) та корекцією затухання за допомогою КТ. Зображення ПЕТ та КТ були зареєстровані для підтвердження анатомічного розташування, а поглинання радіофармацевтичних препаратів було визначено шляхом нанесення області інтересу (ROI) над печінкою, окресленої за допомогою КТ зображень. Концентрації тканин вимірювали за допомогою аналізу ROI в програмному забезпеченні Amide (Sourceforge 10.3, http://amide.sourceforge.net), і поглинання індикатора представляється як процентна зміна поглинання печінки.
2.5. Імуногістохімічний аналіз
Зразки печінки швидко заморожували у рідкому азоті та розподіляли за допомогою кріотоми (зрізи 5 мкм) для імуногістохімічних досліджень. Зрізи замочували в метанолі, що містить 0,3% H2O2, протягом 30 хв при кімнатній температурі для фіксації та блокування активності ендогенної пероксидази, а потім промивали PBS. Після блокування козячої сироватки/H2O2 тканини інкубували з первинним антитілом при кімнатній температурі протягом 30 хвилин (кроляча поліклональна антиальфа SMA Abcam, ab15734; при розведенні 1: 200). Потім зрізи обробляли для кон’югованого з HRP вторинного антитіла відповідно до протоколу виробника полімеру (30 мл) Antirabbit Poly-HRP-IgG (75%).
2.6. Аналіз експресії генів за допомогою qPCR
Тканину печінки швидко заморожували та обробляли для екстракції печінкової РНК та подальшого аналізу qPCR, як описано раніше [18]. TRIzol (Thermo Fisher Scientific) екстрагував загальну РНК, і кДНК ампліфікували, використовуючи зазначені праймери, за 40 циклів ПЛР. Рівень експресії мРНК інтегрину αVβ3, колагену типу 1 та 6 альфа-1 визначали кількісно за допомогою qPCR. Для оцінки відносної експресії мРНК використовували метод 2 -ΔΔCT, який нормалізували до 18S мРНК (як ген ведення домашнього господарства). Послідовності праймерів, що використовуються для qPCR, є такими: Col1a1: 5′-GCTCCTCTTAGGGGCCACT-3 ′ і 5′-CCACGTCTCACCATTGGGG-3 ′. Col6a1: 5′-CTGCTGCTACAAGCCTGCT-3 ′ та 5′-CCCCATAAGGTTTCAGCCTCA-3 ′. Інтегрін αVβ3: 5′-CCGTGGACTTCTTCGAGCC-3 ′ та 5′-CTGTTGAATCAAACTCAATGGGC-3 ′. 18S: 5′-CGTGATTAGCGATGATGAACCAGG-3 ′ і 5′-CATCTCGAGCAA-GTCTTTCAGTCC-3 ′.
2.7. Статистичний аналіз
Печінку CDAHFD або HFD мікроскопічно оцінювали на наявність гістологічної наявності гепатоцелюлярного запалення, змін жиру (стеатоз), балонізації та фіброзу. Годувані CDAHFD миші продемонстрували чітке прогресування НАСГ з 21-го дня з мікро- та макровезикулярними змінами жиру, що спостерігалися з 21-го дня, яке неухильно прогресувало до 70-го дня. Печінковий балон 1 ступеня спостерігався з 21 по 56 день, а надуття повітря 2 ступеня з 56-го дня до кінець дослідження. Ці зміни супроводжувались запальними вогнищами 1 ступеня з 21 дня та 2 ступеня з 35 дня. Фіброз був виявлений на ранніх стадіях у тварин CDAHFD із стадією 1 на 21 день, що переходить у стадію 2 до 35 дня та 3 ступеня з 56 дня і далі. На противагу цьому, у мишей, що годували HFD, у пізніші моменти часу розвивалися певні стеатози та вогнища запалення, але фіброз не розвивався протягом досліджуваного курсу (рис. 1).
Печінкова гістопатологія мишей, яких годували CDAHFD або HFD з 21 по 70 день: (a) фарбування H&E та (b) фарбування Picro Sirius Red (PSR). Всі зображення представлені в 200x.
- Порівняльне порівняння неорганічного нітрату та метформіну на мишачій моделі кардіометаболічного
- Втрата ACE2 перебільшує висококалорійну інсулінорезистентність, спричинену дієтою, за рахунок зменшення GLUT4 у мишей
- Незалежний ефект високої аеробної здатності захищати від інсулінорезистентності, спричиненої дієтою, в
- Користь для здоров'я дієтичної олії насіння дерев півонії у дієті з високим вмістом жиру Хом'як Чжен Функціонал
- Інфлюенсер, звинувачений у фатфобії за те, що він назвав модель огидний; Інсайдер