Визначення протизапальних олігосахаридів, отриманих з галактозаміногалактану (GAG) із Aspergillus fumigatus
Маркус ressресслер
1 Unité des Aspergillus, Інститут Пастера, Париж, Франція
Крістоф Геддерготт
1 Unité des Aspergillus, Інститут Пастера, Париж, Франція
Інес С. Н'Го
1 Unité des Aspergillus, Інститут Пастера, Париж, Франція
Джорджія Ренга
2 Кафедра експериментальної медицини, Університет дельї Студі ді Перуджа, Перуджа, Італія
Василіс Ойконому
2 Кафедра експериментальної медицини, Університет дельї Студі ді Перуджа, Перуджа, Італія
Сільвія Моретті
2 Кафедра експериментальної медицини, Університет дельї Студі ді Перуджа, Перуджа, Італія
Бернадетт Коддевіль
3 Unité de Glycobiologie Structurale et Fonctionnelle (UGSF) UMR 8576 CNRS, Університет Лілля, Лілль, Франція
Йоана Гайфем
4 Науково-дослідний інститут наук про життя та здоров'я (ICVS), Медичний факультет, Університет Міньйо, Брага, Португалія
5 ICVS/3B's-PT Урядова асоційована лабораторія, Брага, Португалія
Рікардо Сільвестр
4 Науково-дослідний інститут наук про життя та здоров'я (ICVS), Медичний факультет, Університет Міньйо, Брага, Португалія
5 ICVS/3B's-PT Урядова асоційована лабораторія, Брага, Португалія
Луїджина Романі
2 Кафедра експериментальної медицини, Університет дельї Студі ді Перуджа, Перуджа, Італія
Жан-Поль Латге
1 Unité des Aspergillus, Інститут Пастера, Париж, Франція
Тьєррі Фонтен
1 Unité des Aspergillus, Інститут Пастера, Париж, Франція
Пов’язані дані
Усі набори даних, створені для цього дослідження, включені до статті/Додаткового матеріалу.
Анотація
Галактозаміногалактан (GAG) - це нерозчинний аміноцукровий полімер, вироблений Aspergillus fumigatus і має протизапальні властивості. Тут досліджували мінімальні глікозидні послідовності, необхідні для індукції IL-1Ra мононуклеарними клітинами периферичної крові (РВМС). Використовуючи хімічну деградацію природного GAG для виділення розчинних олігомерів, ми виявили, що де-N-ацетилювання залишків галактозаміну та розмір олігомеру є критичними для імунної відповіді in vitro. Для протизапальної відповіді необхідний мінімальний розмір олігомеру 20 залишків галактозаміну, але наявність залишків галактози не є необхідним. У моделі миші, викликаної колітом, викликаною сульфатом декстрану, частка де-N-ацетильованих олігомерів з 13 ключових слів: галактозаміногалактан, Aspergillus fumigatus, IL-Ra, протизапальна реакція, глікопрепарат
Вступ
Хімічна модифікація полісахаридів
Де-N-ацетилювання полісахаридів
GAG суспендували в 3 мл 10 мМ HCl при кінцевій концентрації 3,33 мг/мл ультразвуком у пластикових пробірках. Де-N-ацетилювання починали додаванням 3,4 мл 18,8 М NaOH і суміш інкубували при 100 ° C протягом 4–5 годин. Трубки вихровували щогодини. Реакцію зупиняли на льоду і нейтралізацію 12 М HCl. Суміш буферизували за допомогою 20 мМ трис, рН 7. Де-N-ацетильовані ГАГ (dGAG) діалізували проти водопровідної води та двічі проти dH20 (24 години кожен) і, нарешті, ліофілізували насухо і зберігали при температурі навколишнього середовища.
Ацетилювання олігосахаридів
Процедура ацетилювання, описана Lavertu et al. (2012) був модифікований наступним чином: 0,5 мг олігосахаридів dGAG (F-I та F-III) ліофілізували насухо і розчиняли у 25 мкл 400 мМ оцтової кислоти та 100 мкл CH3OH. Суміш попередньо інкубували протягом 1 год при температурі навколишнього середовища при перемішуванні при 300 об/хв. Ацетилювання ініціювали додаванням 3 мкл ангідриду оцтової кислоти. Через 1 год інкубації розчинники випарювали в ексикаторі протягом ночі. Зразки знесолювали шляхом багаторазового розчинення 500 мкл води (4 рази) з подальшим випаровуванням насухо. Зразки розчиняли у 500 мкл води і, нарешті, зберігали при -20 ° C.
Виробництво олігосахаридів GAG
Аналітичні процедури
Аналіз MBTH
Де-N-ацетильовані вісіміни були виявлені та визначені кількісно за допомогою аналізу MBTH (Plassard et al., 1982). Процедуру проводили в 96-лунковому планшеті (Сарштедт): 40 мкл зразка (що містив до 200 мкг вісім омін/мл) змішували з 40 мкл 5% KHSO4 (Sigma Aldrich). Зразки зменшували додаванням 40 мкл 5% NaNO2 (Sigma Aldrich) протягом 60 хв при 50 ° C, в результаті чого 40 мкл 5% NaCl використовували як негативний контроль. Після нейтралізації 40 мкл 12,5% NH4SO2NH2 (Sigma Aldrich) (температура навколишнього середовища, 30 об/хв, 10 хв) додавали 40 мкл 0,5% 3-метил-2-бензотіазолінон гідразидгідрату гідрату (Sigma Aldrich). Покриту пластину інкубували при 37 ° С протягом 30 хв. Нарешті, додавали 40 мкл 0,5% FeCl3 і поглинання при λ = 650 нм вимірювали за допомогою зчитувача пластин Tecan M200Pro ELISA, тоді як λ = 800 нм служив еталонною довжиною хвилі. Калібрувальною кривою послідовного розведення d -галактозаміну (GalN) служила еталоном. Для кількісної оцінки загальної кількості осіміну або ступеня ацетилювання (DA) перед аналізом MBTH проводили стадію гідролізу. Зразки повністю гідролізували 4 М HCl при 100 ° С протягом 4 год і згодом сушили протягом ночі в ексикаторі.
Ацетатна проба
DA також оцінювали за допомогою ферментативного ацетатного аналізу. Зразки (220 мкл) повністю гідролізували додаванням 100 мкл 12 М HCl (100 ° С, 4 год). Потім 100 мкл використовували для виявлення осеміну методом аналізу MBTH, як описано вище, і ще 100 мкл використовували для аналізу ацетату. Після нейтралізації додаванням 75 мкл 7 М NaOH та 75 мкл 2 М MOPS (рН 7,5) зразки піддавали ацетатному колориметричному аналізу (Sigma-Aldrich) згідно з протоколом виробника. Поглинання при λ = 450 нм вимірювали за допомогою зчитувача пластин ELISA від Tecan нескінченного M200Pro, тоді як λ = 700 нм служив еталонною довжиною хвилі. Вміст ацетату в гідролізованих зразках визначали калібрувальною кривою 0,25–1,5 мМ стандартного розчину ацетату.
Ідентифікація та кількісне визначення моносахаридів за допомогою газової хроматографії
Зразки (100 мкг) гідролізували в 500 мкл 8 М HCl для аналізу на гексозамін або 4 М TFA для аналізу на гексозу. Мезоінозитол (4 мкг) використовували як внутрішній стандарт, а 50 мкг Gal, GalNAc та GlcNAc як зовнішні стандарти. Після гідролізу зразки BH4Na та ацетилювання аналізували методом ГХ на приладі Perichrom PR2100 з полум'яно-іонізаційним детектором з використанням капілярної колонки (30 м × 0,32 мм), заповненої DB-1 (SGE), як описано раніше (Fontaine et al ., 2011).
Ферментативна деградація фракцій GAG
Виробництво рекомбінантної ендо-α-1,4-галактозамінідази
Для ферментативної деградації GAG використовується полі-GalN гідролаза Pseudomonas sp. (Tamura та співавт., 1988), названа тут GAGnase, була вироблена в кишковій паличці. До загального синтезу гена послідовність ДНК була оптимізована для кодону для експресії в E. coli. Крім того, до карбоксильного кінця додали мітку гістидину для полегшення подальшого очищення (рис. S2). Ген клонували у вектор експресії pET28a (+) і трансформували у штам експресії E.coli BL21 Gold. Культуру у фазі експоненціального росту індукували 1 мМ IPTG (кінцева концентрація) з подальшим продукуванням протягом 4 год при 30 ° C. Білок міг знаходитись у супернатанті культури (він містить сигнал бактеріальної секреції), цитоплазмі та в органах включення. Фермент, присутній у супернатанті, очищали за допомогою нікелевих агарозних кульки ProBond ™ (ThermoFisher) (співвідношення 0,5 мл кульки/50 мл супернатанту) (рис. S2). Остаточний препарат витримували в 20 мМ буфері HEPES, рН 7,4, 137 мМ NaCl і зберігали в аликвотах при -20 ° C.
Ферментативна деградація олігосахаридів
Ферментативний гідроліз GAG проводили, як описано раніше (Tamura et al., 1992). Коротше кажучи, 5 мг/мл GAG/dGAG або 1 мг/мл GAG олігосахаридів розчиняли в 50 мМ NaAc, рН 6,0. Реакцію (шкала 100 мкл) розпочинали додаванням 2 мкг/мл GAGнази та інкубували протягом 2 год при 37 ° С. GAGnase швидко інактивували теплом (100 ° C, 5 хв), а ефективність розкладу оцінювали за допомогою аналізу кінця цукру, використовуючи PABA як реагент (Lever, 1972).
Масова спектрометрія MALDI-TOF
Спектри MALDI-TOF аналізували в позитивному режимі рефлекрону за допомогою спектрометра 4800 TOF/TOF (Applied Biosystems, Фремінгем, Массачусетс, США), оснащеного імпульсним азотним лазером (337 нм і частотою 200 Гц). Для збору даних MS використовували в середньому 5000 знімків на місце. Зразки готували шляхом змішування безпосередньо на мішені 0,5 мкл розчину олігосахариду у воді (10–50 пмоль) з 0,5 мкл розчину матриці 2,5-дигідроксибензойної кислоти (10 мг/мл у CH3OH/H2O, 50:50, V/V). Зразки сушили при кімнатній температурі.
Виділення мононуклеарних клітин периферичної крові (PBMC)
Зразки крові у здорових донорів були отримані в Etablissement Français du Sang Saint-Louis (Париж, Франція) за письмовою інформованою згодою згідно з рекомендаціями Інституційного комітету з етики Інституту Пастера (конвенція 12/EFS/023). Зразок крові людини у здорових пацієнтів розводили 1: 1 PBS (Gibco). У 50 мл соколиної пробірки 15 мл середовища для поділу лімфоцитів (Eurobio) повільно накладали на 30 мл розведення крові. Клітини відокремлювали центрифугуванням при температурі навколишнього середовища (20 хв, 1800 об/хв). Верхню фазу (буфер і плазма) відкидали і збирали PBMC (2–5 мл). Клітини промивали додаванням 40 мл PBS і подальшим центрифугуванням при температурі навколишнього середовища (10 хв, 1500 об/хв). Повторювали етап промивання (30 мл PBS; 10 хв, 1200 об/хв). Нарешті клітини суспендували у 10–20 мл RPMI 1640 + Глутамакс-I (Gibco) і підраховували в гемоцитометрі (c-Chip DHC-M01; Digital Bio). Нарешті клітини розбавляли до концентрації 1 × 10 7 клітин/мл у RPMI і зберігали на льоду.
Виявлення продукування інтерлейкіну в PBMC за допомогою імуноферментного аналізу (ІФА)
Виявлення цитотоксичності аналізом лактатдегідрогенази (ЛДГ)
Путативна цитотоксичність GAG та олігосахариду GAG оцінювали як вивільнення LDH з PBMC. PMBC висівали в кінцевій концентрації 5 × 10 5 клітин у 200 мкл RPMI 1640 + Glutamax-I з добавкою 10% сироватки людини в U-подібну пластину з 96 лунками. GAG та олігосахариди випробовували у кінцевій концентрації 1,0 та 5,0 мкг/мл (кількість згідно з аналізом MBTH гідролізованих зразків). Ліпополісахариди (LPS) з кишкової палички (10 нг/мл; SIGMA) служили негативним контролем. Повністю лізовані клітини TritonX100 слугували позитивним контролем і еталоном. Усі супернатанти розводили у співвідношенні 1: 5 у PBS + 1% BSA (позитивний контроль 1:20), а аналіз LDH проводили за допомогою набору для виявлення цитотоксичності LDH (Roche) згідно з протоколом виробника. Жоден з цих олігосахаридів не був токсичним для РВМС (рис. S3), показуючи, що секреція IL-1Ra не була пов’язана з апоптозом або некрозом клітин.
Застосування GAG та Oligo-GAG у мишей, оброблених DSS
Статистичний аналіз
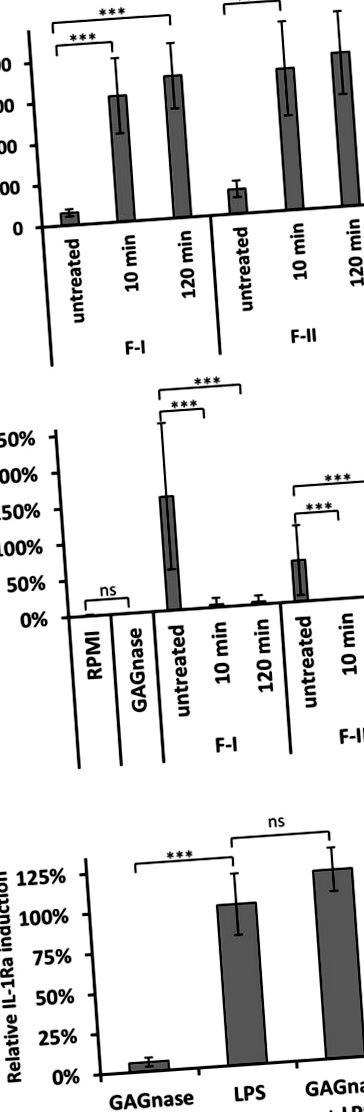
Всі експерименти проводили принаймні з п’ятьма різними партіями GAG та олігосахаридів та мінімум з чотирма донорами крові. Вся статистика експериментів in vitro проводилась за допомогою двостороннього непарного тесту Уілкоксона – Манна – Уїтні за допомогою безкоштовного програмного забезпечення EDISON-WMW (Marx et al., 2016). Статистичний аналіз експериментів in vivo (Малюнок 5) виконувались з одно- або двостороннім ANOVA. Дані одного експерименту з використанням 10 мишей/групи виражали як середнє значення ± SD та аналізували у трьох примірниках із використанням програмного забезпечення GraphPad Prism. Значення P позначені зірочкою наступним чином: * p ** p *** p 20) З GAG Індукувати IL-1Ra на PBMC
Знижений ступінь тяжкості коліту DSS у мишей C57BL/6, які отримували модифіковані молекули GAG. DSS або водний транспортний засіб вводили за бажанням у питну воду протягом 7 днів. Нативний полімер GAG та олігомери GAG у дозі 1 мг/кг вводили внутрішньочеревно протягом 7 днів поспіль після лікування DSS. (A) Виживання, вага (грами) та індекс клінічної активності захворювання. (B) Макроскопічне зображення товстої кишки. (C) Гістологічна оцінка тяжкості коліту (20-кратне збільшення, бар = 200 мкм). (D) Рівні цитокінів товстої кишки. Дані виражаються як середнє значення ± SD. * P Малюнок 5, два олігомери GAG спостерігали два профілі порятунку коліту. Де-N-ацетильовані олігомери (середнє значення dp 16 або більше) врятували мишей, оброблених DSS, зі значним зменшенням інфільтрації запальних клітин, потовщенням м’язів та покращенням структури товстої кишки. Цей ефект супутній індукції секреції IL-1Ra, що також спостерігається in vitro. На противагу цьому, нерозчинні ацетильовані олігомери dp> 26 врятували мишей, оброблених DSS, в незалежному від IL-1Ra режимі дії. Таким чином, розчинні у воді полігалактозамінові олігосахариди є перспективними кандидатами для альтернативного лікування ІЛ-1Ra-залежних захворювань.
Обговорення
Заява про доступність даних
Усі набори даних, створені для цього дослідження, включені до статті/Додаткового матеріалу.
Заява про етику
Дослідження на тваринах було розглянуто та схвалено італійською службою захисту тварин 360/2015-PR та законодавчим рівнем 26/2014.
Внески автора
MG, CH, RS, LR, J-PL та TF задумали та спроектували експерименти. MG, CH, IN'G, GR, VO, SM, BC, JG і TF проводили експерименти. MG, CH, BC, RS, LR, JP-L та TF аналізували дані. MG, CH, GR, VO, SM, BC, JG, RS, LR, J-PL та TF внесли реагенти, матеріали та інструменти для аналізу. MG, TF та J-PL написали статтю.
Конфлікт інтересів
Автори заявляють, що дослідження проводилось за відсутності будь-яких комерційних або фінансових відносин, які можна трактувати як потенційний конфлікт інтересів.
Подяка
Ми вдячні Поліні Робіне, Джорджо Каміллі та Джессіці Квінтін (Інститут Пастера, Париж) за допомогу в ізоляції PBMC.
Виноски
Фінансування. Це дослідження фінансувалось проектом Aviesan Aspergillus, програмою уряду Франції Investissement d'Avenir, Laboratoire d'Excellence Integrative Biology of Emerging Infectious Diseases (Grant No ANR-10-LABX-62-IBEID), la Fondation pour la Recherche Médicale ( DEQ20150331722 LATGE Equipe FRM 2015). РС дякує Fundação за контрактом Ciência e Tecnologia (FCT) IF/00021/2014.
- DNP - визначення DNP за вільним словником
- Трав'яний фен-фен - визначення поняття «трав'яний фен-фен» за допомогою Вільного словника
- Внесок мікробіоти кишечника в експериментальну протизапальну дію, опосередковану P28GST, та
- Визначення Concor Concor за медичним словником
- Дієтична добавка Визначення дієтичної добавки в