Високожирне годування залежно від часу впливає на метаболічні шляхи, що ведуть до синтезу нервової кислоти при НАЖХП.
Кароліна Костянтинович-Новицька
1 Кафедра фізіології Медичного університету в Білостоці, 15-089 Білосток, Польща
Клавдія Берк
1 Кафедра фізіології, Білостоцький медичний університет, 15-089 Білосток, Польща
Адріан Чабовський
1 Кафедра фізіології, Білостоцький медичний університет, 15-089 Білосток, Польща
Ірена Касацька
2 Кафедра гістології та цитофізіології Медичного університету в Білостоці, 15-089 Білосток, Польща
Patrycja Bielawiec
1 Кафедра фізіології, Білостоцький медичний університет, 15-089 Білосток, Польща
Бартломій Лукашук
1 Кафедра фізіології Медичного університету в Білостоці, 15-089 Білосток, Польща
Ева Харасім-Симбор
1 Кафедра фізіології, Білостоцький медичний університет, 15-089 Білосток, Польща
Анотація
1. Вступ
2. Результати
2.1. Зміни концентрації ліпідів у печінці
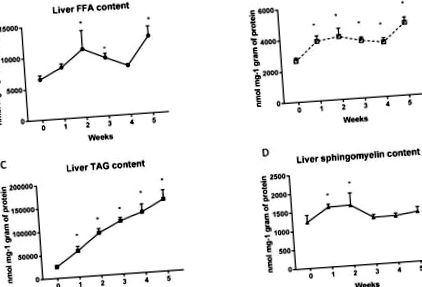
Рівень FFA в гомогенатах печінки після вживання дієти з високим вмістом жиру (HFD) значно зростає на другий (2-й тиждень: + 68%; p Рисунок 1 A), третій (3-й тиждень: + 44%; p Рисунок 1 A) і п’ятий (5-й тиждень: + 90%; p Малюнок 1 A) тиждень годування порівняно зі стандартною контрольною групою чау. Більше того, дієта з високим вмістом жиру значно збільшила вміст DAG (1-й тиждень: + 45,5%; p Рисунок 1 B) та TAG (1-й тиждень: + 129,5%; p Рисунок 1 C) вмісту на кожному тижні годівлі тварин. Цікаво, що рівень сфінгомієліну в печінці групи HFD був підвищений лише у перший (1-й тиждень: + 30,6%; p Рисунок 1 D) та другий (2-й тиждень: + 31,5%; p Рисунок 1 D) тижні дієта.
Репрезентативні вестерн-блоти, що демонструють експресію білків, що беруть участь у транспорті жирних кислот поза клітиною, тобто АТФ-зв'язуючий касетний транспортер A1 (Abca1) (A) і мікросомальний білок переносу триацилгліцерину (Mtp) (B) у гомогенатах печінки з контрольної групи (0 тижнів) та групи HFD наприкінці кожного експериментального тижня (1, 2, 3, 4 та 5). Експресію білка вимірювали за допомогою методу Вестерн-блот, як це було описано в розділі «Матеріали та методи». Дані виражаються як середнє значення ± S.D. і базуються на шести незалежних визначеннях (n = 6). * p Малюнок 4 А). На наш подив, експресія синтази жирних кислот (Fas) в гомогенатах печінки помітно знижувалася щотижня, за винятком першого тижня дієти з високим вмістом жиру. (2-й тиждень: -42,3%; 3-й тиждень: -49,4%; 4-й тиждень: -54,9%; 5-й тиждень: -51%; p Малюнок 4 B). Однак годування з високим вмістом жиру спровокувало збільшення експресії елонгази 3 (Elovl3) та елонгази 6 (Elovl6) порівняно зі стандартною групою, яку годували чау (Elovl3: 2-й тиждень: + 19,7%; p Рисунок 4 C Elovl6: 4-й тиждень: + 33,4%; p Малюнок 4 D). Крім того, ми спостерігали значне підвищення експресії бета-гідроксиацил-КоА дегідрогенази (β-had) в кінці нашого дослідження порівняно з контрольною групою (4-й тиждень: + 34,5%; p Малюнок 4 E). Зниження експресії стеароїл-КоА десатурази 1 (Scd1) спостерігалось у печінці щурів HFD, але воно не досягло значного рівня (рис. 4 F).
2.6. Зміни у відношенні подовження та десатурації
Співвідношення 18: 0/16: 0 було підвищене під час дієтичного харчування з високим вмістом жиру у фракції FFA на кожному тижні нашого дослідження (1-й тиждень: 0,24; 2-й тиждень: 0,38; 3-й тиждень: 0,47; 4-й тиждень: 0,43; 5-й тиждень: 0,46; p Рисунок 6 A), а також у фракціях DAG і TAG на першому, другому і п’ятому тижнях порівняно зі стандартною групою, яку годували чау (DAG: 1-й тиждень: 0,73; 2-й тиждень: 0,74; 5-й тиждень: 0,7; TAG: 1-й тиждень: 0,15; 2-й тиждень: 0,13; 5-й тиждень: 0,11; p Малюнок 6 A). У сфінгомієліну ми спостерігали значне збільшення співвідношення 18: 0/16: 0 на другому та п’ятому тижнях у порівнянні з контрольною групою (2-й тиждень: 0,6; 5-й тиждень: 0,48; p Рисунок 6 A). Співвідношення 20: 0/18: 0 зростало лише у фракції сфінгомієліну, на першому, третьому та четвертому тижнях, що було статистично значущим у порівнянні зі стандартною чау-їжею (1-й тиждень: 0,09; 3-й тиждень: 1; 5-й тиждень: 0,09; р Малюнок 6 Б). Більше того, ми продемонстрували значне зростання співвідношення FFA 22: 0/20: 0 протягом другого, третього та п’ятого тижня дієти з високим вмістом жиру (2-й тиждень: 7,6; 3-й тиждень: 8,6; 5-й тиждень: 7,6; p Малюнок 6 В). На відміну від цього, співвідношення TAG та сфінгомієліну 22: 0/20: 0 зменшувалися на кожному тижні нашого дослідження порівняно з контрольною групою (TAG: 1-й, 2-й, 3-й, 4-й, 5-й тиждень: 0,01; p Рисунок 6 C).
2.7. Зміни в співвідношенні De Novo ліпогенезу (16: 0/18: 2 співвідношення n-3), діяльності n-3 (20: 5 + 22: 6)/18: 3) та n-6 шляхів (20: 4/18: 2 п-6).
HFD спричинив значне зменшення співвідношення FFA 16: 0/18: 2n-3 з другого тижня до кінця нашого дослідження (2-й тиждень: 0,35; 3-й тиждень: 0,28; 4-й тиждень: 0,27 5-й тиждень: 0,27; p Рисунок 7 А) порівняно з контрольною групою. Подібним чином, коефіцієнт DAG і TAG de novo ліпогенезу значно зменшився протягом усього годування HFD, і зниження було більш вираженим на п'ятому тижні нашого дослідження (DAG: 1-й тиждень: 0,92; 2-й тиждень: 0,69; 3-й тиждень: 0,92; 4-й тиждень: 0,76; 5-й тиждень: 0,83; TAG: 1-й тиждень: 0,95; 2-й тиждень: 0,93; 3-й тиждень: 0,82; 4-й тиждень: 0,83 5-й тиждень: 0,88; p Рисунок 7 А). На відміну від цього, співвідношення 16: 0/18: 2n-3 у фракції сфінгомієліну помітно підвищувалось лише на третьому тижні HFD (3-й тиждень: 22,4; p Рисунок 7 A). Співвідношення FFA (20: 5 + 22: 6)/18: 3 значно зросло протягом першого тижня годування HFD, а потім зменшилося з другого тижня до кінця нашого дослідження (1-й тиждень: 3,6; 2-й тиждень: 1,8; 3-й тиждень: 1,5; 4-й тиждень: 1,6; 5-й тиждень: 1,5; p Рисунок 7 Б). Тоді як дієта з високим вмістом жирів спровокувала значне зменшення співвідношення DAG (20: 5 + 22: 6)/18: 3 з другого тижня нашого дослідження (DAG: 2-й тиждень: 2,5; 3-й тиждень: 2,3; 4-й тиждень: 2.1; 5-й тиждень: 2.22; p Рисунок 7 B).
2.8. Печінкові гістологічні зміни
Репрезентативні гістологічні зображення, що демонструють фарбування печінки гематоксилін-еозином (Н + Е) з контрольної групи (0 тижнів, A) та HFD-групи в кінці першої (B), другий (C.), третій (D), четвертий (Е) і п'ятий (F) експериментальний тиждень. Дані базуються на шести незалежних визначеннях (n = 6) одного і того ж фрагмента частки від кожної щури. Оригінальне збільшення 200 × і довжина калібрувальної планки становить 50 мкм.
Репрезентативні гістологічні зображення зрізів печінки, що показують накопичення крапель ліпідів, забарвлених Олійним червоним O з контрольної групи (0 тижнів, A) та HFD-групи в кінці першої (B), другий (C.), третій (D), четвертий (Е) і п'ятий (F) експериментальний тиждень. Дані базуються на шести незалежних визначеннях (n = 6) одного і того ж фрагмента частки від кожної щури. Оригінальне збільшення 200 × і довжина калібрувальної планки становить 50 мкм.
Оцінка активності NAFLD у відділах печінки, тобто оцінка стеатозу печінки (A), оцінка балонізації гепатоцитів (B), оцінка запалення (C.) і загальний обсяг NAS (D) з контрольної групи (0 тижнів) та групи HFD наприкінці кожного експериментального тижня (1, 2, 3, 4 та 5). Для системи підрахунку балів використовували гістологічні зображення, як описано в розділі «Матеріали та методи».
3. Обговорення
На закінчення ми можемо запідозрити, що дієта з високим вмістом жирів поступово впливала на печінковий ліпідний обмін, переходячи від синтезу корисних жирних кислот, таких як нервова кислота, до надмірного накопичення прозапальних ліпідів, особливо у фракції TAG. Однак наше дослідження чітко продемонструвало одночасне прогресування захисних механізмів проти ліпотоксичності, виражене як надмірне накопичення TAG у печінці, посилене β-окислення ліпідів та витікання в кровообіг. Більше того, спостерігається перерозподіл жирних кислот серед ліпідних фракцій та зниження концентрації нервової кислоти, особливо у сфінгомієліні в плазмі, що відображає розвиток та прогресування НАЖХП, має цінний потенціал стати новим прогностичним маркером для виникнення цієї хвороби.
4. Матеріали та методи
4.1. Тварини та навчальний дизайн
4.2. Аналіз ліпідів сироватки та печінки
Концентрації окремих метилових ефірів жирних кислот у плазмі та печінці екстрагували розчином хлороформу-метанолу методом Folch [26] та розділяли на фракції вільних жирних кислот (FFA), DAG, TAG та сфінгомієлін за допомогою тонкошарової хроматографії (TLC ) [27]. Згодом окремі фракції жирних кислот метилировали в 14% розчині метанолу в трифториді бору та кількісно визначали відповідно до часу утримування стандартів із застосуванням процедури газорідинної хроматографії (GLC Hewlett-Packard, Пало Альто, Каліфорнія, США, серія 5890 II газова хроматографія HP-invowax капілярна колонка, обладнана полум'яно-іонізаційним детектором), як було детально описано раніше [27]. Крім того, виходячи зі складу жирних кислот, ми розрахували коефіцієнт подовження (18: 0/16: 0; 20: 0/18: 0; 22: 0/20: 0; 24: 0/22: 0), коефіцієнт десатурації ( 24: 1/24: 0), коефіцієнт ліпогенезу de novo (16: 0/18: 2n-3), активність n-3 (20: 5 + 22: 6)/18: 3) та n-6 шлях (20: 4/18: 2 n-6) у певній ліпідній фракції. Кількість вмісту FFA, DAG, TAG та сфінгомієліну оцінювали як суму окремих видів жирних кислот оцінюваних фракцій, і їх виражали в наномолях на грам тканини.
4.3. Імуноблотинг
Експресія білків, що беруть безпосередню участь у ліпогенезі (Fas; Cell Signaling, Беверлі, Массачусетс, США), шлях окислення (Cpt1, β-had; Санта Круз Біотехнологія, Даллас, Техас, США) та процес десатурації та елонгації (Elovl3, Elovl6, Scd1; Біотехнологія Санта-Крус), а також білки-експортери жирних кислот: Abca1 (Thermo Scientific, Waltham, MA, USA) та Mtp (Santa Cruz Biotechnology) були виявлені за допомогою рутинних вестерн-блотінгів, як раніше детально описано Konstantynowicz-Nowicka et ін. [28]. Коротко, концентрацію білка визначали, використовуючи метод біцинхонової кислоти (BCA) з бичачим сироватковим альбуміном (BSA) як стандарт. Сигнали, отримані за допомогою імуноблотингу, кількісно визначали денситометрично за допомогою системи візуалізації ChemiDoc (Bio Rad, Варшава, Польща). Рівне завантаження білка було підтверджено за допомогою фарбування Ponceau S. Експресія всіх білків була стандартизована до експресії Gapdh (Санта Круз Біотехнологія), а контроль встановили на 100%.
4.4. Гістопатологія печінки
Зразки печінки (однаковий фрагмент частки від кожної щури) відбирали для гістологічних досліджень. Їх фіксували у 10% забуференному формаліні та регулярно обробляли для вбудовування у парафін. Зрізи вирізали товщиною 4 мкм і фарбували гематоксилін-еозином (Н + Е). Краплі ліпідів у тканинах печінки визначали фарбуванням Oil Red O. Свіжозібрані фрагменти печінки поміщали в Tissue-Tek® O.C.T. ™ (Sakura Finetek, Alphen aan den Rijn, Нідерланди), потім заморожували при ™ 30 ° C. Зрізи товщиною 7 мкм вирізали на замороженому мікротомі та розмістили на клейких предметних стеклах. Зрізи інкубували в пропіленгліколі протягом 2 хв. і, згодом, у розчині Oil Red O протягом 6 хв. Потім зрізи тканин диференціювали у 85% пропіленгліколі протягом 1 хв, двічі промивали у воді та інкубували у гематоксиліні протягом 1–2 хв. Потім зрізи промивали у водопровідній воді за звичайною процедурою і покривали водним монтажним середовищем. Результати фарбування були представлені для оцінки в мікроскопі Olympus BX41 з камерою Olympus DP12 (Гамбург, Німеччина) при збільшенні 200 × (об'єктив 20 × і окуляр 10 ×).
Стеатоз печінки, запалення та гепатоцелюлярний балонізація були оцінені чотирма незалежними патологами, не знаючи про тип експериментальної групи. Вони оцінили діагноз НАЖХП за допомогою NAS (оцінка активності НАЖХП коливалася від 0 до 8) [29] як найпопулярнішої системи оцінювання та постановки, що складається з трьох частин, як показано нижче:
0 для 66% гепатоцитів стеатотичних.
б) Здуття гепатоцитів
0 для жодних балонних гепатоцитів;
1 для кількох балонних гепатоцитів;
2 для багатьох балонних гепатоцитів.
0 для відсутність запальних вогнищ
1 для 1–2 запальних вогнищ на поле × 20;
2 для 2–4 вогнищ запалення на поле × 20;
3 для> 4 запальних вогнищ на поле × 20.
Оцінка> 4 при стеатозі та балонуванні гепатоцитів вважалася НАЖХП.
- До побачення, чіпси з високим вмістом жиру Нові правила для шкільних закусок
- Дієта з високим вмістом жиру змінює фізіологію мікробіоти кишечника у мишей - PubMed
- Провідне рішення для ожиріння - хірургія схуднення в Південній Каліфорнії
- Кишкове мікробне та метаболічне профілювання мишей, котрі харчуються дієтами з високим вмістом глюкози та високим вмістом фруктози
- Як виміряти рівень метаболізму - манекени