Високий ІМТ суттєво пов’язаний із позитивним статусом рецепторів прогестерону та клініко-патологічними маркерами неагресивного захворювання при раку ендометрія
Предмети
Ця стаття оновлена
Анотація
Передумови:
У промислово розвинутих країнах зростає захворюваність на рак ендометрію. Високий індекс маси тіла (ІМТ, кг м −2) пов’язаний з вищим ризиком захворювання. Ми хотіли дослідити, чи ІМТ пов'язаний з клініко-патологічними характеристиками, статусом гормональних рецепторів у первинній пухлині та результатами захворювання при раку ендометрія.
Пацієнти та методи:
Загалом протягом 1981–2009 років було досліджено 1129 жінок, які в основному лікувались від карциноми ендометрія в Університетській лікарні Хокеленда. Індекс маси тіла був доступний для 949 пацієнтів і стосувався вичерпних клінічних та гістопатологічних даних, статусу гормональних рецепторів пухлини, лікування та спостереження.
Результати:
Високий ІМТ був суттєво пов'язаний із низьким рівнем Міжнародної федерації гінекології та акушерства (FIGO), ендометріоїдною гістологією, низьким/середнім ступенем та високим рівнем мРНК рецепторів прогестерону (PR) за допомогою qPCR (n= 150; P= 0,02) та експресія білка за допомогою імуногістохімії (n= 433; P= 0,003). На відміну від них, рецептор естрогену (ERα) статус не був пов'язаний з ІМТ. Жінки із зайвою вагою/ожирінням мали значно кращу специфічну для виживання хворобу (DSS), ніж жінки з нормальною/недостатньою вагою при однофакторному аналізі (P= 0,035). При багатофакторному аналізі DSS з урахуванням віку, стадії FIGO, гістологічного підтипу та ступеня ІМТ не виявив незалежного прогностичного впливу.
Висновок:
Високий ІМТ суттєво асоціювався з маркерами неагресивного захворювання та позитивним PR-статусом у великому популяційному дослідженні карциноми ендометрію. Жінки з високим ІМТ мали значно кращий прогноз при однофакторному аналізі DSS, ефект, який зник при багатофакторному аналізі з урахуванням встановлених прогностичних маркерів. Роль PR у канцерогенезі ендометрія потребує подальшого вивчення.
На цьому тлі ми дослідили взаємозв'язок між ІМТ та великою групою клінічних та гістопатологічних даних, статусом гормональних рецепторів у первинних пухлинах та результатами захворювання у великій популяційній серії карциноми ендометрію.
Пацієнти та методи
Серія пацієнта
Серія пацієнтів включає 1129 жінок, які в першу чергу лікувались від карциноми ендометрія в Університетській лікарні Хокеленда в період з 1981 по 2009 рік. Це лікарня для направлення в окрузі Хордаланд, де проживає 475 000 жителів, що становить близько 10% норвезького населення (SSB, 2010) . Рівень захворюваності на рак ендометрія та прогноз у цій області подібні до даних для загальної кількості населення (Норвезький реєстр раку, 2009).
Інформація про зріст, вагу, вік, менопаузальний статус, стадію Міжнародної федерації гінекології та акушерства (FIGO), гістологічний підтип та ступінь, лікування та спостереження була зібрана шляхом перегляду медичних записів та листування з первинними лікарями. Загалом 91% жінок перенесли гістеректомію з двосторонньою сальпінгоофоректомією як первинне лікування і класифікувались за критеріями FIGO 1988 (Mikuta, 1993). Якщо хірургічне лікування було протипоказане, постановка проводилась на основі наявної інформації з результатів кюретажу, клінічного обстеження, рентгенографії грудної клітки та КТ черевної порожнини.
Час спостереження визначався як часовий інтервал між датою первинного діагнозу та датою смерті або останнім спостереженням. Середній час спостереження становив 4,9 року (діапазон 0,01-23,2). Загалом 223 пацієнти (20%) померли від карциноми ендометрію протягом періоду спостереження, тоді як 207 (18%) померли від інших причин. Ці дані були перевірені з даними Реєстру ракових захворювань Норвегії та Реєстру статистичних даних Норвегії. Останнє спостереження було 20 грудня 2009 року.
Індекс маси тіла розраховували як вагу (кг), поділену на зріст у квадраті (м 2), обидва вимірювали на момент постановки діагнозу. Ці дані були доступні для 949 пацієнтів (84%). Для статистичного аналізу ІМТ ми використовували квартилі для набору даних як точки вирізання, а також встановлену систему класифікації ВООЗ; ІМТ до 18,5 (недостатня вага), від 18,5 до 24,9 (норма), від 25 до 29,9 (надмірна вага) і> 30 (ожиріння). Зріст і вага контурних ліній (ІМТ 50, n= 7) було перепроверено. Всі аналізи також проводились за винятком цих; це не вплинуло на жоден з висновків.
Імуногістохімія
Зразки пухлини, закріплені у формаліні парафіну, були встановлені в тканинних мікрочипах (ТМА), як описано раніше (Hoos et al, 2001; Stefansson et al, 2004). Коротко, ТМА був побудований шляхом виявлення області найвищого ступеня пухлини на зафарбованих НЕ предметних скельцях з подальшим вибиванням трьох циліндрів тканини з вибраних ділянок донорського блоку та встановленням їх у парафіновий блок реципієнта за допомогою спеціально виготовленого прецизійного приладу ( Beecher Instruments, Silver Spring, MD, США). Імуногістохімічне фарбування за статусом рецепторів оцінювали для рецепторів естрогену та прогестерону (ERα та PR) і доступний для 437 та 433 пацієнтів для ЕРα та PR відповідно (38% досліджуваного населення). Метод імуногістохімічного фарбування був описаний раніше, використовуючи нижній квартиль для визначення втрати рецептора (Engelsen et al, 2008b).
qPCR-аналіз
У підгрупи з 150 пацієнтів (13%) свіжа заморожена пухлинна тканина була зібрана проспективно і доступна для аналізу мРНК паралельно з імуногістохімічним фарбуванням. Загальну РНК витягували за допомогою набору RNeasy (Qiagen, Hilden, Німеччина) з контролем якості та методом обробки даних, як повідомлялося раніше (Engelsen et al, 2008a; Salvesen et al, 2009). Рівні експресії мРНК у пухлинах для ERα та PR досліджували за допомогою qPCR, використовуючи метод TaqMan Array Low Density Array (Engelsen et al, 2008a).
Статистичні методи
Індекс маси тіла в категоріях ВООЗ застосовувався для оцінки розподілу різних клініко-патологічних змінних, використовуючи Пірсона χ 2 -тест. Статус гормональних рецепторів у первинній пухлині щодо ІМТ оцінювався Манном – Уїтні U-тест. Однофакторні аналізи виживання для специфічної для хвороби виживання (DSS) та загальної виживаності (OS) проводили за допомогою методу Каплана – Мейєра (log-rank тест). Пропорційний регресійний аналіз ризику Кокса застосовували для оцінки прогностичного впливу ІМТ з урахуванням встановлених прогностичних маркерів при карциномі ендометрія. Ми порівняли розподіл клініко-патологічних змінних та прогнозу для пацієнтів з наявними даними щодо ІМТ серед пацієнтів, де ці дані відсутні (16%). Жінки, у яких відсутні дані ІМТ, були старшими, середній вік 69,3 року, порівняно з 65,2 року для групи, де ІМТ був зареєстрований, P= 0,004 (Манн – Уїтні U-тест). Інших суттєвих відмінностей не виявлено. Для аналізу даних було використано статистичне програмне забезпечення PASWStatistics18.0 (SPSS Inc., Чикаго, Іллінойс, США).
Дослідження було схвалено IRB (NSD 15501, REK III nr 052.01).
Результати
Високий ІМТ асоціюється з клініко-патологічними маркерами неагресивного захворювання
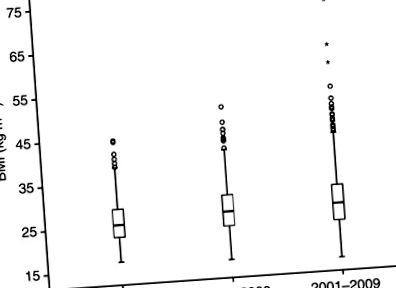
Медіана ІМТ на момент встановлення діагнозу становила 26,4 (діапазон 14,7–73,0), при цьому значно зростав ІМТ протягом періоду дослідження, P= 0,002 (рисунок 1). Існував значний зв’язок між ІМТ та віком пацієнта під час діагностики, стадією FIGO та гістологічним підтипом, як показано в таблиці 1. Частка пацієнтів з ІМТ ⩾ 25, тоді як спостерігалася тенденція до того, що пацієнти середніх вікових квартилів мали б надмірна вага або ожиріння. Частка нормальних/худорлявих пацієнтів була більшою для III та IV стадій FIGO порівняно з I та II стадіями FIGO. Високий ІМТ також був пов’язаний з гістологією ендометріоїдів. Не було значної зв'язку між ІМТ та менопаузальним статусом, а також ІМТ та ступенем. Крім того, не було значної різниці в кількості проведених лімфаденектомій, пов'язаних з ІМТ (P= 0,99), але тенденція до більш ад'ювантної терапії пацієнтам з ІМТ Рисунок 1
Розподіл ІМТ для хворих на карциному ендометрію, які отримували лікування в одному визначеному регіоні Норвегії (графство Хордаланд) у періоди 1981–1990, 1991–2000 та 2001–2009. Медіана ІМТ та діапазону значно зростає з 25,3 (16,9–44,5) до 26,7 (15,8–50,5) та 26,9 (14,7–73,0) за досліджувані періоди часу, P= 0,002 (тест Крускала – Уолліса). = незначні викиди та = основні викиди.
Високий ІМТ асоціюється з позитивним PR-статусом пухлини
При дослідженні біомаркерів на статус рецепторів у пухлинах, пов’язаних з ІМТ, ми виявили, що у пацієнтів з PR-негативними пухлинами (за даними IHC) середній ІМТ був нижчий у порівнянні з пацієнтами, які мали PR-позитивні пухлини, медіана 25,5 проти 26,9 відповідно (P= 0,003, Манн – Уїтні U-тест). Ми не виявили жодної суттєвої кореляції між ІМТ та ЕРα статус пухлин (P= 0,08) (таблиця 1). Для подальшої перевірки цього висновку ми дослідили підмножину 150 свіжозаморожених зразків пацієнтів для рівня експресії мРНК для гормональних рецепторів за допомогою qPCR. Це підтвердило значно вищий рівень експресії мРНК для PR у пацієнтів з ІМТ> 25 порівняно з пацієнтами з нижчим ІМТ (P= 0,02, Манн – Уїтні U-тест). Для ERα, такої асоціації з ІМТ не спостерігалося для рівнів експресії мРНК (P= 0,21). Втрата ERα та PR (за IHC) був пов'язаний із статусом постменопаузи (P= 0,01 і P= 0,006, відповідно, Пірсона χ 2-тест).
ІМТ та прогноз
Одновимірний аналіз
Встановлені клініко-патологічні змінні показали, як і очікувалось, дуже значний вплив на СППР, як зазначено в таблиці 2. У однофакторному аналізі спостерігалася тенденція до кращого прогнозу для пацієнтів з вищим ІМТ (таблиця 2). Пацієнти із зайвою вагою/ожирінням проти нормальна/недостатня вага, як визначено ВООЗ, мала кращий DSS, з 5-річним виживанням 82% для жінок з ІМТ ⩾ 25 порівняно з 76% для ІМТ ⩾ 25 (P= 0,18; Малюнок 2B). В аналізі ОС ми також бачимо закономірність зменшення різниці виживаності між двома групами ІМТ> 10 років після діагностики. Це може стосуватися більш високого ризику розвитку інших захворювань у жінок із зайвою вагою, що є більш важливим, ніж ризик смертності від раку> 10 років після діагностики.
Однофакторний графік виживання Каплана – Мейєра для оцінки DSS (A) та ОС (B) у пацієнтів з карциномою ендометрію, пов’язаною з ІМТ. Загальна кількість пацієнтів у кожній групі супроводжується кількістю смертей, наведеними в дужках; P-значення на основі тесту Мантеля – Кокса.
Багатовимірний аналіз
Ефект виживання ІМТ, який спостерігався при однофакторному аналізі на СПП, зник, коли було зроблено корекцію віку на момент діагностики (безперервна змінна), стадії FIGO, гістологічного підтипу та ступеня при багатофакторному регресійному аналізі Кокса, як зазначено в Таблиці 3. Коригування ЧСС для ІМТ ⩾ 25 становив 0,93 (ДІ 0,68–1,27, P= 0,65). Коли ІМТ застосовували як безперервну змінну в тій самій моделі Кокса, ми виявили подібний незначний показник ІМТ для ІМТ 1,01 (ДІ 0,98–1,04) та закономірність для інших змінних з незалежним впливом лише на стадію та вік FIGO. На відміну від цього, використовуючи ОС як кінцеву точку в моделі Кокса, ми виявили, що ІМТ мав незалежний вплив на прогноз при введенні як безперервної змінної з ЧС 1,02 (ДІ 1,00–1,04), P= 0,035). Стадія та вік FIGO також були незалежними предикторами прогнозу (P Таблиця 3 Аналіз виживання 905 хворих на карциному ендометрію на основі моделі пропорційних ризиків Кокса
Обговорення
Наскільки нам відомо, на сьогодні це найбільш повне дослідження клініко-патологічних змінних. Це також найбільше на сьогодні дослідження, що вивчає взаємозв'язок між ІМТ та великою групою маркерів фенотипу пухлини при карциномі ендометрію. Великий обсяг вибірки з ретельною характеристикою стадії FIGO, гістологічного підтипу та класу надає більшої точності оцінкам незалежного прогностичного впливу ІМТ порівняно з меншими попередніми дослідженнями. Крім того, той факт, що досліджувана серія пацієнтів була похідною від чітко визначеного географічного регіону в Норвегії, який раніше був репрезентативним для загальної норвезької популяції (Salvesen et al, 1999), свідчить про те, що результати можуть бути репрезентативними для кавказького пацієнта населення в цілому.
Ми виявили позитивну зв'язок між високим ІМТ та сприятливим DSS при однофакторному аналізі, але не при багатовимірному аналізі. Однак при багатовимірному аналізі ОС ми виявили незалежний несприятливий прогностичний вплив збільшення ІМТ. Попередні дослідження, що вивчають вплив ІМТ на виживання, повідомляли суперечливі результати, які можуть бути зумовлені розмірами зразків, вибором точки зрізу для ІМТ, застосованими змінними результатами та групою клініко-патологічних маркерів, скоригованих для багатовимірного аналізу. Подібно до цього дослідження, декілька повідомляють про тенденцію до кращого виживання при надмірній вазі порівняно з більш стрункими жінками (Anderson et al, 1996; Temkin et al, 2007; Munstedt et al, 2008). Інші дійшли висновку без різниці (Jeong et al, 2010) та ще гіршої виживаності жінок із вищим ІМТ (von Gruenigen et al, 2006). Виживання, характерне для захворювання, застосоване в цьому дослідженні, швидше за все, буде точним при виявленні смертей, безпосередньо пов’язаних із вивченою хворобою. Попередні дослідження, в основному із застосуванням ОС, могли недооцінити позитивний біологічний вплив ожиріння, оскільки жінки з ожирінням збільшують ризик смерті від інтеркурентних захворювань (Anderson et al, 1996; Temkin et al, 2007). Наші висновки про те, що ОС менш сприятлива для жінок, що страждають ожирінням, з урахуванням стандартних клініко-патологічних факторів ризику можуть підтвердити це.
Обмеження нашого дослідження полягає в тому, що ІМТ вимірюється під час діагностики. Це може призвести до упередженості, оскільки агресивний рак часто асоціюється із втратою ваги, кахексією та анорексією (Keller 1993). Отже, ми, можливо, недооцінили вагу пацієнтів із раком високої стадії.
- Високий рівень дієтичного споживання магнію пов’язаний із низькою резистентністю до інсуліну в Ньюфаундленді
- Здорова, але висока калорія - ресурси для схуднення
- Ризики для здоров’я, пов’язані з надмірною вагою, правда про вагу®
- Як високі підбори можуть покращити ваше сексуальне життя - ABC News
- Заміни низькокалорійних макаронних виробів з високим вмістом калорій з беконом та сиром Харчування здорове