Вимірювання впливу західної дієти на архітектуру тканин печінки за допомогою автофлюоресценції FLIM та мікроскопії гармонік
Суман Ранджит
1 Лабораторія динаміки флуоресценції, кафедра біомедичної інженерії, Каліфорнійський університет, Ірвін, Каліфорнія, США
Олександр Дворников
1 Лабораторія динаміки флуоресценції, кафедра біомедичної інженерії, Каліфорнійський університет, Ірвін, Каліфорнія, США
Євгенія Добринських
2 кафедри медицини, Медичний університет Колорадо-Аншутц, Аврора, Колорадо, США
Сяосін Ван
2 кафедри медицини, Медичний університет Колорадо-Аншутц, Аврора, Колорадо, США
Юхуань Ло
2 кафедри медицини, Медичний університет Колорадо-Аншутц, Аврора, Колорадо, США
Моше Леві
2 кафедри медицини, Медичний університет Колорадо-Аншутц, Аврора, Колорадо, США
Енріко ratреттон
1 Лабораторія динаміки флуоресценції, кафедра біомедичної інженерії, Каліфорнійський університет, Ірвін, Каліфорнія, США
Анотація
Фазовий підхід до візуалізації автофлуоресценції протягом життя був використаний для ідентифікації та характеристики видів, що тривалий термін життя (LLS) (
7,8 нс) у печінці мишей, яких годували західною дієтою. Розмір територій, що містять цей вид LLS, залежить від типу дієти, і розподіл за розмірами показує, що західна дієта має набагато більші розміри LLS. Поєднання зображень третьої гармоніки із FLIM ідентифікувало види LLS із краплями жиру та було оцінено розподіл розміру крапель. Мікроскопія другої гармоніки у поєднанні з фазором FLIM показує, що при західній дієті спостерігається збільшення фіброзу. Нове розкладання трьох компонентів фазового сюжету показує, що західна дієта корелює з більшою часткою вільного NADH, що означає більший стан зниження та більший гліколітичний стан. Багатопараметричний аналіз розподілу фазорів показує, що від розподілу фазорних точок можна відокремити західну дієту, яку годують, та дієту з низьким вмістом жиру, яку годують зразками печінки мишей. Фазовий підхід до аналізу FLIM-зображень автофлуоресценції у зразках печінки може призвести до відкриття нових флуоресцентних видів, і тоді ці нові флуоресцентні види можуть допомогти оцінити архітектуру тканин. Нарешті, інтеграція FLIM та аналіз другої та третьої гармонік забезпечує міру прогресування фіброзу як ефекту дієти.
1. Вступ
7,8 нс), знайдений у крапельках жиру в тканинах печінки, що є результатом західної дієти. Раніше цей вид тривалого життя спостерігався в клітинах, що харчуються олеїновою кислотою, або коли клітини перебувають у гіпоксії для утворення активних форм кисню (АФК) або в жирових тканинах миші [22, 23]. Раман-сигнатура тригліцеридів збігається з наявністю цього виду LLS у цих краплях при обробці олеїновою кислотою [22]. Окислення АФК жирових молекул є ймовірною причиною утворення LLS, і тут ми використали цей сигнал LLS для виявлення та розрізнення впливу західної дієти на зрізи тканин печінки.
Мікроскоп, що використовується для наших вимірювань, базується на детекторі прямого напрямку, де дані збираються у напрямку збудження, і він чудово чутливий для гармонічного зображення [24-26]. У роботі, описаній у цій роботі, ми використовували зображення генерації третьої гармоніки, особливо чутливі до меж крапель жиру, щоб показати, що компонент LLS збігається з краплями [27]. Ми також використовували комбінаторний підхід FLIM та генерації другої гармоніки (SHG) для кількісної оцінки ступеня фіброзу в тканинах печінки [28–32].
2. Методи
2.1 Модель тварини та підготовка зрізу тканини
8-тижневих мишей-самців C57BL/6J отримували з лабораторії Jackson. Їм годували 6 місяців відповідну контрольну дієту з низьким вмістом жиру (НЖ, 10 ккал% жиру) або західну дієту (ВД, 42 ккал% молочного жиру, 34% сахарози, 0,2% холестерину). Дослідження на тваринах та відносні протоколи були затверджені Комітетом з догляду та використання тварин при Університеті Колорадо в Денвері. Усі експерименти на тваринах проводились відповідно до Керівництва з догляду та використання лабораторних тварин (Національний інститут охорони здоров’я, Бетесда, штат Медіка).
В кінці періоду годування мишей знеболювали, а печінку видаляли та обробляли замороженою в суміші OCT (оптимальна температура різання) або фіксованому формаліні та вкладеному парафіні (FFPE). Тканину розрізали на ділянки товщиною 5 мкм, і цю ділянку встановили на предметне скло. З'єднання OCT видаляли за допомогою буфера DPBS (ThermoFisher Scientific, Waltham, MA) і зріз встановлювали на покривному склі, використовуючи той самий буфер. Зрізи парафіну візуалізували з оптичним зрізом після “підкладки” предметних стекол при 60 ° C без подальшого видалення парафіну ксилолом та етанолом.
2.2 Збір даних: DIVER та фазовий підхід до FLIM
2.3 Аналіз даних
2.3.1 Фазовий аналіз
Флуоресценція та гармонічні сигнали, зібрані з кожної точки зображення, перетворювались у простір фазорів за допомогою наступного перетворення [20, 33, 34]
де si, j (ω) та gi, j (ω) - координати Y та X у фазовому графіку відповідно; ω - частота повторення джерела лазера в радіанах, T - період частоти повторення лазера і n - частота гармонік. Ii, j - затухання інтенсивності, виміряне на кожному пікселі вихідного оптичного зображення. Флуоресценція, зібрана з кожного пікселя зображення, перетворюється в точку на фазовому графіку. Зміни метаболізму та накопичення ліпідів внаслідок змін у раціоні можуть змінити положення фазових точок та загальну схему розподілу фазової ділянки. Потім можна вибрати набір фазових точок, використовуючи кольоровий курсор, і відповідне зображення можна відповідно забарвити. Ми описуємо різні способи аналізу розподілу фазорів для кількісної оцінки різних видів у спостережуваній тканині.
2.3.2 Розрахунок розміру крапель ліпідів
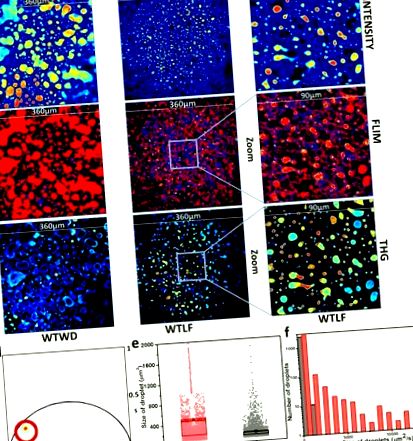
Місце розташування видів, що живуть довгий час, на фазовій ділянці було обрано червоним курсором, а зображення FLIM були відповідно пофарбовані (рис. 1 (d)). Вид LLS присутній лише в краплях ліпідів. Таким чином, розмір крапель можна виміряти, вимірявши розмір площі зображень, охоплених LLS. Існує велика кількість крапель дуже малого розміру, які зазвичай присутні в тканинах печінки. Порогове значення> 85 мкм 2 у розподілі за розміром для крапель жиру призводить до кращого відокремлення зображень від тканин печінки при західній дієті з високим вмістом жиру та дієті з низьким вмістом жиру. Тоді розміри крапель можуть бути представлені графіком коробки або гістограмами (рис. 1 (e) та 1 (f). Графік поля показує, як змінюється середнє та стандартне відхилення розміру крапель залежно від типу Гістограма показує, як краплі для західної дієти поширюються на значно більші розміри, ніж ті, що спостерігаються для зразків дієти з низьким вмістом жиру.
Вплив дієти на розмір крапель ліпідів. (а) репрезентативні зображення інтенсивності флуоресценції, (б) зображення автофлуоресценції FLIM та (c) зображення зразків третьої гармоніки (THG) з зразків жирової дієти (WD) та знежиреної дієти (LF) відповідно. FOV становить 360 мкм. Збільшене зображення (90 мкм) (права панель) інтенсивності (a) FLIM (b) та THG (c) показує, що сигнали LLS від зразків тканини печінки мишей LF дієт збігаються з дуже дрібними крапельками. Ці зображення робляться шляхом масштабування відповідних НЧ (360 мкм) зображень. (d) Фазовий графік зображень FLIM печінки. Червоний курсор був використаний для вибору довготривалого виду (LLS) на фазовому графіку, а зображення FLIM були відповідно забарвлені фазорами, вибраними червоним курсом. (e) Графічний графік, що описує середнє значення (невеликий заповнений квадрат) та стандартне відхилення (верх і низ коробки) для зразків WD (червоний) та LF (чорний). Точки представляють індивідуальне вимірювання на кожному зображенні. (f) Гістограма крапель розміром понад 85 мкм 2. Червоний та сірий представляють зразки WD та LF відповідно. Значення р для тесту Колмогорова-Смирнова (K-S) для даних на панелях e і f було менше 0,0001.
2.3.3 Розрахунок частки вільного та зв’язаного NADH
Поєднання та розташування компонентів фазору в аналізі FLIM регулюється законом додавання фазорів [20]. Відповідно до цього закону, положення фазової точки, що є результатом спаду флуоресценції на певному пікселі зображення, можна простежити до фазових позицій компонентів, відповідальних за флуоресценцію в цій конкретній точці. Закон додавання фазора диктує, що відносний внесок двох або більше фазових точок в іншу точку між ними обернено пропорційний відстані між точкою посередині та відповідними фазовими точками [20]. Зображення FLIM для західної дієтичної печінки мають фазовий підпис у каналі NADH, що є результатом їх оригінальних видів, що сприяють. Зображення, зроблені за допомогою фільтра NADH, мають внесок із вільного NADH (
0,4 нс), зв’язаний НАДН (3,4 нс) і види, що тривалий час життя (
8 нс). Ці три компоненти були обрані із зеленим, синім та червоним курсорами відповідно на рис. 2 (а). Окремі частки можна обчислити залежно від положення фазових точок усередині трикутника, що визначається червоним, зеленим і синім курсором.
Розкладання фазової ділянки з використанням трьох компонентів (а) Розміщення трьох компонентів у розподілі фазорів, що використовуються для поділу різних внесків, показано, а червоний, зелений та синій представляють LLS, зв’язаний та вільний NADH, відповідно. Чорна точка представляє точку у розподілі фазорів, частка якої відображається за допомогою рівнянь, описаних у розділі Методи. (b) Зміни частки вільного NADH та (c) частки видів LLS для дієти з низьким вмістом жиру (чорний) та західної (червоний) відповідно. Смужки помилок на панелях b і c відповідають стандартному відхиленню 9 незалежних проб для кожного режиму дієти, а суцільні лінії відповідають середньому показнику 9 незалежних проб для кожного стану.
Враховуючи експериментальну точку координат g та s (чорна крапка, рис. 2 (а)), якщо у зразку присутні лише 3 види (вільні та зв’язані NADH та LLS), точка повинна потрапляти у трикутник із червоним, зеленим та сині куточки. Потім за правилом додавання фазору використовували для визначення відносної кількості зв’язаної з вільною фракцією NADH та LLS наступного способу. Проведено лінію, що проходить через червону та чорну крапки, і ця лінія перехоплюється лінією між зеленою та синьою крапками. Точка перехоплення використовується для визначення відносної концентрації зв’язаного зі вільним за допомогою коефіцієнта
Фракцію LLS отримували з використанням співвідношення
Ми використали це розкладання для перетворення розподілу фазових точок у розподіл вільного та зв’язаного NADH. Співвідношення вільного та зв’язаного НАДН пов’язане із співвідношенням НАД +/НАДН у тканині, а отже, розподіл вільного та зв’язаного НАДН є мірою змін у метаболізмі. Після віднімання ефекту видів LLS можна порівняти справжній розподіл вільного до зв’язаного NADH із західних зразків та з низьким вмістом жиру та оцінити зміни в метаболізмі.
2.3.4 Багатопараметричний аналіз розподілу фазорів
Розподіл фазових точок, що походять від зображення FLIM, є відбитком пальця зображення і характерним для відповідного зображення. Різниця у розподілі фазорів між різними наборами даних часто відрізняється зміною середнього положення фазових точок. Однак часто середнього положення недостатньо для опису змін розподілу фазорів. Раніше ми розробили мультипараметричний підхід для аналізу розподілу фазорів [30]. Для роз'яснення аналізу, використаного в роботі, цей підхід ще раз описаний нижче. Спочатку гістограма у розподілі фазорів ділиться на чотири рівні висоти на основі максимальної висоти гістограми розподілу фазорів. Тоді для кожного сегмента розраховується п’ять параметрів, включаючи середнє (g), середнє (s), довжину (a) та ширину (b) розподілу (розглядаючи це як еліпс) та кут розподілу (θ) на основі просторовий момент розподілу.
Просторовий момент розподілу розраховували за окремими положеннями фазових точок:
де I (g, s) - значення гістограми фазора в положеннях g і s. Потім центральний момент обчислюється, використовуючи таке співвідношення:
де p, q та f (g, s) - індекси, що вказують на ранг моменту відповідно. Цей аналіз використовує моменти до 2-го рангу.
Кут обчислюється за допомогою:
Нарешті, форма розподілу обчислюється на основі величини головної (а) та малої осі (б):
Потім ці множинні параметри поєднували, щоб створити спектр, який відповідає певному розподілу фазорів. Нарешті, два різні набори розподілу фазорів, що належать до західної дієти та зображень печінки з низьким вмістом жиру, порівнюються, додаючи набір параметрів підгонки для кожного з компонентів. Як тільки значення цих параметрів підгонки визначено для найкращого розділення західної дієти та дієти з низьким вмістом жиру, крива робочої характеристики приймача (була розрахована крива ROC та різні статистичні параметри, включаючи площу під кривою (значення AUC), істинне та хибне можна розрахувати позитивні показники, чутливість та швидкість позитивного прогнозування та порівняти різні зразки тканин [30]. Представлені тут дані використовували параметри g, s, a, b для порівняння.
2.3.5 Мікроскопія третьої гармоніки
Генерація третьої гармоніки є результатом різких змін показника заломлення на кордонах тканин. У цьому процесі випромінюване світло має третину довжини хвилі порівняно з довжиною хвилі збудження. У тканинах спостерігається велика зміна показника заломлення на межі крапель ліпідів, і ці краплі генерують сильний сигнал ТГГ [27]. У цій роботі THG було використано, щоб показати, що види LLS на знімках FLIM перекриваються з краплями ліпідів. Це спеціально показано для збільшених зображень для дієтичної печінки з низьким вмістом жиру, де збільшені зображення показують, що ці маленькі плями LLS насправді належать до крапель ліпідів.
2.3.6 Фіброз зображення з генерацією другої гармоніки
3. Результати
3.1 Розрахунок розміру краплі
Зображення інтенсивності флуоресценції показано на рис. 1 (а). Ці зображення FLIM були нанесені на кольори (рис. 1 (b)) після того, як вид довгих років життя (LLS) на фазовій ділянці був обраний червоним курсором (рис. 1 (d)). Порівняння між цими кольоровими FLIM-зображеннями та зображеннями третьої гармоніки (рис. 1 (c)) показує, що LLS насправді перекривається із сигналом THG, доводячи, що види LLS присутні в краплях ліпідів. Зразки з дієтою з низьким вмістом жиру (LF) були збільшені (FOV 90 мкм), щоб показати, що LLS насправді збігається з сигналом THG. На малюнку 1 (b) представлені репрезентативні зображення FLIM із західної та нежирної дієти відповідно. Це порівняння також показує, що розмір крапель набагато більший для західних дієтичних мишей. Також показано порівняння розмірів за допомогою гістограми та графічного поля (рис. 1 (е), 1е). Діаграма наочно показує, що середні розміри крапель ліпідів набагато більші, ніж розміри крапель нежирних дієтичних мишей. Гістограми показують, що краплі жиру мають загальний розподіл за розмірами. Однак більші краплі є лише у західних дієтичних мишей. Середні показники восьми зображень для шести тварин наведені на рис. 1 (e), а стандартне відхилення зображень було використано для бокс-ділянки.
3.2 3-компонентний фазовий аналіз
3.3 Багатопараметричний аналіз
Багатопараметричний індекс поділу з використанням фазового розподілу як відбитка пальця на зображеннях тканин показано на рис. 3 (а). Параметри, що використовувались для поділу, включали середнє значення g, s, a, b. На малюнку 3 (а) показано поділ між зразками мишей з низьким вмістом жиру (чорні) та західними дієтичними (червоними). У цьому методі найкраще розділення досягається, коли червоні точки не перекриваються темно-сірими; розділення дуже добре, і ступінь відокремлення видно з області під кривою (рис. 3 (b)), яка дорівнює 1,0. Високе значення AUC визначає поділ, досягнутий аналізом форми фазового графіку між дієтами, і це передається такими статистичними параметрами, включаючи точність (0,98), специфічність (0,97), чутливість (1,00), значення позитивного прогнозу (0,96) та істинно/помилково позитивний коефіцієнт (1,00/0,03).
- Як дієта впливає на функцію мозку Біострап
- Виявлення неалкогольних жирових захворювань печінки з активним фіброзом шляхом вимірювання
- Функція печінки та некроз печінки через недостатню дієту SpringerLink
- Міккі Мехта Ми прийняли західні дієтичні тенденції замість індійських - Lifestyle News
- Інгібуюча дія екстракту жимолості блакитної на жирову печінку, спричинену дієтами, у мишей