Викид кортизолу, стимульований CRH, і прийом їжі у здорових дорослих людей, що не страждають ожирінням
Зараз доктора Хан можна отримати за адресою:, Відділ аналізу та досліджень медичної інформації, Відділ охорони здоров’я перших націй та інуїтів, Jeanne Mance Bldg (Rm. 1964C), Health Canada, Tunney’s Pasture, Ottawa, ON K1A 0K9
Резюме
Передумови
Існують значні анекдотичні та деякі наукові докази того, що стрес викликає харчову поведінку, але основні фізіологічні механізми залишаються невизначеними. Вісь гіпоталамус-гіпофіз-наднирники (ГПА) є ключовим посередником фізіологічних реакцій на стрес і може відігравати роль у зв'язку між стресом та прийомом їжі. Реакції кортизолу на лабораторні стресори передбачають споживання, але незрозуміло, чи такі реакції вказують на вразливість до їжі, пов’язаної зі стресом, чи кортизол безпосередньо стимулює харчування у людей.
Методи
Ми вливали здоровим дорослим кортикотропін-вивільняючий гормон (CRH) у дозі, яка суб'єктивно не виявляється, але викликає стійку реакцію ендогенного кортизолу, і вимірювали подальше споживання закусочних продуктів, дозволяючи аналізувати вплив реактивності HPA на прийом їжі без складних психологічних ефектів парадигма стресу.
Результати
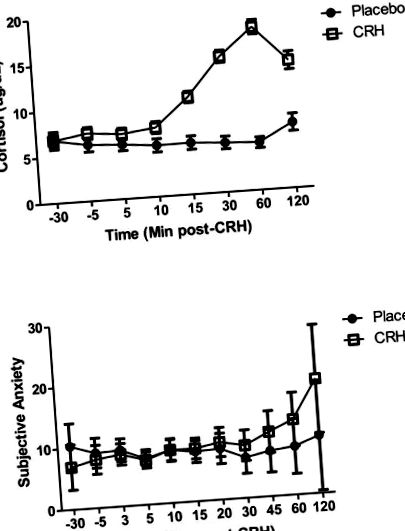
CRH підвищував рівень кортизолу відносно плацебо, але не впливав на суб’єктивний тривожний дистрес. Суб'єкти їли більше після CRH, ніж після плацебо, а пікова відповідь кортизолу на CRH була сильно пов'язана як з споживанням калорій, так і із загальним споживанням.
Висновки
Ці дані показують, що реактивність осі HPA на фармакологічну стимуляцію передбачає подальше споживання їжі і припускають, що сам кортизол може безпосередньо стимулювати споживання їжі у людей. Розуміння фізіологічних механізмів, що лежать в основі їжі, пов’язаної зі стресом, може виявитися корисним у спробах атакувати кризи громадського здоров’я, спричинені ожирінням.
Вступ
Взаємозв'язок між стресом і апетитом складний. Стрес може як збільшити, так і зменшити споживання їжі (Levine and Morley 1981; Morley et al., 1983) і може сприяти ожирінню та анорексії. Апетитна реакція на стрес формується цілим рядом фізіологічних та психологічних процесів. З'являється все більше доказів про вплив певних психосоціальних факторів у спричинене стресом харчування (Grunberg and Straub 1992; O'Connor et al., 2008; Oliver et al., 2000; Stone and Brownell 1994; Wardle et al., 2000; Weinstein та ін., 1997), але менше відомо про основні фізіологічні механізми. Вісь гіпоталамус-гіпофіз-наднирники (ГПА) є головним посередником фізіологічних реакцій на стрес і може відігравати роль у зв'язку між стресом та прийомом їжі. У відповідь на сприйняття загрози чи виклику, вивільнення кортикотропіну (CRH) вивільняється з гіпоталамуса, викликаючи викид адренокортикотропного гормону (ACTH) з гіпофіза, а потім вивільнення глюкокортикоїдів (GC) з кори надниркових залоз (Tsigos and Chrousos 2002). Глюкокортикоїди (кортизол у людей, кортикостерон у тварин) підвищують доступність глюкози через розщеплення білків, глюконеогенез та ліполіз, полегшуючи адаптацію за рахунок мобілізації енергії.
Глюкокортикоїди також впливають на поведінку і можуть надалі впливати на доступність енергії, змінюючи споживання їжі. У людей хронічне введення ГХ збільшує споживання їжі за умови необхідності (Tataranni et al., 1996). На моделях на тваринах ГК впливають на споживання калорій за допомогою прямих нейрофармакологічних ефектів (Dallman et al., 2007), і показано, що кортикостерон залежно від дози збільшує споживання смачних продуктів, таких як сахароза, сахарин (Bhatnagar et al., 2000) та сало (la Fleur et al., 2004). Ці висновки можуть мати значення для сучасної епідемії ожиріння - повторне вивільнення ГХ, пов’язане зі стресом, може спричинити надмірне споживання висококалорійної їжі та сприяти збільшенню ваги. Дійсно, було показано, що тваринам, схильним до ожиріння, потрібні циркулюючі глюкокортикоїди, щоб це могло статися (Bray 1985), а антагонізм рецепторів GC запобігає або зменшує збільшення ваги у цих тварин (Okada et al., 1992). Цікаво, що у людей існує також зв'язок між підвищеною реакцією осі ГПА на стрес та абдомінальним ожирінням (Epel et al., 1999; Epel et al., 2000; Pasquali et al., 1993; Pasquali et al., 1999).
Таким чином, вивільнення ГК, ключового кінцевого продукту активації стресу, виробляє фізіологічні ефекти, які потенційно можуть впливати на доступність енергії, апетитну поведінку та підтримку ожиріння. Підвищений рівень ГК у відповідь на стрес також може бути ознакою, пов’язаною з абдомінальним ожирінням. Однак, незважаючи на ці дані, прямий зв’язок між стимуляцією осі HPA та збільшенням споживання їжі у людей не продемонстровано. Є дані про зв’язок між реактивністю на стрес та споживанням їжі, оскільки реакція кортизолу на лабораторний стрес передбачає збільшення споживання, особливо висококалорійної їжі, у групі здорових дорослих жінок (Epel et al., 2001), а також передбачав зв'язок між екологічно виміряними щоденними клопотами та збільшенням перекусів (Newman et al., 2007). Цікаво, що в першому дослідженні споживання було суттєво пов’язане з реакцією кортизолу відразу після стресу, але не з загальним секретованим кортизолом, що свідчить про важливість реактивності на стрес.
Однак з цих досліджень важко визначити, чи відповідає реактивність на стрес HPA окремим фактором вразливості, що сприяє пов’язаному зі стресом харчуванню, не пов’язаному з підвищеним споживанням, чи глюкокортикоїди безпосередньо стимулюють харчову поведінку у людей, як це відбувається у тварин . Хоча причинно-наслідковий зв'язок, можливо, можна було б безпосередньо оцінити шляхом гострого введення глюкокортикоїдів та вимірювання споживання їжі, екзогенне введення лікарських засобів має численні відмінності від ендогенного вивільнення і не могло б паралельно викликати стрес-індуковане вивільнення глюкокортикоїдів, яке зазвичай відбувається через стимуляцію гіпофіза. У цьому дослідженні ми досліджували, чи може ендогенний викид кортизолу, викликаний безпосередньою стимуляцією гіпофіза, за відсутності психологічного стресу, сприяти збільшенню споживання їжі. Ми зробили це, вливши здоровим людям, які не страждають ожирінням, CRH у дозі, яка суб’єктивно не виявляється (не викликає стресу та тривоги) та вимірюючи подальше споживання їжі.
Методи
Предмети
Чотирнадцять випробовуваних (8 жінок, 6 чоловіків) у віці від 18 до 42 років (у середньому 23,3 ± 6,2) років були набрані за допомогою реклами та перевірені за допомогою Структурованого клінічного інтерв'ю для DSM-IV. Вони були медично здоровими, не мали в анамнезі психічних захворювань, наркотичної або алкогольної залежності, нещодавно (6 місяців) зловживання наркотиками, алкоголем або тютюном та повідомляли про низький рівень вживання тютюну та алкоголю. Випробовувані мали негативні скринінги лікарських препаратів із сечею та нормальні скринінгові лабораторні результати і знаходились у межах +30%/- 10% від ідеальної маси тіла (середнє значення 69,4 ± 10,6 кг). Жінки були в менопаузі, не використовували протизаплідні таблетки, не були вагітними та годували груддю, і їх вивчали протягом 10 днів від початку менструації. Випробовувані надавали письмову, поінформовану згоду та отримували по 200 доларів США кожному. Дослідження було схвалено нашою Інституційною комісією з огляду.
Дизайн та процедури
Випробовувані двічі повідомляли до Загального клінічного дослідницького центру (GCRC) та отримували внутрішньовенні ін’єкції плацебо (0,9% фізіологічного розчину) та овельної CRH (0,3 мкг/кг; Acthrel, Ferring Pharmaceuticals, Tarrytown, NY), розділених від 1 до 7 днів. Вісім суб'єктів отримували плацебо спочатку, а шість - CRH. Їм сказали, що вони можуть отримати будь-яку речовину під час обох візитів. Суб'єкти та медсестри GCRC були сліпими до стану.
Суб'єкти, про які повідомляється для дослідження о 13:00 год. Слідчий повністю описав процедури та загальні побічні ефекти CRH. Випробовуваних супроводжували до GCRC, де внутрішньовенний катетер (сольовий крапельниця) вводили в антекубітальну вену в
1330 год. Випробовувані відпочивали в ліжку 1,5 години, читаючи чи дивлячись телевізор, щоб адаптуватися до обстановки. Базові зразки крові отримували через 1500h та 1525h. О 15:30 год. Слідчий повернувся (за завісу, поза свідомістю випробуваного), щоб ввести фізіологічний розчин або ХРН протягом 10 секунд. CRH готували за годину до ін'єкції та охолоджували до використання. Кров відбирали у крижані вакуумні пробірки через 5, 10, 15, 30, 60 та 120 хвилин після введення препарату, віджимали у холодильній центрифузі протягом 5 хвилин, відокремлювали та заморожували (-70 ° C).
Заходи та аналізи
Емоційні симптоми реєстрували під час кожного зразка крові за допомогою візуальних аналогових шкал (VAS), що вимірюють стан відчуття на 100-міліметрових лініях ("зовсім не" до "найчастіше"). Первинною залежною змінною було суб'єктивне тривожне переживання, розраховане із використанням суми оцінок VAS "тривожний", "нервовий" та "страшний". Кортизол аналізували за допомогою аналізу Coat-A-Count від Diagnostic Products Corporation (Лос-Анджелес, Каліфорнія). Чутливість становила 0,2 мкг/дл. Коефіцієнти варіації були менше 10%.
Аналіз
Для оцінки впливу CRH (порівняно з плацебо) на кортизол та суб’єктивні реакції використовували двофакторний аналіз дисперсії повторних вимірювань (Time X Drug) (RM-ANOVA). Однак нашим головним інтересом є вплив кортизолу на споживання їжі, і це було досліджено за допомогою RM-ANOVA у суб'єктів, щоб порівняти споживання їжі після CRH з їжею, з'їденою після плацебо. Нашою основною залежною змінною було споживання, виміряне в калоріях, але ми також вивчали загальне споживання в грамах у підтверджуючих аналізах. Взаємозв'язок між споживанням їжі та рівнем кортизолу вивчали далі, регресуючи споживання їжі за піком реакції кортизолу (максимум після CRH мінус середнє базове значення) та рівнем кортизолу під час прийому їжі (120 хвилин після інфузії) за допомогою кореляцій Пірсона.
Результати
A. Відповіді кортизолу на CRH або ін’єкцію плацебо (середнє значення ± SE); B. Суб’єктивний рейтинг тривожності після ін’єкції CRH або плацебо (середнє значення ± SE).
A. Взаємозв'язок між реакцією кортизолу на ХГС та кількістю споживаних калорій; B. Взаємозв'язок між реакцією кортизолу на CRH та кількістю споживаної їжі.
Обговорення
Низькі дози введення CRH суттєво збільшили споживання їжі порівняно з ін’єкцією плацебо у здорових дорослих людей, які не страждають ожирінням, як вимірюється як калоріями, так і загальним обсягом споживаних грамів. Величина пікової реакції кортизолу на CRH була сильним предиктором подальшого прийому їжі. Ці дані поширюють все більше свідчень про зв'язок між системами реагування на стрес та харчовою поведінкою людини, припускаючи, що активність в межах осі HPA - наша центральна нейроендокринна система реакції на стрес - нейробіологічно пов'язана із споживанням їжі.
Попередні людські роботи показали, що величина реакції HPA на психосоціальний лабораторний стрес пов'язана з більшим споживанням їжі (Epel et al., 2001), а також передбачає реальне життя, пов'язане зі стресом, харчування протягом наступних днів (Newman et al., 2007). Однак жодне з цих досліджень не змогло безпосередньо пов'язати активність осі HPA із збільшенням споживання їжі. У першому дослідженні для активації осі HPA використовували інтенсивний психосоціальний стрес, але не було відомо, чи викликали інші, негормональні аспекти стресу як збільшення викиду кортизолу, так і збільшення споживання. У другому дослідженні величина реактивності HPA на подібний психосоціальний стресор передбачала збільшення прийому їжі в поєднанні з щоденними клопотами протягом наступних днів, але в цьому випадку реактивність HPA, можливо, означала вразливість до їжі, пов’язаної зі стресом. Не було зібрано даних про рівень кортизолу під час прийому їжі, і література суперечлива щодо того, чи задокументовані типи клопотів можуть спричинити достатнє вивільнення кортизолу для стимулювання харчової поведінки (Dickerson and Kemeny 2004; van Eck et al., 1996 ). Тому в обох випадках механізми, що пов'язують реактивність стресу з харчовою поведінкою, залишаються незрозумілими.
Дані як про тварин, так і про інших людей підтверджують пряму роль глюкокортикоїдів у регуляції апетиту. Введення ГК може збільшити споживання їжі (Bell et al., 2000; Bhatnagar et al., 2000; la Fleur et al., 2004; Tataranni et al., 1996), що найбільш помітно збільшує споживання смачних страв. Підвищений рівень глюкокортикоїдів асоціюється із збільшенням секреції інсуліну (Strack et al., 1995). Сукупний вплив глюкокортикоїдів на споживання їжі з високою енергетичною щільністю та підвищена ймовірність того, що споживана енергія буде зберігатися як жир у присутності інсуліну, означає, що гіперактивність HPA може бути механізмом, за допомогою якого ожиріння як виникає, так і надалі підтримується. Недавнє дослідження показало, що люди, які харчуються у відповідь на стрес, демонструють як підвищений нічний інсулін, так і кортизол (Epel et al., 2004), а також високий рівень збільшення ваги. Отже, люди, які їдять стрес, можуть зазнати особливо великого ризику для розвитку та підтримання ожиріння та пов’язаних із цим проблем зі здоров’ям.
Точний механізм, що пов'язує прийом їжі з реактивністю кортизолу як в психосоціальній (Epel et al., 2001), так і в парадигмах виклику CRH, ще потрібно з'ясувати, але сучасні дані підтверджують гіпотезу про те, що сам кортизол може відігравати причинну роль у збільшенні споживання їжі. Очевидно, необхідне подальше вивчення, щоб повністю зрозуміти механізми, що лежать в основі, але така робота може виявитися корисною в спробах атакувати важкі кризи громадського здоров'я, породжені ожирінням.
Виноски
Заява видавця: Це PDF-файл нередагованого рукопису, який прийнято до друку. Як послуга для наших клієнтів ми надаємо цю ранню версію рукопису. Рукопис пройде копіювання, набір версій та перегляд отриманого доказу, перш ніж він буде опублікований у остаточній формі. Зверніть увагу, що під час виробничого процесу можуть бути виявлені помилки, які можуть вплинути на вміст, і всі юридичні застереження, що стосуються журналу, стосуються.
- Швидке харчування як сімейне харчування обмежує споживання здорової їжі, збільшує ризик ожиріння - ScienceDaily
- Вплив форми їжі та строків прийому їжі на апетит та споживання енергії у худих молодих людей та
- Фруктові закуски - це здорова мережа харчування Здорова їжа Рецепти, ідеї та продовольчі новини Продовольча мережа
- Шоколадні профітролі - Керівництво з здорової їжі
- Вибирайте дієтичну їжу для схуднення, корисні соки, органічний мед - ZOE