Відсутність тау викликає вікові залежні морфофункціональні дефіцити сідничного нерва та рухові порушення
Софія Лопес
1 Науково-дослідний інститут наук про життя та здоров’я (ICVS), Школа наук про здоров’я, Університет Мінью, Кампус Гуальтар, 4710‐057, Брага, Португалія
2 ICVS/3B - Урядова асоційована лабораторія ПТ, Брага/Гімарайнш, Португалія
Андре Лопес
1 Науково-дослідний інститут наук про життя та здоров’я (ICVS), Школа наук про здоров’я, Університет Мінью, Кампус Гуальтар, 4710‐057, Брага, Португалія
2 ICVS/3B - Урядова асоційована лабораторія ПТ, Брага/Гімарайнш, Португалія
Вітор Пінто
1 Науково-дослідний інститут наук про життя та здоров’я (ICVS), Школа наук про здоров’я, Університет Мінью, Кампус Гуальтар, 4710‐057, Брага, Португалія
2 ICVS/3B - Урядова асоційована лабораторія ПТ, Брага/Гімарайнш, Португалія
Марко Р. Гімарайнш
1 Науково-дослідний інститут наук про життя та здоров’я (ICVS), Школа наук про здоров’я, Університет Мінью, Кампус Гуальтар, 4710‐057, Брага, Португалія
2 ICVS/3B - Урядова асоційована лабораторія ПТ, Брага/Гімарайнш, Португалія
Ванесса Мораїс Сардінья
1 Науково-дослідний інститут наук про життя та здоров’я (ICVS), Школа наук про здоров’я, Університет Мінью, Кампус Гуальтар, 4710‐057, Брага, Португалія
2 ICVS/3B - Урядова асоційована лабораторія ПТ, Брага/Гімарайнш, Португалія
Сара Дуарте ‐ Сільва
1 Науково-дослідний інститут наук про життя та здоров’я (ICVS), Школа наук про здоров’я, Університет Мінью, Кампус Гуальтар, 4710‐057, Брага, Португалія
2 ICVS/3B - Урядова асоційована лабораторія ПТ, Брага/Гімарайнш, Португалія
Сара Пінейро
1 Науково-дослідний інститут наук про життя та здоров’я (ICVS), Школа наук про здоров’я, Університет Мінью, Кампус Гуальтар, 4710‐057, Брага, Португалія
2 ICVS/3B - Урядова асоційована лабораторія ПТ, Брага/Гімарайнш, Португалія
Жоао Пісарро
1 Науково-дослідний інститут наук про життя та здоров’я (ICVS), Школа наук про здоров’я, Університет Мінью, Кампус Гуальтар, 4710‐057, Брага, Португалія
2 ICVS/3B - Урядова асоційована лабораторія ПТ, Брага/Гімарайнш, Португалія
Жоао Філіпе Олівейра
1 Науково-дослідний інститут наук про життя та здоров’я (ICVS), Школа наук про здоров’я, Університет Мінью, Кампус Гуальтар, 4710‐057, Брага, Португалія
2 ICVS/3B - Урядова асоційована лабораторія ПТ, Брага/Гімарайнш, Португалія
Нуно Соуза
1 Науково-дослідний інститут наук про життя та здоров’я (ICVS), Школа наук про здоров’я, Університет Мінью, Кампус Гуальтар, 4710‐057, Брага, Португалія
2 ICVS/3B - Урядова асоційована лабораторія ПТ, Брага/Гімарайнш, Португалія
Уго Лейте-Алмейда
1 Науково-дослідний інститут наук про життя та здоров’я (ICVS), Школа наук про здоров’я, Університет Мінью, Кампус Гуальтар, 4710‐057, Брага, Португалія
2 ICVS/3B - Урядова асоційована лабораторія ПТ, Брага/Гімарайнш, Португалія
Іоанніс Сотіропулос
1 Науково-дослідний інститут наук про життя та здоров’я (ICVS), Школа наук про здоров’я, Університет Мінью, Кампус Гуальтар, 4710‐057, Брага, Португалія
2 ICVS/3B - Урядова асоційована лабораторія ПТ, Брага/Гімарайнш, Португалія
Резюме
Вступ
Клінічна картина хвороби Альцгеймера (БА) є складною і виходить далеко за рамки когнітивних порушень, що характеризують це розлад (Duker et al., 2012). Зміни виразів обличчя, ходи та постави, прояви ригідності, брадикінезії та тремору виявляються на пізніх стадіях БА, хоча все більші дані свідчать про те, що моторні проблеми виникають задовго до будь-якого впізнаваного ознаки БА (Wilson et al., 2000; Scarmeas et al. ., 2004; Buchman & Bennett, 2011). Аномальне гіперфосфорилювання та наступні збої функціонують як ключові механізми нейрональної дисфункції АД, коли гіперфосфорильовані та/або агреговані (нерозчинні) форми тау виявляють нейродегенеративні дії, які також перешкоджають нормальному тау, секвеструючи та зменшуючи розчинні форми тау (Ксіезак-Редінг) та ін., 1988; Жукарєва та ін., 2003). Ці ураження в основному виявляються в різних областях ЦНС, таких як гіпокамп і кора головного мозку, хоча деякі дослідження також демонструють наявність дефіциту Тау в периферичній нервовій системі (ПНС; наприклад, вегетативні ганглії та сідничний нерви Bohl et al., 1997; Holzer et al., 1999). Хоча дані свідчать про те, що зменшення тау може блокувати прогресування патології АД (Roberson et al., 2007), вказуючи на те, що стратегії, спрямовані на тау, можуть представляти інтерес для терапії AD (Gotz et al., 2012), безпеку та/або потенційний побічний ефект ці підходи недостатньо вивчені.
Здається, генетична делеція тау добре переноситься молодими тваринами, оскільки більшість моделей Tau -/- не демонструють поведінкових змін або змін мікротрубочок (Dawson et al., 2001; огляд Ke et al., 2012). Однак хронічна втрата тау, як було описано, призводить до незначних або легких рухових дефіцитів у тварин, що старіють у віці (оглянуто Gotz et al., 2013). Дійсно, одне дослідження виявило втрату дофамінергічних нейронів чорної субстанції (SN) у тварин тау -/- середнього віку (Lei et al., 2012), в той час як в іншому дослідженні використовували вік тау -/- того самого штаму, подібного двигуна були виявлені дефіцити, але незалежно від SN-/дофаміну (Morris et al., 2013), що підвищує невизначеність основних механізмів рухових дефіцитів у тварин тау -/-. Дивно, але участь ПНС не оцінювалося в жодному з попередніх досліджень, враховуючи той факт, що зниження тау виявляється в периферичних нервах (наприклад, сідничному нерві) пацієнтів з АД (Holzer et al., 1999). Отже, це дослідження мало на меті відстежувати вплив хронічної втрати білка Тау на еферентні властивості ПНС, первинний відсік моторної схеми та моторні показники за допомогою батареї поведінкових тестів, що аналізують рухову функцію як у молодих (4–6 місяців), так і у старших (17– 22 місяці) миші тау -/- у поєднанні із систематичним морфофункціональним аналізом сідничного нерва.
Результати
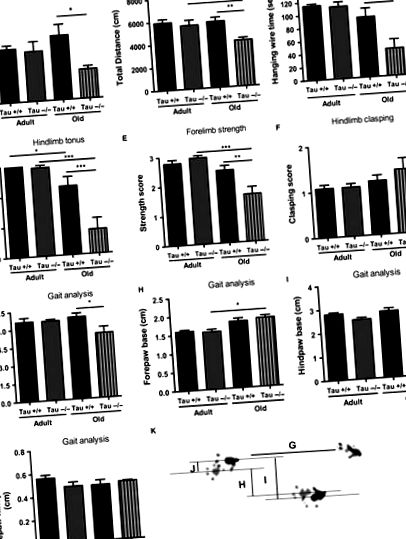
Хронічна відсутність тау призводить до дефіциту рухів у старих тварин
Механізми, що лежать в основі порушення рухової поведінки за відсутності тау у людей похилого віку, не повністю зрозумілі, повідомляються суперечливі висновки. Лей та ін. (2012), наприклад, повідомляли про вікову втрату дофамінергічних нейронів SN у тварин тау -/- середнього віку. На відміну від цього, нещодавнє дослідження на тій самій лінії Tau -/- не змогло спостерігати жодної великої дофамінергічної втрати в різних рухових компонентах ЦНС старих мишей Tau -/- (Morris et al., 2013). Хоча обидва дослідження показали руховий дефіцит, Lei et al. (2012) продемонстрували втрату нігростріалу у мишей Tau -/- середнього віку з фоном C57BL/6/SV129, тоді як наше дослідження та дослідження Morris et al. (2013) не виявили втрати нейростріальних нейронів у старих мишей із фоном C57BL/6 (дані не наведені). Крім того, у наступному дослідженні Lei et al. (2014) показали, що руховий дефіцит старих тау -/- тварин не залежить від походження або має залежний від статі профіль. Відповідно до цього, незважаючи на той факт, що в нашому дослідженні використовувались самці тварин, а в дослідженні Морріса (2013) використана змішана (чоловіча та жіноча) когорта, обидва дослідження демонструють рухові дефіцити, що надалі підтверджують відсутність гендерного впливу в старому Тау -/- рухові дефіцити.
Хоча низка областей ЦНС причетна до виникнення пов'язаних з АД рухових дефіцитів, мало уваги приділяється первинним еферентним ефектам ПНС. Попередні дані свідчать про те, що сідничні нерви пацієнтів з АД, але не з урахуванням віку здорових людей, мають знижений рівень Тау (Holzer et al., 1999). У нашому дослідженні ми демонструємо, що хронічна втрата білка Тау призводить до морфофункціональних дефіцитів сідничного нерва, що включає збільшений відсоток дегенеруючих волокон, гіпомієлінізацію великих діаметрів, пов'язаних з рухом волокон, та зниження провідних властивостей у старих, але не молодих, тау-/- сідничний нерв. Хоча інші механізми не можна виключати, вищезазначені дефіцити сідничного нерва можуть критично сприяти дефіциту рухів, виявленому в старому Тау -/-, оскільки тонка настройка товщини і утворення мієлінової оболонки є важливою для підтримки та належної роботи рухових волокон. Крім того, хоча не виявлено амплітудних різниць у потенціалах дії м’язів Тау -/-, необхідні подальші дослідження для з’ясування впливу втрати Тау на нервово-м’язовий зв’язок через старіння, оскільки патологія, пов’язана з Тау, в нервово-м’язових нейронах несправність переходів і дефіцит двигуна в моделях AD Tg (Zhang et al., 2005; Ubhi et al., 2007).
Експериментальні процедури
Тварини
У цьому дослідженні використовувались чоловіки Тау +/+ та Тау -/- від 4 до 6 та від 17 до 22 місяців (Dawson et al. (2001); C57BL/6 background). Мишей утримували по 4–5 тварин у клітці за стандартних умов навколишнього середовища з вільним доступом до їжі та води. Усі експериментальні процедури були затверджені місцевим етичним комітетом та національним органом для експериментів на тваринах та відповідали керівним принципам по догляду та поводженню з лабораторними тваринами, як описано в Директиві 2010/63/ЄС.
Тести поведінки
Аналіз ультраструктури сідничного нерва
Під глибокою анестезією [кетамін гідрохлорид (75 мг кг -1) та медетомідин (1 мг кг -1)] сідничні нерви були зібрані та негайно зафіксовані в 4% глутаральдегіді (в 0,1 м натрієвому какодилатному буфері, рН 7,4) протягом 7 днів і кімнатної температури, а потім постфіксують в 1% OsO4, зневоднюючи. Нарешті, тканина була вбудована в епонову смолу (Electron Microscopy Sciences) і розділена відповідно до мети (див. Нижче). Поперечні зрізи в один мікрометр, що охоплюють всю область поперечного перерізу нерва, фарбували 1% п-фенілендіаміном і встановлювали на Entellan (Merk). Потім зображення світлового мікроскопа (Olympus DP70, Гамбург, Німеччина) встановлювали на Photoshop і використовували для ручного розрахунку кількості та щільності мієлінованих волокон на поперечний зріз (4–5 тварин на групу). Для оцінки вироджених волокон було використано 16 фотографій ПЕМ, що не перекриваються (3000 ×), надто тонких зрізів (60 нм) (отриманих за допомогою JEM ‐ 1400 TEM). Ті самі зображення ТЕМ також використовувались для розрахунку g-співвідношення [діаметр аксона/(діаметр аксона + товщина мієліну)]; на одну тварину вимірювали більше ста волокон. Морфометричний аналіз проводився експериментатором, незрячим до провідності зразків.
Вимірювання потенціалу дії сполук ex vivo
Гостроізольовані сідничні нерви від кожної групи (6–8 тварин на групу) використовувались для оцінки швидкості провідності A- і C-волокон та потенціалу дії сполук, як описано раніше (Pinto et al., 2008). Коротко кажучи, сідничний нерв розтинали та очищали від сполучнотканинної оболонки у штучній лікворі. Записи потенціалів складної дії були зроблені за допомогою підсилювача Multiclamp 700B в режимі CC та оцифровані за допомогою цифрового дигітайзера Digidata 1440a за допомогою програмного забезпечення PCLAMP 10 (Axon Instruments, Саннівейл, Каліфорнія, США). Сигнали фільтрували на низьких частотах з ефективною кутовою частотою 16 кГц і відбирали проби на частоті 50 кГц. Волокна стимулювали при 60 мкс, і розраховували швидкості провідності для першого піку потенціалів дії сполуки; загальна площа була розрахована за допомогою програмного забезпечення CLAMPFIT (Axon Instruments). Електрофізіологічні записи та аналізи проводив експериментатор, сліпий до провінції тканини.
Електрофізіологічні вимірювання in vivo
Вестерн-блот-аналіз
Тау -/- і Tau +/+ сідничні нерви були гомогенізовані [10 мм HEPES pH 7,9, 150 мм NaCl, 1 мм EGTA, 1 мм ЕДТА, 10% гліцерин, 1% NP ‐ 40, повний інгібітор протеази (Рош, Мангейм, Німеччина ) та коктейлі інгібітора фосфатази II та III (Sigma, Сент-Луїс, Міссурі, США)]. Після обробки ультразвуком та центрифугування (15 000 г; 10 хв; 4 ° C) вміст білка оцінювали за методом Бредфорда, а лізати електрофорезували на 10% акриламідних гелях і переносили на нітроцелюлозні мембрани (BIORAD Turbo, Мюнхен, Німеччина). Для виявлення рівнів MBP мембрани блокували у забуференному Tris сольовому розчині, що містить 5% знежиреного молока в TBS-T перед інкубацією з антитілами проти MBP (Serotec, Оксфорд, Великобританія; 1: 500), Tau (abcam, Cambridge, UK; 1: 1000) та актину (DSHB, Університет Айови, ІА, США; 1: 2000). Антигени були виявлені за допомогою посиленої хемілюмінесценції (BIORAD) після інкубації з відповідними кон’югатами пероксидази хрена – імуноглобулін G (BIORAD). Плямки сканували та кількісно визначали за допомогою програмного забезпечення для візуалізації tina 3.0 (Raytest, Штраубенхардт, Німеччина). Всі значення були нормалізовані щодо актину.
Статистичний аналіз
Якщо не вказано інше, використовували двосторонній ANOVA, який мав генотип (Тау +/+ проти Тау -/-) та старіння (дорослий проти старого) як фактори, а також послідовний аналіз Тукі (SPSS, Aspire Software, Armonk, NY, США). Відмінності вважали суттєвими, якщо p Bohl J, Ulbricht D, Steinmetz H (1997) Нейрофібрилярні клубки в периферичних вегетативних клітинах гангліїв при хворобі Альцгеймера: біологія, діагностика та терапія (Iqbal K, Winblad B, Nishimura T, Takeda M, Wisniewski, ред.). Чічестер: John Wiley & Sons, стор. 281–287. [Google Scholar]
- Відсутність внутрішньомолекулярного переносу заряду з 4-фтор-N, N-диметиланіліном (DMA4F), на відміну від
- Наукові звіти про контроль за відсутністю судом за допомогою інтерфейсу мозку
- Автозапчастини та транспортні засоби Нові моторні заміські болти для снігоочисника на 3 та 9 снігу для автомобілів та вантажівок
- Двостороннє загальне защемлення грудного відділу нерва після надмірної втрати ваги Звіт про випадки та огляд
- Втрата ваги та дозвіл на контурування тіла, які ви; Буду в змозі тримати - здоров’я нервів