Контроль відсутності нападів за допомогою інтерфейсу мозку
Предмети
Анотація
Вступ
Двосторонні генералізовані спайкові та хвильові розряди (SWD), що є електрофізіологічною ознакою відсутності епілепсії, утворюються в межах кортико-таламо-кортикальної мережі 1,2,3. Довгий час вважалося, що SWD непередбачувані і раптово виникають із звичайного фонового ЕЕГ 4. Однак офлайн-аналіз наявних наборів даних ЕЕГ за допомогою передових методів мережевого аналізу виявив внутрішньокіркові та кортико-таламо-кортикальні зміни в мережевій активності, які можна було виявити за 2 секунди до початку SWD 5, 6. SWD також передують короткочасні дельта-тета-попередники в корі та таламусі 7. У цій роботі ми представляємо новий алгоритм прогнозування припадків SWD/відсутність, який в реальному часі оцінює зміни синхронізму між корою та таламусом, які передбачають SWD.
За 0,5 секунди (II) до настання SWD означало, що SWD ось-ось почнеться. Це збільшення енергії вейвлетів відбулося в смузі частот 5–10 Гц (еквівалентний часовий масштаб 0,1–2,2 Гц -1, Δs 1), що означає, що спектральна складова цього ЕЕГ-сигналу починає синхронізуватися між корковими шарами, а також між корою та таламусом.
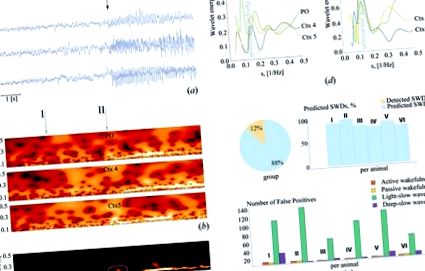
(a) Набір записів ЕЕГ, зроблених із субгранулярних шарів 4 (Ctx4) та 5 (Ctx5) соматосенсорної кори та заднього/бічного ядра таламуса (PO). (b) Енергія вейвлет-перетворення, що відповідає показаним вище ЕЕГ-сигналам і розподіляється в діапазоні часових шкал s = 1 /f, де f - лінійна частота. (c) Отримана поверхня \ (W (s, t) = ^ <> _(s, t) \). Коливальний малюнок, що виникає до настання SWD, який вважається попередником SWD, оточується. (d) Моментальний розподіл енергії вейвлету в діапазоні 5–10 Гц, прийнятий протягом 4 секунд (I) і
0,5 секунди (II) до початку SWD. Лівий малюнок показує, що за 4 секунди до початку SWD лише ЕКГ кортикальної зони виявляють локальну синхронізацію в смузі попередника (тобто місцеве збільшення енергії з'являється на частоті
7 Гц). Енергії вейвлетів коркових ЕЕГ демонструють синхронізоване збільшення (тобто лінії вирівняні одна до одної), тоді як енергія вейвлетів таламічної ЕЕГ не (тобто лінія таламуса зміщена відносно інших). Правий малюнок показує, що при
За 0,5 секунди до початку SWD енергія вейвлету збільшується для всіх трьох каналів. (e) Відсоток передбачених та виявлених SWD протягом 4-годинного запису першої групи з шести щурів WAG/Rij. Пам'ятайте, що жоден SWD не залишався невизначеним за допомогою цього (першого) алгоритму, SWD, які не були передбачені, були швидко виявлені; Кількість помилкових спрацьовувань у різних станах настороженості. Для кожного щура та кожного стану настороженості в кожному записі випадковим чином було обрано 5 сегментів тривалістю 50 секунд для кількісного визначення кількості помилкових тривог.
Ефективність прогнозування нападів алгоритму оцінювали за допомогою ЕЕГ (тривалістю чотири години) щурів WAG/Rij, добре перевіреної генетичної моделі тварини з відсутністю епілепсії, оскільки вони переживають кілька сотень спонтанно виникаючих SWD на день. Вони супроводжуються м’яким міоклонусом обличчя у нерухомої тварини 8. Було виявлено, що алгоритм правильно прогнозував у середньому 88% SWD (діапазон 80–100%), тоді як решта SWD були (рано) виявлені (рис. 1д). Помічено велику кількість хибнопозитивних прогнозів; вони в основному відбувались під час легкого повільного сну, стану настороженості, при якому нейрони дещо гіперполяризовані і мають високий ризик розвитку судом 9. Лише декілька помилкових тривог генерувались під час активного неспання, пасивного неспання та глибокого повільного сну (рис. 1д).
Алгоритм був розширений для того, щоб зменшити кількість помилкових спрацьовувань. Розширення базувалося на одночасному врахуванні енергій вейвлетів двох інших смуг частот, пов’язаних із синхронізованою мозковою діяльністю: \ (>> __> \) (7–20 Гц, діапазон веретен сну, які у щурів мають широкий спектр частот) та \ (> _ \) (діапазон низькочастотних коливань (дельта високої (3–5) Гц, легкий повільний сон)). Прекурсори тепер були автоматично виявлені за допомогою набору логічних умов (детально див. розділ «Методи» та додаткову мал. 3). Це призвело до значного зменшення частоти помилкових тривог на 83% (± 3,3%) ((F (1,10) = 321,35, p Рисунок 2
Ця остання версія алгоритму була згодом реалізована в системі стимуляції глибокого мозку із замкнутим циклом. У цій системі ЕЕГ вільно переміщуються щурів WAG/Rij, записані з двох ділянок кори і таламуса, подавались через підсилювач до системи збору даних. ЕЕГ аналізували з точки зору синхронності в реальному часі за допомогою алгоритму прогнозування. Щоразу, коли рівень синхронності перевищував попередньо встановлене порогове значення, і були задоволені два інші критерії (детальніше див. Розділи «Методи»), у вільному каналі системи збору встановлювали маркер, а стимулятор постійного струму спрацьовував для подачі низької інтенсивності 1 сек. Імпульсного руху 130 Гц до щура (рис. 2а, б). Попередньо встановлене порогове значення виявлення було визначено для кожного окремого щура і коливалось від 0,10 до 0,40 (див. Розділ «ЕЕГ-запис та обробка» для деталей щодо визначення порогу виявлення).
Ми припустили, що імпульсна послідовність 130 Гц повинна запобігати SWD. Це припущення базувалося на нашій попередній роботі, в якій було встановлено, що цей імпульсний механізм був досить ефективним (близько 90%) у перериванні увімкнених SWD 10. Порівняння активності SWD між одночасним початковим записом, при якому не застосовували стимуляцію, та активністю SWD протягом одногодинного сеансу стимуляції показало, що активність SWD знизилася на 72 ± 10% (F (1,5) = 48,52, p 8 Крім того, в записах ЕЕГ тварин під час або після стимуляції не спостерігалося жодного іншого виду аберрантної активності, а враховуючи низьку інтенсивність електричної стимуляції для запобігання та порушення SWD та відносних коротких стимуляційних поїздів, ми припускаємо, що цей тип стимуляції можна вважати відносно безпечною стратегією втручання.
Включення додаткових критеріїв сну мало на меті зменшити кількість помилкових тривог, але також знизило чутливість прогнозування SWD з 88 до 45%. Слід зазначити, що один і той же алгоритм швидко виявив усі інші, непередбачувані SWD. З точки зору виявлення SWD, цей алгоритм досі зберігає чутливість 100% для прогнозування SWD та раннього виявлення взагалі. Включення критеріїв сну також зменшило кількість помилкових виявлень на 83%. Ми відчували, що особливо у світлі безпеки стимуляції (з метою втручатися якомога частіше, але якомога менше) таке включення корисно. Передбачувані негативні ефекти втручання високочастотною електричною стимуляцією мозку контролювали, використовуючи поведінкову активність як параметр зчитування, який не суттєво змінювався між базовим рівнем та сеансом стимуляції. Однак у довгостроковій перспективі додаткові параметри, такі як комбінований відео-ЕЕГ-аналіз, ретельний гістологічний огляд місця стимуляції та аналіз стану сну та неспання протягом довших (> 24 годин) сеансів стимуляції залишаються необхідними для точної оцінки безпеки стимуляції.
Велика кількість хибнопозитивних прогнозів вказує на те, що синхронізація всередині мозкових структур та між ними не є унікальною для генерації SWD. Можливо, мозок також «намагається» генерувати SWD у періоди, зазначені помилково позитивними виявленнями, але не робить цього, оскільки інша невідома вимога до генерації SWD не виконується. SWD, що передувала активності у вигляді коливань 5–9 Гц, раніше був помічений у щурів GAERS, ще однієї добре охарактеризованої та підтвердженої моделі генетичної відсутності епілепсії, досить подібної до щурів WAG/Rij. Подібно до щурів WAG/Rij, не всі коливання 5–9 Гц супроводжувались SWD 23, 24 .
Як чутливість, так і специфічність нашого алгоритму прогнозування SWD можуть бути покращені шляхом вибору найоптимальнішої комбінації місць запису в поєднанні з уточненням способів стимулювання мозку для запобігання виникненню SWD. Крім того, ретельне дослідження перехідних періодів нападів на рівні одиничної та багатоодиничної активності в корі та таламусі може виявити додаткові параметри, які будуть корисними для поліпшення прогнозування SWD. Спостерігалося послідовна зміна активності випалу соматосенсорного таламусу, що передував SWD у моделі миші з нокаутом Scn8a 25 для конкретного регіону. Однак в останній роботі зміна активності стрільби не застосовувалася для прогнозування SWD.
Поточна робота є, наскільки нам відомо, першою, яка поєднує окремі дисципліни прогнозування судом та глибокої стимуляції замкнутого циклу мозку в області відсутність епілепсії. Представлені тут ідеї також можуть бути корисними для розробки та вдосконалення чутливих та селективних систем прогнозування/профілактики нападів ВСМ для інших типів генералізованих епілепсій.
Методи
Самці 6–7 місяців щурів WAG/Rij (маса тіла близько 350 г) служили експериментальними суб’єктами. Щури народились і вирощувались у відділі біологічної психології Центру пізнання Дондерса Університету Радбуд, Неймеген, Нідерланди. До операції їх розміщували парами, після операції - окремо (клітини High Makrolon з постільним матеріалом Enviro Dri та збагачення клітини). Щурів утримували в світловому циклі 12:12 (фаза вимкнення між 8.30 і 20.30 год), їжа та вода за необхідністю. Всі зусилля були докладені для обмеження кількості щурів та обмеження дискомфорту. Усі процедури та протоколи проводились відповідно до керівних принципів ради Європейського Союзу від 22 вересня 2010 р. (2010/63/ЄС) та затверджені Етичним комітетом з експериментів на тваринах Університету Радбоу, Неймеген (RU-DEC).
Хірургія
Стереотаксична операція проводилась під наркозом ізофлурану. Першій групі з 6 щурів WAG/Rij імплантували спеціальний набір електродів. Кінчики двох електродів були спрямовані на глибокі шари соматосенсорної кори, третій - на заднє ядро таламуса. Електроди складалися з дротів з нержавіючої сталі діаметром 0,2 мм, утеплених поліімідом. Тільки кінчик кожного електродного дроту не був ізольований. Кортикальні розташування кінчика електродів, що реєструють ЕЕГ, були (A/P = 0, M/L = −4,6 мм, H = −4,1; A/P = 0, M/L - 4,6 мм, H = 4,6) і для таламус (A/P: -3,6, M/L: -2, H: 6,4 мм), наземний та еталонний електроди розміщували поверх мозочка.
Другій групі з шести щурів імплантували триполярний (MS 333/2a, Plastic One, Roanoke, VA, USA) та два біполярні набори електродів (MS 303/11, Plastic One). Перший набір електродів був використаний для реєстрації таламічної ЕЕГ (A/P: -3,6, M/L: -2,4, H: 6,4 мм), з еталонним та заземлюючим електродом над мозочком. Перший біполярний набір електродів, також використовуваний для запису, був спрямований на глибину соматосенсорної кори (A/P: обидва електроди -0,5, M/L: 4,5 і 5,0, H: 4,5 і 5,0 мм), другий набір електродів складався з пари біполярних стимулюючих електродів, що охоплювали вогнищеву область кінчиками, спрямованими на глибоку соматосенсорну кору або підлягає білу речовину (координати A/P: 2,0, M/L: 4,4, H: 4,1 мм та A/P: -3,0, M/L: 4,8, H: 2,95 мм). Усі координати були отримані з стереотаксичного атласу Паксіноса та Ватсона 26 .
Всі набори електродів були закріплені на черепі стоматологічним цементом (Simplex Rapid, Kemdent, Purton, Swindon, Wiltsher, UK). До операції тварини отримували ін’єкцію атропіну (0,05 мл внутрішньом’язово) та римадилу (5 мг/кг підшкірно). Вони також отримували римадил через 24 та 48 годин після операції (5 мг/кг підшкірно). Щурам дозволяли відновлюватися за 14 днів до проведення будь-яких електрофізіологічних експериментів.
Запис та обробка ЕЕГ
На додаток до порогу виявлення попередника, поріг для електричної стимуляції кори для переривання SWD також був визначений для кожного окремого щура шляхом знаходження інтенсивності, з якою три наступних SWD були перервані 1-секундним імпульсним шлейфом 130 Гц. Ця інтенсивність була використана у другому експерименті. У день прогнозування/стимулювання цього експерименту за одногодинним записом ЕЕГ за базовою лінією супроводжувались сеансом прогнозування SWD протягом 1 години та записом електростимуляції.
Гістологія
Розташування електродів, використаних у другому експерименті, було гістологічно перевірено після завершення експерименту 26. Постійний струм (9 В, тривалість 15 с) спочатку пропускали через кожен електрод у обезболеного щура. Далі щурів перфузували розчином калій-ферроціанід-формальдегід-фосфат; мозок видаляли і фіксували в 30% розчині сахарози в 0,1 мл PBS. Мозок вирізали корональними зрізами розміром 40 мкм, щоб визначити розташування електродів. Тварини з підтвердженим кінчиком електрода в соматосенсорній корі або підстилаючій білій речовині були включені в статистичний аналіз (додаткова фіг. 1). Позиції кінчиків електродів щурів, використані в першому експерименті, були раніше опубліковані 12 .
Вейвлет-аналіз
Часово-частотне розкладання кожного ЕЕГ-сигналу X i (т) проводили з безперервним вейвлет-перетворенням 27:
- Зменшення мозку та тіла до хвороби Альцгеймера; s Набори з живої науки
- Вправа на рак мозку; Щоденник дієтичного щоденника про їжу та втрату ваги (6x9), 3-місячне відстеження їжі
- Бред Пітт розлючений повідомленнями, що Анджеліна Джолі споглядає на переїзд до Великобританії
- 9 питань про контроль за народжуваністю, на які відповів гінеколог - Insider
- B-Epic ACCELER8; ELEV8 Review Посилення мозку, сну; Втрата ваги