Куркумін обмежує збільшення ваги, ріст жирової тканини та непереносимість глюкози після припинення фізичних навантажень та обмеження калорій у щурів
Анотація
Відновлення ваги, ріст жирової тканини та резистентність до інсуліну можуть відбутися протягом декількох днів після припинення регулярних дієт та фізичних вправ. Це явище частково пояснюється дією гормонів стресу, а також місцевим та системним запаленням. Ми досліджували вплив куркуміну, природного поліфенолу, відомого своїми протизапальними властивостями та інгібуючою дією на активність 11β-HSD1, на збереження метаболічного здоров'я та обмеження росту жирової тканини після припинення щоденних фізичних навантажень та обмеження калорій (CR). Щури Спрег-Доулі (віком 6–7 тижнів) пройшли “тренувальний” протокол 24-годинного добровільного доступу до бігових коліс та CR (15–20 г/день;
50–65% від споживання в режимі ad libitum) протягом 3 тижнів (“Усі треновані”) або були сидячими та годувались за бажанням (“Sed”). Через 3 тижні всіх тренованих випадковим чином розділили на одну групу, яка була негайно припинена (“треновану”), та дві детреновані групи, котрі заблокували колеса і були знову введені у режимі ad libitum протягом 1 тижні. Групи, заблоковані колесом, отримували або щоденну пробірку плацебо (“Виведений + Плацебо”) або куркумін (200 мг/кг) (“Виведений + Куркумін”). Припинення щоденного КР та фізичних вправ спричинили збільшення маси тіла, а також збільшення епідидимальної, периренальної та пахової жирової тканини в 9-14 разів, усі вони були ослаблені куркуміном (P Keywords: відновлення ваги, детрена, куркумін, запалення, жирова тканина
фізична активність та обмеження калорій (CR) є наріжними модифікаціями способу життя для стимулювання втрати ваги та боротьби з хронічними захворюваннями. Однак багато людей часто стикаються з труднощами в підтримці успішного схуднення (54). Біологічні механізми, що лежать в основі відновлення ваги, залишаються до кінця не вивченими, але їх пояснюють зміненими метаболічними характеристиками скелетних м’язів, печінки, жирової тканини, мозку, кишечника та нейроендокринної системи. Крім того, ці біологічні зміни можуть відбуватися швидко, як тільки припиняються вищі рівні щоденної фізичної активності та CR. Наприклад, зменшення добової кількості кроків у людей (23, 32, 36) та припинення руху коліс у гризунів (24, 25, 28) викликає стійкість скелетних м’язів до інсуліну, непереносимість глюкози та значне збільшення жирової маси протягом днів. Важливо, що якщо цим шкідливим ефектам можна протидіяти шляхом подальших модифікацій способу життя або фармакологічних стратегій, тоді біологічний потяг до відновлення ваги, навіть після припинення щоденних фізичних навантажень, може послабитись.
Використовуючи цю модель тренувальної децентрації, загальною метою цього дослідження було подальша характеристика ранніх механізмів, що призводять до початкового відновлення ваги, резистентності до інсуліну та росту жирової тканини. Виходячи з різноманітності біологічних властивостей куркуміну, які завершуються зменшенням запалення, пригніченням сигналів росту жирової тканини та зменшенням активного вироблення ГХ, ми висунули гіпотезу, що введення куркуміну протягом періоду децентралізації послаблює відновлення ваги та метаболічну дисрегуляцію, пов’язану з детренінгом (тобто інсулінорезистентність, непереносимість глюкози).
МАТЕРІАЛИ І МЕТОДИ
Заява про етику.
Це дослідження було схвалено Комітетом з догляду за тваринами Йоркського університету відповідно до рекомендацій Канадської ради з догляду за тваринами.
Обробка гризунів та експериментальне проектування.
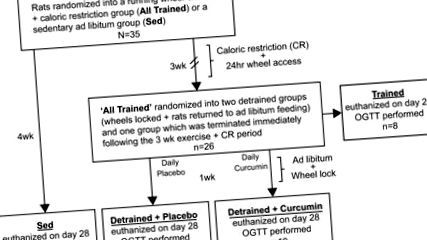
Модель добровільного бігу на колесі, яка використовувалася у цьому дослідженні, передбачала 24-годинний доступ до ходових коліс плюс щоденний CR протягом 3 тижнів з подальшим блокуванням коліс та повторним введенням у режим подавання за винятком з щоденним вимірюванням куркуму або без нього. Для цього 35 самців щурів Спрег-Доулі (лабораторії Чарльз-Рівер, 50–75 г після прибуття) були розміщені індивідуально в середовищі з контролем вологості та температури (відносна вологість 50%, 22–23 ° C) з 12:12 -h цикл світло-темно (0800–2000). Огляд експериментальної конструкції зображений на рис. 1. Коротко кажучи, щурів випадковим чином розділили на дві групи: сидячу групу, яку годували ad libitum (Sed) (n = 9), та добровільну бігову групу (All дресированих, n = 26), яка годувала CR дієтою 15–20 г/день (
50–65% від споживання їжі за умови необхідності) стандартної чау-гризу (Purina Labdiet, № 5012, Сент-Луїс, Міссурі). З практичних цілей гранули зважували у вазі, поки загальна маса не становила 15–20 г/день для кожної щури з обмеженою калорійністю. Через 3 тижні групу «Усі треновані» додатково поділяли на такі групи: «Треновані», «Витреновані + плацебо» та «Витреновані + куркумін» (n = 8–10 на групу, див. Рис. 1). Навчена група була евтаназована наприкінці 3-ї неділі та використана як порівняння попереднього блокування. У знедолених груп заблокували ходові колеса, їх знову ввели в режим харчування довільно і їм давали щоденний пробір плацебо (Detrained + Placebo) або куркуміну (200 mg/kg) (Detrained + Curcumin) протягом 1 тижня. Усім групам проводили пероральний тест на толерантність до глюкози (OGTT), який проводили в день збору врожаю.
Експериментальна хронологія. Спочатку щурів Спрег-Доулі поділяли на 2 групи: Сед та Усі треновані. Група All Trained мала доступ до добровільних бігових коліс 24 години на добу протягом 3 тижнів, і вона отримувала дієту CR 15–20 г/день (
50–65% від надмірного споживання) стандартної чау-гризу. Група Sed не мала доступу до колеса і годувалась за бажанням протягом усього дослідження. Через 3 тижні групу «Усі треновані» поділили на такі групи: Треновані, Детреновані + Плацебо та Детреновані + Куркумін. 21-го дня групам плацебо та куркуміну було заблоковано колесо, вони були введені на додаткове харчування та отримували щоденний пероральний аналіз куркуміну або плацебо. Підготовлену групу збирали на 21 день і використовували для порівняння попереднього блокування. Групи плацебо та куркуміну збирали 28-го дня, 1 тиждень після припинення щоденних фізичних вправ та CR. Групу Sed також збирали на 28 день. Усім групам проводили пероральний тест на толерантність до глюкози (OGTT), який проводили в дні збору врожаю.
Введення куркуміну.
Куркумін (№ C1386, Sigma, Oakville, ON, Канада) розчиняли в диметилсульфоксиді (DMSO, 100% мас./Об.) У концентрації 200 мг/мл, і перорально вводили матрац у дозі 1 мл/кг для остаточної дози 200 мг/кг на день. Група плацебо отримувала лише ДМСО у дозі 1 мл/кг. Ця доза була обрана на основі дослідження, в якому ця доза послабила збільшення ваги та покращила ліпідний профіль крові у пацюків із ожирінням, що годувались жирним жиром (19). Важливо зазначити, що кілька досліджень не повідомляли про токсичність, пов’язану з лікуванням куркуміном як у людей (27), так і у гризунів (40), навіть у дуже високих дозах (3000–12000 мг/кг). Відповідно, ми мали високий рівень впевненості, що доза в цьому дослідженні буде добре переноситися. З іншого боку, ця доза дорівнює 14 г на добу для дорослої людини вагою 70 кг і, можливо, не є здійсненною довгостроковою стратегією прийому добавок. Варто зазначити, що куркумін, як відомо, має погану біодоступність, і останні стратегії подолання цього включають використання наночастинок, ліпосом, фосфоліпідних комплексів та міцел (39), які можуть зменшити дозу куркуміну, необхідну для спостереження клінічних ефектів.
Пероральний тест на толерантність до глюкози.
Оральний тест на толерантність до глюкози (OGTT) вводили (1,5 г/кг маси тіла, 50% розчин декстрози) тваринам, що голодували протягом ночі, через пероральний апарат, як описано раніше (47), наприкінці 3-ї тижні для тренованої групи або наприкінці 4-го тижня для групи Sed та для обох зневажених груп (див. рис. 1 для часової шкали). Концентрацію глюкози в крові вимірювали за допомогою ручного глюкометра (Bayer, Contour, NY). Плазму також виділяли із забору сафенової крові протягом усього OGTT для подальшого аналізу концентрацій інсуліну (див. Нижче). Площа глюкози під кривою (AUC) була розрахована відносно рівня глюкози натще кожного окремого щура. Усі щури були евтаназовані відразу після завершення OGTT.
Аналіз плазми.
Приблизно 125 мкл цільної крові було зібрано у кожної тварини за допомогою пункції підшкірної вени для вимірювання рівня інсуліну в плазмі крові (№ 90060, Crystal Chem, Downer’s Grove, IL) та кортикостерону (№ 07120102, MP Biomedicals, Solon, OH). Для цього невелику ділянку волосся на бічній верхній задній кінцівці голили електричною бритвою і протирали тонким шаром вазеліну. Після того, як була знайдена підшкірна вена, для проколювання вени використовували стерильну голку 25-го калібру, а цілу кров збирали в капілярні пробірки, покриті літій-гепарином, з мікроветками (№ 16.443.100, Сарштедт, Канада) і центрифугували при 14500 г ( Eppendorf Mini-Spin Plus, Brinkman Instruments) протягом 5 хв, переносять у поліетиленові пробірки та зберігають при -80 ° C до подальшого аналізу. Неестерифіковані жирні кислоти (NEFA) (№ 999–34691, 995–34791, 991–34891, 993–35191, Wako Diagnostics, Річмонд, штат Вірджинія) та CRP (№ RAB0097, Sigma-Aldrich) вимірювали з крові, зібраної під час обезголовлення. після OGTT.
Заходи інсулінорезистентності та функції β-клітин.
Оцінка моделі гомеостазу (HOMA) була детально описана раніше (31). Коротко, інсулінорезистентність (HOMA-IR) розраховували наступним чином: [глюкоза натще (мМ) × інсулін натще (мО/л)/22,5]. Оцінка моделі гомеостазу для β-клітин (HOMA-β) була розрахована наступним чином: [20 × інсулін натще (мО/л)/[глюкоза натще (мМ) - 3,5].
Вестерн-блот.
Статистичний аналіз.
10–12 км/ніч протягом останніх 10 днів доступу до добровільних ходових коліс (рис. 2F).
Маса тіла, споживання їжі та поточні дані. В: маса тіла з часом у всіх групах. B: остаточна маса тіла на дату збору врожаю. С: споживання їжі протягом періодів КР (1-3-й тиждень) та періодів ad libitum (4-й тиждень). Підготовлену групу збирали в кінці 3-ї тижні. Групи Сед, плацебо та куркумін збирали наприкінці 4-ї тижні. D та E: загальне споживання їжі у г та ккал відповідно під час періоду виснаження (останній тиждень). F: щоденна бігова відстань по всьому протоколу у всіх 3 бігових групах ("Усі треновані"). * Сед проти всіх тренованих (P Рис. 3, A – F). Після 1 тижні прийому їжі ad libitum та блокування коліс група плацебо суттєво збільшила абсолютну та відносну масу жирової тканини в епідидимальних, периненальних та пахових депо порівняно з групою тренованих (P Рис. 3, A – F) . Група, яка отримувала куркумін, також мала значне збільшення маси жирової тканини щодо групи тренованих; однак вони отримали значно менше жирової тканини порівняно з групою плацебо (P Рис. 3, A – F). У групи плацебо в два рази збільшилась абсолютна маса печінки порівняно з групою, що навчалася, і цей ріст був значно зменшений у щурів, які отримували куркумін (табл. 1). Підсумок відносної та абсолютної маси тканин скелетних м'язів та печінки наведено в таблиці 1 .
Усі дані є середніми ± SE; n = 8–10. Відносна (г/кг маси тіла) та абсолютна (г) маси тканин відповідно для скелетних м’язів та печінки. Істотна різниця присутня, коли групи не мають спільного листа (P Рис. 4). У групі плацебо 1 тиждень блокування колеса та необмежений прийом їжі погіршили як толерантність до глюкози, так і чутливість до інсуліну до значень, подібних до або вище, ніж спостерігалося в сидячій групі ad libitum (рис. 4). Більш конкретно, у групи плацебо спостерігалося збільшення в два та шість разів AUC глюкози та інсуліну відповідно під час проведення ОГТТ, порівняно з групою, що навчалася (P Рис. 4, B та E). Після блокування колеса та CR група плацебо також мала дев'ятикратне та трикратне збільшення рівня HOMA-IR та HOMA-β відповідно до групи підготовки (P Рис. 4, C та F). Порівняно з групою плацебо, група куркуміну підтримувала AUC глюкози в крові та плазми інсуліну в плазмі до рівнів, що спостерігались у групі, що навчалася (рис. 4). Більше того, HOMA-IR у групі куркуміну, хоча все ще була вищою, ніж у групі тренованих, була нижчою, ніж у групі плацебо, що свідчить про роль куркуміну у збереженні покращеної толерантності до глюкози та чутливості до інсуліну.
- Серйозно не можу набрати вагу (бодібілдери, м'ясо, біг, схуднення) - фізичні вправи та фітнес
- Пошкодження периваскулярної жирової тканини, пов’язане з ожирінням, зменшується шляхом стійкої втрати ваги у щурів
- Шейн Уорд план дієти для схуднення Зірка вулиці Коронація використовувала вправи для схуднення
- Зірка "Гарненьких маленьких брехунів" Саша Пітерсе розкриває стан здоров'я, який спричинив надзвичайний набір ваги
- Спорт Фітнес Молоді Дівчата Бігають Вільний Елемент, Вправи, Схуднення, Втрата Ваги PNG Прозорий