Відкриття білків сироваткового біомаркеру при важкій прееклампсії шляхом протеомічного аналізу
Анотація
Прееклапсія (ПЕ) є важким розладом, що виникає під час вагітності, що призводить до захворюваності та смертності матері та плоду. ТЕЛА вражає приблизно 3-8% усіх вагітностей. У цьому дослідженні ми провели рідинну хроматографію з масовою спектрометрією/мас-спектрометрією (LC-MS/MS), щоб проаналізувати зразки сироватки, виснажені з шести найбільш поширених білків при нормальних вагітностях та вагітності, уражені РЕ, для профілактики сироваткових білків. Всього було впевнено ідентифіковано 237 білків
Вступ
Прееклампсія (ПЕ) - це розлад, що визначається новою гіпертензією та протеїнурією після 20 тижнів гестації та може проявлятися вже через 4-6 тижнів після пологів. ТЕЛА вражає 3-8% усіх вагітностей і є основною причиною материнської захворюваності та смертності (Noris et al., 2005). Однак основний патогенез гестозу залишається невідомим, і розробка адекватних біомаркерів для його діагностики та прогнозу ще не розроблена (Jauniaux et al., 2006). Загалом ПЕ характеризується наступним чином: 1) протягом раннього періоду вагітності плацента вивільняє кілька факторів росту в кровообіг матері, викликаючи надмірне системне запалення у відповідь на ішемічну гіпоксію та окислювальний стрес (Borzychowski et al., 2006). 2), генералізована дисфункція ендотелію призводить до характерних для матері симптомів прееклампсії, таких як гіпертонія та протеїнурія протягом пізнього періоду вагітності (Taylor, 1997). Незважаючи на те, що ТЕЛА досліджувались давно, в даний час не існує надійних біомаркерів для прогнозування ТЕЛА на ранніх термінах вагітності.
Останнім часом багато груп приділяють особливу увагу сироватковим білкам, пов’язаним з ожирінням, запаленням низького ступеня та гіпертриацилгліцеролемією, які є загальними симптомами ПЕ (Smets et al., 2006). Вважається, що різні білки сироватки сприяють появі симптомів ПЕ, такі як фактор росту плаценти (PlGF), фактор росту судинного ендотелію (VEGF), розчинний рецептор-1 фактора росту ендотеліального судинного судин (sVEGFR-1), розчинна fms-подібна тирозинкіназа -1 (sFlt-1), плацентарний білок 13 (PP-13), пов'язаний з вагітністю білок плазми A (PAPP-A), хоріонічний гонадотропін людини (HCG), розчинний ендоглін (sEng), альфа-фетопротеїн (AFP), інсулін, подібний фактор росту-1 та IGF-зв’язуючий білок-1 (IGFBP-1) (Muller et al., 1996; Bersinger and Odegard, 2004; Audibert et al., 2005; Venkatesha et al., 2006; Baumann et al., 2007; Спенсер та співавт., 2008; Тейшейра та ін., 2008).
Різні дослідження показали, що рівні експресії цих білків збільшуються або зменшуються відповідно до розладу та його ступеня в ПЕ (Baumann et al., 2007). Однак невідомо, чи ці білки будуть служити новими маркерними білками для діагностики ПЕ в клінічній практиці. Оскільки ці білки мають відносно низьку специфічність для захворювання, необхідний подальший розвиток для його клінічного застосування.
Щоб забезпечити комерційне використання, необхідно подолати такі проблеми, як валідація, відтворюваність та специфічність щодо нових маркерних білків. Крім того, аналіз біологічної рідини, яка має високу складність та динамічний діапазон, вимагає детальної попередньої підготовки та більш чутливих методів (Hu et al., 2006).
З цих причин у цьому дослідженні ми систематично порівнювали протеоми материнської сироватки у жінок з ПЕ та нормальною вагітністю, використовуючи протеомічні технології на основі LC-MS після виснаження дуже великих кількості сироваткових білків, таких як альбумін, імуноглобулін та перенесення тощо. з 237 білків сироватки крові були впевнено ідентифіковані за зразками сироватки жінок з ПЕ та нормальним показником показника помилкового виявлення 1% (FDR). Серед них 97 білків, що мають кілька унікальних пептидів, було збережено для групового порівняння. Диференціальні рівні експресії вибраних білків перевіряли за допомогою кількісного мас-спектрометричного методу, селективного моніторингу реакцій (SRM) (Ji et al., 2003) та імуноферментного аналізу (ELISA).
Результати
Видобуток нових біомаркерів з біологічних рідин людини ставить багато проблем, які необхідно подолати за допомогою протеомічного підходу, таких як широкий динамічний діапазон в достатку та складність білкових компонентів. Відповідно, були зроблені різні спроби відкрити нові білки маркерів з клінічними значеннями (Whiteaker et al., 2007). У цьому документі ми намагалися ідентифікувати нові маркери білків для PE, використовуючи LC-MS/MS, залежні від даних, як для ідентифікації, так і для напів кількісного визначення. Рівень експресії диференційовано експресованих білків додатково підтверджували методом мас-спектрометричного кількісного визначення, SRM та ELISA.
Ми проаналізували окремі зразки сироватки від п’яти пацієнтів на групу в двох примірниках методом LC-MS/MS для виявлення білків сироватки (табл. 1). У цьому аналізі зібрані зразки сироватки обробляли за допомогою колони з множинним видаленням спорідненості (MARS), що містить шість антитіл проти альбуміну, IgG, IgA, трансферину, гаптоглобіну та альфа-1-антитрипсину (Ryu et al., 2010). Після великого рясного виснаження білка зразки сироватки перетравлювали за допомогою трипсину послідовності для аналізу LC-MS/MS для порівняння сироваткових протеом у жінок з ПЕ та у жінок, які переносять нормальну вагітність.
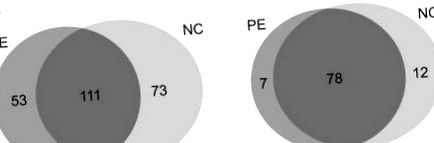
Отримані спектри MS/MS шукали за допомогою алгоритмів SEQUEST, використовуючи стратегію складеної бази даних приманки, щоб оцінити довіру пептиду (Ballif et al., 2005). Ми отримали 5984 та 5744 спектри MS/MS з групи PE (n = 5) та нормальної групи (n = 5), відповідно. У цілому 237 білків з 1% FDR були віднесені до цих спектрів (рис. 1А). Ми обмежили позитивний набір білків білками, ідентифікованими множинними пептидами. Серед них 97 білків відповідали 2 ≤ унікальним пептидам (рис. 1В) (табл. 2), і вони були піддані подальшим анотаціям та валідації. Отже, ми ідентифікували 85 білків та 90 білків, що утворюють зразки сироватки ПЕ та зразки сироватки крові нормальної вагітності відповідно. Серед 85 білків, ідентифікованих у групах ПЕ, 49 білків було виявлено у всіх п'яти пацієнтів. Крім того, 49 білків було виявлено у всіх п'яти пацієнтів серед 90 білків, визначених у нормальній групі.
Діаграма Венна Ідентифікованих білків з обох груп; (А) показує білки, ідентифіковані з одним пептидним попаданням. Всього 111 білків, спільних між групою PE та NC. (В) являє собою білки, які мають кілька унікальних пептидів. В обох групах було поділено сімдесят вісім білків.
Серед 97 достовірно ідентифікованих білків 78 було виявлено в обох групах. Для скринінгу потенційних біомаркерів, специфічних для кожної групи, відносні рівні експресії ідентифікованих білків порівнювали напівкількісним аналізом на основі спектрального підрахунку (Choi et al., 2008; Little et al., 2010). Врешті-решт 62 білки показали більш ніж 1,2-кратну різницю в рівнях експресії, 27 з яких регулювались вгору, а 35 з них регулювались вниз відповідно до їх спектральної кількості (Таблиця 3).
Ці білки, ідентифіковані в процесі профілювання з 1% FDR, були додатково анотовані на основі їх молекулярної функції та біологічного процесу відповідно до термінів генної онтології (GO) у порівнянні з контрольним сироватковим протеомом, отриманим у результаті проекту плазмових протеомів HUPO (Adamski et al., 2005; Omenn et al., 2005) з використанням інструменту функціональної анотації пантери (Thomas et al., 2003).
Специфічно змінені білки РЕ були в основному збагачені в генетичній онтології з точки зору біологічних процесів білкового обміну/модифікації та адгезії клітин в основному збагачені в нормальній групі вагітності (рис. 2). Для відбору цільових білків SRM ми вибрали цільові білки для аналізу SRM згідно з наступними критеріями: i) цільові білки повинні різним чином змінювати рівні експресії порівняно з нормальною групою. ii) Їх патофізіологічні функції повинні бути пов’язані з патологією ПЕ на основі попередніх звітів. iii) Пептиди цільових білків повинні мати високі піки сигналу SRM в режимі сканування SRM, що гарантує хорошу аналітичну відтворюваність з високою ймовірністю.
Функціональна кластеризація генів, визначена інструментом функціональної анотації Panther; Ми порівняли ідентифіковані білки сироватки крові з обох груп із 889 білками високої довіри HUPO з плазмою протеомів (HPPP) за допомогою функціональної кластеризації генів із 95% довірою. Кластеризація генів показала, що біологічні процеси, пов’язані з транспортом, гомеостазом фактора росту, адгезією клітин та метаболізмом/модифікацією білка, суттєво змінилися порівняно з білками HPPP (A). У випадку молекулярних функцій (B) білки, пов'язані з адгезією клітин, були змінені в гестозі.
Відповідно до цих критеріїв ми вибрали чотирьох кандидатів як цільові білки для подальшого СРМ; альфа2-HS глікопротеїн (AHSG), інсуліноподібний фактор росту, що зв’язує білок, кислотостійка субодиниця (IGFBP-ALS), зв’язуючий білок ретинолу4 (RBP4) та альфа-1-мікроглобулін/бікунін (AMBP) Потім ці цільові білки були перевірені методами SRM з добре встановленими переходами (пептидні послідовності, іони-попередники та іони продукту) (Таблиця 4).
Для кількісного визначення білка порівнювали площі піків окремих переходів SRM. Отже, ми могли б визначити відносні рівні експресії цільових білків між групою PE (n = 8) та нормальною групою (n = 5). Як показано на малюнку 3, рівні експресії IGFBP-ALS, AMBP та AHSG були вищими у зразках сироватки, відібраних з групи РЕ. Рівень експресії RBP4 у групі PE був знижений порівняно з нормальною групою.
LC-SRM аналіз чотирьох білків-кандидатів, RBP4, AMBP, IGFBP-ALS та AHSG; Ми проаналізували зразки сироватки у пацієнтів з ПЕ та нормальною вагітністю. Після моніторингу вибраних пептидів ми розрахували відносні площі піків переходів для цільових білків. Рівні білка AMBP, IGFBP-ALS та AHSG були підвищені у пацієнтів із ПЕ (* P-значення # P-значення = 0,08).
У попередніх дослідженнях було показано, що AHSG, який синтезується в печінці та виділяється в кровотік, пов'язаний з ангіогенезом та резистентністю до інсуліну. Також було показано, що рівень AHSG у сироватці крові підвищений у пацієнтів із ожирінням або діабетом (Danzer et al., 1980; Thomas et al., 2003). Це важливий показник того, що AHSG бере участь у сигнальному шляху інсуліну. Крім того, схоже, це підвищує ймовірність розвитку гестаційного діабету під час вагітності (Srinivas et al., 1993; Kalabay et al., 2002; Swallow et al., 2004; Stefan et al., 2006; Briana et al., 2008) . Насправді, наші результати показують, що рівні AHSG у сироватці крові були підвищені в групі PE, як було визначено як за допомогою аналізу SRM (рис. 3), так і аналізу ELISA (рис. 4).
Значне збільшення рівня AHSG спостерігалось у зразках сироватки з ПЕ з використанням аналізу SRM (у 2,5 рази, P
Обговорення
Недавні досягнення в протеоміці відкрили нову главу у відкритті білкових біомаркерів, зробивши внесок у діагностику в клінічній практиці. Однак нові маркери-білки все ще рідко використовуються клінічно через їх обмежену відтворюваність та специфічність.
У цьому дослідженні ми розробили аналітичну методику з використанням мас-спектрометра на основі SRM для кількісного визначення білків біомаркерів у сироватці крові вагітних із важкою формою ПЕ. Результати свідчать про те, що кількісне визначення на основі мас-спектрометрії може бути корисним для ідентифікації та кількісного визначення диференційовано експресованих білків у клінічній практиці.
Хоча воно має обмеження, існує потреба у специфічному антитілі проти білків-мішеней. Однак на розробку таких аналізів потрібно багато часу; тому імуноаналізи на основі антитіл використовувались як потужний інструмент кількісного аналізу біологічних рідин. Крім того, неможливо розробити аналізи ІФА для всіх білків у біологічних рідинах, в яких концентрації білків мають суттєво великий динамічний діапазон та складність. Тому в цій галузі нещодавно були введені аналізи на основі мас-спектрометрії (Aebersold and Mann, 2003).
У цьому дослідженні ми визначили кілька білків як потенційні діагностичні біомаркери для PE, IGFBP-ALS, AHSG та AMBP, використовуючи протеомічні технології. У попередніх дослідженнях деякі групи повідомляли, що інсуліноподібні фактори росту можуть корелювати з патофізіологією ПЕ через їх здатність до росту плода (Chard, 1994).
Отже, ці кандидати корелюють із ростом плода та патофізіологією ПЕ, хоча всі вони не будуть прийняті як нові маркерні білки через обмежену кількість пацієнтів та нормальний стан. Відповідно, необхідні подальші дослідження для вивчення диференціальної експресії білків-кандидатів-маркерів шляхом систематичного аналізу великої кількості пацієнтів для їх клінічного застосування.
Крім того, причини цієї хвороби та способи вилікувати РЕ без передзрілих пологів досі не визначені. Відповідно, з часом буде необхідно дослідити патогенез та діагностику цього захворювання, щоб запобігти загибелі плода та матері. З цього аспекту, SRM на основі мас-спектрометра, описаний тут, буде корисним для відкриття білків біомаркерів.
Методи
Матеріали
Стовпець із системою видалення спорідненості (MARS) був придбаний у Agilent Technologies (Санта-Клара, Каліфорнія). Секвенирующий модифікований трипсин був отриманий від Promega (Madison, WI). Ацетонітрил (сорт ВЕРХ), вода (сорт ВЕРХ) та мурашина кислота (сорт регента ACS) були придбані в Олдріча (Мілуокі, Вісконсин). Реагент для аналізу білка BCA був придбаний у PIERCE (Рокфорд, Іллінойс). Для визначення концентрації AHSG у сироватці використовували людський набір Fetuin-A ELISA (BioVendor, Гейдельберг, Німеччина).
Дослідження сукупності та підготовка вибірки
Ми взяли на роботу вісім вагітних із важкою формою ПЕ та п’ять із неускладненою вагітністю. П'ять вагітних жінок з кожної групи були націлені на профілювання загальних білків сироватки крові, а всіх жінок використовували для кількісного аналізу, SRM та ІФА для валідації. Фенотип досліджуваної популяції представлений у таблиці 1. Ми відібрали жінок, яким було проведено планове кесареве розтин для усунення родового впливу на експресію генів. Перед пологами відбирали з передпліччя 10 мкл венозної крові та збирали у пробірку для вакуатора. Важка прееклампсія визначалася як артеріальний тиск (АТ), щонайменше, 160 мм рт.ст. (систолічний) та/або 110 мм рт.ст. (діастолічний), з протеїнурією ≥ 2+, що визначається за допомогою тесту щупом, вимірюваного щонайменше двічі через шість годин після 20-й тиждень вагітності. Жінки з раніше наявною хронічною гіпертензією, захворюваннями нирок, червоною вовчаком, цукровим діабетом та гестаційною гіпертензією були виключені. Це дослідження було схвалено Інституційною комісією з огляду медичного центру Gangnam CHA, Медичний коледж, Університет CHA, і письмова інформована згода була отримана від кожного пацієнта.
Виснаження рясних сироваткових білків
Щоб зменшити складність сироваткового білка, ми видалили шість найпоширеніших білків із зразків сироватки MARS (Agilent Technologies, Санта-Клара, Каліфорнія) відповідно до інструкцій виробника. Це призвело до виснаження альбуміну, трансферину, IgF, IgA, антитрипсину та гаптоглобіну із сироватки крові людини. Потім збіднені зразки сироватки знесолювали за допомогою спінової колонки PepClean C18 (термо, Рокфорд, Іллінойс) для зміни буфера (50 мМ NH4HCO3), після чого їх піддавали триптичному розщепленню у розчині наступним чином: 10 мкг збіднених зразків сироватки і 10 мМ дитиотреїтолу об'єднували та інкубували протягом 45 хв при 60 ℃ для відновлення білка. Далі додавали 5 мМ йодоацетаміду і зразки інкубували протягом 30 хв у темряві при кімнатній температурі, щоб викликати алкілування. Потім підготовлену суміш піддавали розщепленню 125 нг трипсину щонайменше 4 год при 37 ℃, після чого перетравлені зразки ліофілізували за допомогою Speed-Vac і потім повторно суспендували в 10 мкл 0,1% TFA у воді з ВЕРХ з подальшою шляхом знесолення колоною ZipTip C-18 (Millipore Co., Billerica, MA) для видалення миючого засобу та солі з пептидної суміші.
Ідентифікація білків сироватки крові за допомогою LC-MS/MS
Аналіз селективного моніторингу реакцій (SRM)
ІФА аналіз
Рівні кількості сироваток аналізували за допомогою людського набору AHSG ELISA (BioVendor, Гейдельберг, Німеччина). Сендвіч-ІФА проводили згідно з інструкціями виробника. Потім до кожної лунки контролю якості та зразків додавали 100 мкл розведених стандартів, і планшет інкубували на орбітальній мікропланшеті при кімнатній температурі протягом 1 години. Після триразового промивання лунки додавали 100 мкл розчину кон'югату, а потім планшет інкубували протягом 1 години при кімнатній температурі при струшуванні при 300 об/хв. Потім планшет промивали три рази промивним розчином, після чого в кожну лунку додавали 100 мкл розчину субстрату і планшет інкубували близько 10 хвилин, щоб забезпечити розвиток реакції. Нарешті, поглинання при 450 нм вимірювали за допомогою зчитувача планшетів ELISA.
Статистичний аналіз
Статистичну значущість вимірювань порівнювали, використовуючи дані студента т-тест за допомогою програми MedCalc (програмне забезпечення MedCalc, Mariakerke, Бельгія, версія 11.3.3.0).
- Пошкодження харчової цінності рослинних білків хімічними реакціями під час зберігання та переробки
- Повна стаття Сучасні споріднені підходи для очищення рекомбінантних білків
- Безбарвна очищаюча сироватка, 150 мл Shani Darden NET-A-PORTER
- Виявлення м'якої пшениці у манній та твердій хлібі пшениці шляхом аналізу мікросателітів ДНК
- Вуглеводи, білки та жири - Порушення харчування - Інструкція для споживачів MSD