Виділення, характеристика та гіполіпідемічна активність ферулової кислоти при індукованій дієтою гіперліпідемії з високим вмістом жиру у лабораторних щурів
Панкадж Г. Джейн
1 Інститут фармацевтичної освіти та досліджень імені Р. С. Пателя, Ширпур, Діст-Дуле-425405, Махараштра, Індія
Санджай Дж. Сурана
1 Інститут фармацевтичної освіти та досліджень імені Р. С. Пателя, Ширпур, Діст-Дуле-425405, Махараштра, Індія
Анотація
Вступ
Хвороби серцево-судинної системи є видатною загрозою для здоров'я, яка часто призводить до смерті. Малорухливий спосіб життя та помилкові харчові звички, що охоплюють споживання жирів та рафінованого цукру, призводять до зниження активності ниток міозину та актину (Brai et al., 2007 [7]), підсилюють ризик гіперліпідемії, вагомого фактора ризику для добре відомих серцево-судинні розлади, атеросклероз та супутні серцево-судинні складності. Близько 17,5 мільйонів людей померли через серцево-судинні захворювання (ССЗ), що становить 31% всіх смертей у світі, і очікується, що до 2030 року це зросте до понад 23,6 мільйона (Mozaffarian et al., 2016 [37]). Очікується, що частка осіб з гіпертонічною хворобою в Індії зросте у 2 рази до 2025 року (Brai et al., 2007 [7]). Ішемічна ішемічна хвороба є вагомим фактором ризику в патогенезі передопераційних несприятливих серцево-судинних подій, які підвищують ризик смертності у підгрупі пацієнтів з високим ризиком хірургічного лікування (Howard-Alpe et al., 2006 [15]).
Профіль холестерину пацієнта відіграє вирішальну роль у лікуванні гіперліпідемії. Численні антигіперліпідемічні компоненти, включаючи статини, фібрати, ніацин, жовчні кислоти, езитиміб тощо, знижують рівень холестерину, хоча і за іншим механізмом (Durrington, 2003 [12]). В даний час доступні гіполіпідемічні препарати полегшують частину пацієнтів і асоціюються з низкою побічних ефектів, включаючи гіперурикемію, діарею, нудоту, міозит, загострення шлунку, гіперемію, сухість шкіри та зміну функції печінки (Santharam et al., 2015 [43]).
Останнім часом було розроблено декілька експериментальних моделей гіперліпідемії на тваринах для характеристики характерних сегментів патофізіологічних форм, що зображують це захворювання. У цьому дослідженні гіперліпідемія у щурів була індукована введенням HFD протягом 60 днів. Доведено, що ВЧС спричиняв значне підвищення рівня ЛПВЩ як у клінічних, так і в доклінічних дослідженнях (Katan et al., 1994 [27]; Nevin and Rajamohan, 2009 [38]). Попереднє дослідження, проведене в нашій лабораторії, виявило, що етаноловий екстракт Prosopis cineraria (L.) Druce (Leguminosae) (син. Prosopis spicigera L.) має потужну антигіперліпідемічну дію проти гіперліпідемії, спричиненої дієтою, у лабораторних щурів (Jain and Surana, 2016 [17]). Однак, про очищення, стандартизацію та оцінку антигіперліпідемічної активності етанолового екстракту P. cineraria (ET-PCF) поки не повідомляється. Отже, дане дослідження було проведено з метою виділення та характеристики ET-PCF та оцінки антигіперліпідемічного ефекту на експериментальних лабораторних щурах.
Матеріали і методи
Наркотики та хімікати
Різні ліки та хімічні речовини були отримані від комерційно доступного виробника, такого як HFD (60 ккал% жиру, # D12492, 5,24 ккал/г, Research Diet Inc., Нью-Брансвік, Нью-Джерсі, США). Набори для холестерину, тригліцеридів, HDL-C та LDL-C (Accurex Biomedical Pvt. Ltd., Мумбаї, Індія), петролейний ефір (60:80) та діетиловий ефір (Merck, Індія).
Збір рослинного матеріалу
Свіжі плоди рослини P. cineraria були зібрані з району Сатпуда штату Махараштра, Індія. Професор Л. К. Кширсагар (таксономіст, кафедра ботаніки, Науковий коледж доктора hoоґре Л. К. Доктора С.Г.П.С., Дуле, Університет Північної Махараштри, Джалгаон) проводив автентифікацію заводу.
Зразок того самого був поданий до гербарію відділу.
Приготування етанолового екстракту та виділення
Хімічна характеристика виділеної молекули
Для визначення хімічної структури виділеної сполуки використовували такі методи, як УФ, ІЧ, ЯМР 1 Н, ЯМР 13 С та РХ-МС. ІЧ-спектр реєстрували за допомогою гранул KBr на ІЧ-спектрометрі Перкіна-Елмера (Perkin-Elmer, Waltham, MA). Спектри ЯМР 1 Н та ЯМР 13 C реєстрували з використанням CDCl3 як розчинника на Bruker Advance II. 400 ЯМР та LC-MS спектри реєстрували з високою роздільною здатністю на мас-спектрометрі (система Perkin Elmer Auto) на спектрометрі SAIF Panjab University, Chandigarh, дані наведені у значеннях m/z.
Дослідні тварини
Самці щурів Sprague-Dawley (180-220 г) були отримані з коледжу тваринництва Інституту фармацевтичної освіти та досліджень імені Р. С. Пателя, Шірпур, Індія. Вони були розміщені в добре провітрюваних клітках та підтримували контрольовану температуру 22 ± 2 ° C з 12-годинним циклом світло/темрява та стандартним лабораторним контролем. Тварини мали вільний доступ до стандартного чау-чау (Pranav Agro-Industries Ltd., Санглі, Індія) та фільтрували воду за бажанням протягом експериментального протоколу. Інституційний комітет з питань етики тварин коледжу RCPIPER, Ширпур затвердив протокол дослідження (IAEC/RCPIPER/2012-13/09).
Розробка раціону, що годується щурами
Два дієтичні режими, такі як нормальна дієта на гранулах (NPD) та дієта з високим вмістом жиру (HFD, 58% жиру, 25% білка та 17% вуглеводів, у відсотках від загальної кількості ккал, ad libitum) годували щурів на початковій стадії. термін 60 днів. Склад і підготовка HFD, як було описано в інших місцях (Jain and Surana, 2016 [17]).
Експериментальний дизайн
Дослідження проводились на наступних групах тварин
Група I: Нормальні щури: щури отримували нормальну гранульовану дієту, і їх обробляли носієм (10 мг/кг дистильованої води)
Група II: Контроль HFD: щури отримували дієту з високим вмістом жиру і обробляли носієм (10 мг/кг дистильованої води)
ІІІ група: AT (1.2): щури отримували дієту з високим вмістом жиру, і їх лікували аторвастатином (1.2 мг/кг)
IV група: FA (10): щури отримували дієту з високим вмістом жиру і лікували феруловою кислотою (10 мг/кг)
Група V: FA (20): щури отримували дієту з високим вмістом жиру і лікували феруловою кислотою (20 мг/кг)
VI група: FA (40): щури отримували дієту з високим вмістом жиру, і їх лікували феруловою кислотою (40 мг/кг).
Дозу FA (10, 20 та 40 мг/кг, перорально) було обрано на основі раніше повідомленого методу (Balasubashini et al., 2004 [3]). Транспортний засіб або аторвастатин або FA вводили перорально протягом 60 днів поспіль. Після закінчення лікування щури голодували протягом ночі, і через 24 години їх послідовно знеболювали ефіром анестетика протягом приблизно 30-40 с. Кров відбирали шляхом ретроорбітальної пункції. Кожен зразок крові збирали в окремі флакони для визначення параметрів сироватки крові.
Підготовка зразків сироватки та біохімічні оцінки
Сироватку відокремлювали центрифугуванням за допомогою кріоцентрифуги Еппендорфа (модель № 5810, Еппендорф, Гамбург, Німеччина), витримували при 4 ° C і працювали зі швидкістю 7000 об/хв протягом 15 хв. Рівні ліпопротеїдів високої щільності (ЛПВЩ), ліпопротеїдів низької щільності (ЛПНЩ), тригліцеридів (ТГ) і загального холестерину (ТК) вимірювали спектрофотометром (УФ-видимий спектрофотометр, Jasco V-530, Токіо, Японія) комерційні набори реактивів згідно з процедурою, наданою виробником (Accurex Biomedical Pvt. Ltd., Мумбаї, Індія) (Adil et al., 2015 [1]; Honmore et al., 2015 [14]).
Приготування гомогенатів печінки
Після забору крові тварину вбивали шляхом вивиху шийки матки, печінку видаляли і негайно гомогенізували в 3 мл крижаного буфера PBS. Одну частину супернатанту використовували для подальшого вимірювання SOD, GSH, MDA та NO згідно з раніше повідомленими методами (Adil et al., 2015 [1]; Honmore et al., 2015 [14]). Решту порції супернатанту печінки використовували для подальшого вимірювання ЛПВЩ, ЛПНЩ, TG та загального холестерину за допомогою комерційно доступних наборів реагентів згідно з процедурою, наданою виробником (Accurex Biomedical Pvt. Ltd., Мумбаї, Індія). По одній тканині печінки з кожної групи обробляли для гістогістологічного дослідження.
Гістопатологія тканин печінки
Тканину печінки фіксували у 10% (об/об) нейтральному буферизованому формаліні протягом 24 годин для гістопатологічних досліджень. Його обробляли протягом 12 год із застосуванням ізопропілового спирту, ксилолу та парафіну, вкладених для мікроскопічного дослідження світла (Nikon E200, Японія). Зрізи тканини, вкладені в парафін, вирізані товщиною 5 мкм, готували і фарбували після депарафінації з використанням гематоксилінових та еозинових плям (Н & Е) для перевірки морфологічної оцінки. Мікрофотографії були зроблені при збільшенні 40X.
Статистичний аналіз
Весь статистичний аналіз проводили за допомогою GraphPad Prism 6.0 (GraphPad Software, Inc, La Jolla, CA, USA). Дані про масу тіла та біохімічні вимірювання аналізували за допомогою окремого одностороннього аналізу ANOVA з подальшим тестом Даннета окремо для кожного параметра. Значення p 1 H ЯМР, 13 C ЯМР і LC-MS
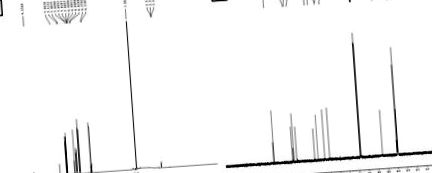
Хімічна структура виділеної сполуки з'ясована за допомогою інфрачервоної спектроскопії (ІЧ), протонного ядерно-магнітного резонансу (1 Н ЯМР), вуглецевого ядерно-магнітного резонансу (13 С ЯМР) та експерименту з рідинною хроматографією-мас-спектрометрією (LC-MS) . Характеристика виділеного з'єднання проводилася за допомогою FT-IR, 1 H ЯМР (рис. 1A (рис. 1)), 13 C ЯМР (рис. 1B (рис. 1)) та LC-MS спектрів (рис. 2 (рис. 2)). Результати цієї характеристики дозволяють припустити, що виділена сполука складається з одного хімічного фрагменту з чистотою 93%. Отримане ізольоване з'єднання являло собою кристалічну тверду речовину світло-жовтого кольору (температура плавлення 168 ° C до 172 ° C).
У його LC-MS пік молекулярних іонів M + 1 пік при m/z. 195.42 припускає одну з можливих молекулярних формул як C10H10O4. Його ІЧ-спектр показав характерну широку смугу поглинання при 3438 см -1 для гідроксильної групи, він також показав широкі піки при 2968 см -1 для групи карбонової кислоти, 1691 см -1 для карбонільної групи та 1275 см -1 для Група CO.
Його спектр ЯМР 13 С демонстрував 10 сигналів для 10 вуглецевих сигналів у такій формі: (а) дев'ять СН, (б) одна СН3.
Спектр ЯМР 1Н також показав присутність трьох метильних груп при δ 3,9 с, (3H, J.05,0, 10,0 Гц), 6,2 д, (1H, J.07,0, 10,0 Гц) СН, 6,8 d, (1H, СН ар. Кільця), 6,9 д, (1Н, СН ар. Кільця), 7,1 с, (1Н, СН), 7,5 д, (1Н, СН) та 9,2 с, (1Н, ОН) для гідроксильної групи . З даних ЯМР та LC-MS підтверджено, що структурою сполуки є ферулова кислота (Singh et al., 2013 [45]) з чистотою 93%.
Вплив ферулової кислоти на HFD-індуковані зміни маси тіла та маси печінки щурів
Вага тіла та маса печінки значно збільшились (р (табл. 1)). Однак збільшена маса тіла та маса печінки значно зменшились (р (табл. 1)). Лікування аторвастатином (1,2 мг/кг) також призводить до значного зменшення (р (табл. 1)).
Вплив ферулової кислоти на індуковану HFD зміну рівня ліпідів у сироватці крові та атерогенний індекс щурів
Введення HFD значно зростає (р (табл. 1)). Введення ФА (10, 20 та 40 мг/кг) спричинило значне та дозозалежне зниження (р (табл. 1)).
Відбулося значне зменшення (p (табл. 1)). Лікування ФА (20 та 40 мг/кг) суттєво та залежно від дози пригнічується (р (табл. 1)). У порівнянні з контрольною групою HFD лікування аторвастатином (1,2 мг/кг) також суттєво гальмувало (р (табл. 1)).
Вплив ферулової кислоти на індуковану HFD зміну печінкового ліпідного профілю та атерогенний індекс щурів
Контрольні щури HFD демонструють суттєве збільшення (р (табл. 2)). Введення ФА (20 та 40 мг/кг) призводило до значного гальмування (р (табл. 2)). Лікування аторвастатином (1,2 мг/кг) також суттєво гальмувало (р (табл. 2)).
Вплив ферулової кислоти на зміну, спричинену HFD, у рівнях СОД, GSH, MDA та NO у щурів
Відбулося значне зменшення (р (рис. 3)). Лікування ФА (20 та 40 мг/кг) суттєво збільшилось (р (рис. 3)). Введення аторвастатину (1,2 мг/кг) також призвело до значного збільшення (р (рис. 3)).
Вплив ферулової кислоти на індуковані HFD зміни в гістології печінки щурів
Запальні клітини від помірного до легкого ступеня (чорна стрілка, ступінь 2) були присутні у щурів, оброблених FA (10 та 20 мг/кг) (малюнок 4D (рис. 4) та малюнок 4E (рис. 4), відповідно та таблиця 3 (табл. 3)). Печінкова тканина щурів, оброблених ФА (40 мг/кг), відображала наявність інфільтрації запальних клітин (чорна стрілка, ступінь 1), вакуолізацію (ступінь 1) та відсутність будь-якого відкладення везикулярного жиру, а також некрозу, застійних явищ та набряків (рис. 4F (рис. 4) та таблиці 3 (табл. 3)).
Обговорення
Повідомлялося, що підвищена продукція NO відіграє життєво важливу роль у індукції різних захворювань, включаючи гіперліпідемію (Айдін, 2015 [2]). Травма тканин сталася, коли NO реагує з супероксидом і утворює пероксинітрити, і необхідно пригнічувати це вироблення NO для полегшення пошкодження тканин (Kandhare et al., 2013 [23], 2012 [24]). У цьому дослідженні HFD спричинив значну індукцію пошкодження печінки через збільшення виробництва NO. Введення ФА призвело до значного покращення підвищеного вироблення NO, спричиненого HFD. Повідомлялося, що FA модулював біодоступність оксиду азоту (NO) та знижував синтез iNO (Suzuki et al., 2007 [49]). Наші результати підтверджують висновок попереднього дослідника, що ФА спричинив інгібування продукції NO.
Повідомлялося, що підвищений окислювальний стрес сприяє розвитку метаболічного синдрому, пов’язаного з атеросклерозом (Choi et al., 2010 [10]). Більше того, велика кількість тригліцеридів у сироватці крові пов’язана з атеросклерозом із підвищеним ризиком серцевих захворювань та інсульту (Ong et al., 2009 [40]). Індукована HFD гіперліпідемія пов'язана зі зміненими механізмами антиоксидантного захисту. Гіперхолестеринемія призводить до атеросклерозу, а інгібування перекисного окислення ліпідів пригнічує цей атеросклероз (Yokozawa et al., 2003 [52]). У цьому дослідженні щури, яким вводили HFD, виявляли підвищений рівень окисного стресу разом з LDL-C та тригліцеридами, що в свою чергу підвищувало атеросклеротичний індекс. Однак введення ФА викликало значне пригнічення атеросклеротичного індексу через його антиоксидантний потенціал. Більше того, результати попередніх досліджень показали, що фенольні сполуки ефективно запобігають утворенню та прогресуванню атеросклерозу, що головним чином обумовлено його антиоксидантним та гіпохолестеринемічним потенціалом (Carew et al., 1987 [8]). FA - це природна поліфенольна сполука, що володіє як антиоксидантною, так і гіпохолестеринемічною активністю, і яка може пригнічувати прогресування атеросклерозу.
Аторвастатин є ефективним засобом із значним зниженням ліпідів, що широко застосовується у лікуванні гіперліпідемії, атеросклерозу або серцево-судинних ускладнень (таких як ішемічна хвороба серця) (Stancu and Sima, 2001 [47]). Він має здатність інгібувати фермент HMG-CoA-редуктази, фермент, який генерує мевалонат шляхом перетворення з HMG-CoA. Це інгібування ферменту HMG-CoA-редуктази служить обмежувачем швидкості в біосинтезі холестерину. Таким чином, інгібування ГМГ-КоА-редуктази, в свою чергу, спричиняє зниження рівня холестерину, ЛПНЩ-холестерину та загального рівня холестерину (Davignon et al., 1992 [11]). Однак вони мають здатність знижувати концентрацію тригліцеридів, що залежить від вихідного рівня тригліцеридів. Однак у цьому дослідженні FA виявив значне зниження загального холестерину та тригліцеридів у сироватці крові, а також у печінковій тканині.
На закінчення, хімічна структура виділеної сполуки була визначена за допомогою експерименту ЯМР 1Н, ЯМР 13C та LC-MS, який показав, що з етанолового екстракту P. cineraria виділено лише одну сполуку, яка характеризується як FA. Нарешті, чистий ізольований ФА був обстежений за допомогою моделі щурів, індукованої HFD, на предмет його гіполіпідемічної дії з використанням параметрів ліпідів сироватки та печінки. FA (20 та 40 мг/кг) призводив до значного зниження ТК, ТГ, ЛПНЩ, ЛПНЩ-Л і значного збільшення ХС-ЛПВЩ як у сироватці, так і в печінковій тканині. Це також призвело до значного покращення оксидо-нітрозативного стресу в печінці, викликаного HFD. Нещодавнє дослідження також показало, що ФА пом'якшує метаболічний синдром, викликаний дієтою з високим вмістом вуглеводів у моделі щурів (Senaphan et al., 2015 [44]). Таким чином, зроблено висновок, що етаноловий екстракт P. cineraria мав гіполіпідемічну активність, головним чином завдяки ФА через пригнічення підвищеного оксидо-нітрозативного стресу. Ці результати з чистою ізольованою ФА та попередні результати з етаноловим екстрактом P. cineraria підтверджують, що P. cineraria є корисним у запобіганні гіперліпідемії у лабораторних тварин. Однак триває подальше дослідження з метою з'ясування фактичного механізму дії FA, виділеного з P. cineraria на молекулярному рівні.
Декларація про інтерес
Автори повідомляють про відсутність конфлікту інтересів.
- Гіполіпідемічна активність Moringa oleifera Lam, Moringaceae на дієті з високим вмістом жиру
- Гіполіпідемічна активність Moringa oleifera Lam, Moringaceae на дієті з високим вмістом жиру
- Чи існує якийсь зв’язок між надмірною вагою, фізичною активністю, споживанням жиру та клітковини з
- L-карнітин та жир у дієті матері під час вагітності та лактації змінюють жирну кислоту
- Застосовані водневі, механічно міцні нановолокна з регульованою антиоксидантною активністю ACS