Важливість функціональних втрат FUS у FTLD/ALS
Шінсуке Ісігакі
1 Неврологічний факультет, Медична школа Нагойського університету, Нагоя, Японія
2 Кафедра терапії нерозв'язних неврологічних розладів, Вища медична школа Університету Нагої, Нагоя, Японія
Ген Собу
3 Центр досліджень мозку та розуму, Університет Нагої, Нагоя, Японія
4 Науково-дослідний відділ деменції та нейродегенеративних захворювань, Вища медична школа Університету Нагої, Нагоя, Японія
Анотація
Вступ
Аміотрофічний бічний склероз (БАС), що характеризується селективною втратою рухових нейронів в центральній нервовій системі, і лобно-скронева дегенерація крупозних відділів (FTLD), яка відрізняється змінами характеру, аномалією поведінки, порушеннями мови та прогресуючою деменцією, нещодавно визнана два кінці спектру однієї хвороби (Robberecht and Philips, 2013). Це поняття підтверджується генетичними детермінантами, що лежать в основі сімейних FTLD/ALS (Renton et al., 2014) та рядків доказів, що свідчать про патологічну неперервність між ALS і FTLD (Riku et al., 2014). РНК-зв’язуючі білки (RBP), такі як трансактивна відповідь (TAR), ДНК-зв’язуючий білок 43 (TDP-43) і злитий у саркомі (FUS) генетично та патологічно пов’язують два нейродегенеративні захворювання до одного захворювання (Van Langenhove et al., 2012). Ці гени є збудниками сімейних ALS і FTLD і є патологічними ознаками як сімейних, так і спорадичних FTLD/ALS, при яких спостерігаються TDP-43 або FUS-позитивні включення (Kwiatkowski et al., 2009; Lagier-Tourenne and Cleveland, 2009; Vance et al., 2009; Mackenzie et al., 2011; Strong and Volkening, 2011). Крім того, FTLD також класифікується як тауопатія, що характеризується накопиченням фосфорильованого білка тау, пов'язаного з мікротрубочками (Tau), у уражених нейронах (Seelaar et al., 2011).
Цей огляд надає огляд нещодавніх висновків, які виявляють ефекти функціональної втрати FUS на патогенез FTLD/ALS. По-перше, втрата FUS в ядрі призводить до незбалансованості ізоформ Tau через недостатнє пропускання екзону 10 у гені MAPT. По-друге, втрата FUS в цитоплазмі спричиняє зниження стабільності мРНК GluA1 та SynGAPα2, що призводить до аберрантного дозрівання дендритних колючок. Крім того, ми узагальнюємо ролі FUS у підтримці нейритів та аксональному транспорті, а також даємо короткий огляд переходу FUS в рідку фазу, який може змінити різні його фізіологічні функції та сприяти розвитку токсичних клітинних ефектів за патологічних умов. Таким чином, функціональні властивості FUS можуть впливати на множинні клітинні процеси нейронів та/або гліальних клітин, дисфункція яких може бути найбільш вірогідним поясненням нейрональної токсичності, опосередкованої втратою FUS.
Кількісна та якісна втрата функції FUS
Хоча останні повідомлення дозволяють припустити, що втрата функції FUS в рухових нейронах може не сприяти дегенерації рухових нейронів при ALS (Scekic-Zahirovic et al., 2016; Sharma et al., 2016), ряд фактів свідчить про те, що -FUS-функції в мозкових нейронах може сприяти дисфункції нейронів та нейродегенерації при FTLD. Миші з дефіцитом FUS, що генеруються або за допомогою мовчання, або з нокаутом FUS мають порушення поведінки (Kino et al., 2015; Udagawa et al., 2015). Однак відновлення FUS дикого типу у мишей, замовчуваних FUS, врятувало поведінкові фенотипи, тоді як мутант, пов’язаний із захворюванням, ні (Ishigaki et al., 2017).
Хоча патологія FUS виявляється як у випадках ALS, так і у FTLD, більшість мутацій, що викликають захворювання в FUS, пов'язані з випадками ALS. Тим не менше, у підгрупи сімейних та епізодичних випадків ALS, що включають мутації гена FUS, було виявлено когнітивну дисфункцію або розумову відсталість (Bäumer et al., 2010; Huang et al., 2010; Yan et al., 2010; Belzil et al., 2012; Yamashita et al., 2012). Більше того, у значної субпопуляції хворих на БАС спостерігався спектр когнітивних порушень (Swinnen and Robberecht, 2014). У сукупності клінічні дані та висновки моделі мишей, замовчуваних FUS, підтверджують гіпотезу про те, що дисфункція FUS призводить до ранніх когнітивних порушень.
У сукупності ці висновки вказують на те, що як кількісні, так і якісні втрати функції FUS, ймовірно, беруть участь у патогенезі FTLD/ALS, і повинні надати підказки для терапевтичних засобів, які уточнюють функціональні властивості FUS.
Функція FUS в ядрі: регулювання альтернативного сплайсингу та транскрипції
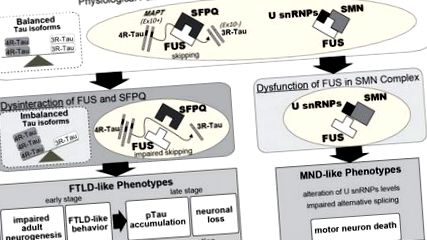
Оскільки FUS відіграє роль у багатьох аспектах метаболізму РНК, погіршення транскриптома може бути найбільш вірогідним поясненням нейрональної токсичності, спричиненої втратою FUS. На підтвердження цього було виявлено численні молекули, пов'язані з функцією нейронів, у профілях транскриптома, регульованих FUS (Ishigaki et al., 2012; Lagier-Tourenne et al., 2012; Rogelj et al., 2012; Fujioka et al., 2013; Honda et al., 2013; Nakaya et al., 2013). Зміна експресії генів та/або альтернативне сплайсинг цих генів може мати великий вплив на функцію нейронів, що сприяє нейродегенерації, яка спостерігається при FTLD/ALS. Ми припускаємо, що порушення функціональності FUS може спричинити частковий ефект, а не летальний збиток, змінивши ізоформи або рівні експресії цих генів. Таким чином, можливо, що нейродегенерація виникає лише після того, як порушення транскрипції, спричинене втратою функціональності FUS, досягає критичного порогу, так що експресія окремих генів та альтернативні випадки сплайсингу самі по собі не є критичними.
Додаткові мішені опосередкованого FUS пропуску екзону можуть також сприяти патогенезу FTLD/ALS. Серед цих генів є сам FUS, в якому FUS-опосередковане сплайсинг на екзоні 7 сприяє авторегуляції експресії з пропущеним варіантом екзону 7, що зазнає розпаду, опосередкованого безглуздям (NMD). Функція авторегуляції не вистачає у мутантів FUS, асоційованих з ALS (Zhou et al., 2013).
Інші FUS-регульовані гени, такі як NTNG1 або BRAF, які можуть бути важливими для виживання нейрональних клітин, були виявлені в багатьох звітах (Orozco та Edbauer, 2013). Подальші дослідження необхідні для оцінки їх значення у патогенезі FTLD/ALS.
Функція FUS в дендритному відділі хребта: стабілізація мРНК
Поки FUS збагачується в ядрі, відсоток білка локалізується на сомах і нейрональних відростках (Fujii and Takumi, 2005; Aoki et al., 2012; Yasuda et al., 2013). Більше того, у дендритах багато РНК-зв'язуючих білків, включаючи FUS, беруть участь у місцевих механізмах трансляції для регулювання синаптичної функції та морфології (Fujii and Takumi, 2005; Qiu et al., 2014; Sephton et al., 2014). Зв'язування FUS з 3'UTR цільових мРНК є важливим фактором, що визначає трансляційну ефективність та стабільність мРНК (Colombrita et al., 2012; Lagier-Tourenne et al., 2012; Rogelj et al., 2012). Таким чином, ці висновки дозволяють припустити, що цитоплазматична функція FUS може брати участь у регулюванні стабільності, трансляції та транспорту мРНК.
Масуда та ін. повідомили, що FUS бере участь в альтернативному механізмі поліаденилювання з FUS-зв'язуючими зароджувальними РНК та взаємодіючими з комплексами CPSF і CSTF (Masuda et al., 2015). Крім того, ми показали, що FUS регулює стабільність мРНК GluA1 у співпраці з CPSF6, PAN2 та PABP, а також контролює стабільність мРНК SynGAPα2, ізоформи SynGAP1, з білками ELAVL залежно від довжини 3'UTR. Заглушення FUS зменшило кількість зрілих дендритних колючок як in vitro, так і in vivo. Відновлення експресії або GluA1, або ізоформи SynGAPα2 у мишей з дефіцитом FUS частково покращує аномальну поведінку та порушення дендритного дозрівання хребта, спричинене виснаженням FUS, припускаючи, що опосередкована FUS стабільність мРНК GluA1 та контроль експресії специфічної ізоформи SynGAPα2 є критичним для них фенотипи (Udagawa et al., 2015; Yokoi et al., 2017).
Ці результати, взяті разом, дозволяють припустити, що втрата регуляторного контролю стабільності мРНК синаптичної молекули у відповідь на порушення функціональності FUS спричиняє синаптичну дисфункцію і може призвести до постсинапсичних порушень у FTLD/ALS.
Підтримання морфології нейронів методом FUS
Відомо, що постсинапсичні порушення при нейродегенеративних розладах, включаючи FTLD/ALS, можуть бути ранніми патологічними змінами (Sephton and Yu, 2015; Herms and Dorostkar, 2016). Наприклад, недолучення білка Тау до соматодендритного відділу визнано ранньою патологічною подією при хворобі Альцгеймера (АД) та інших тауопатіях (Ballatore et al., 2007; Hoover et al., 2010). Подібним чином у трансгенних мишей FUS R521G спостерігалося зменшення дендритних альтанок і зрілих шипів (Sephton et al., 2014), а при надмірній експресії FUS R521C - дендритні та синаптичні дефекти, що супроводжувалися пошкодженим зрощуванням Bdnf (Qiu et al., 2014).
Було продемонстровано, що довжина невриту зменшується у замовчуваних FUS первинних кортикальних нейронах, але їх можна відновити, надмірно виражаючи FUS дикого типу, тоді як мутанти, пов'язані із захворюваннями, не мали ефекту (Ishigaki et al., 2017). Подібним чином, нейрони, отримані з iPSC, у сімейних хворих на БАС, що містять мутації у FUS, виявляли коротші неврити порівняно з контролем (Ichiyanagi et al., 2016). Більше того, порятунок шляхом спільного мовчання 4R-Tau покращив токсичні ефекти FUS-шумозаглушення на довжину невриту (Ishigaki et al., 2017). Таким чином, дисфункція FUS індукує патологічну нейрональну морфологію, що може бути пов’язано із змінами в ізоформах тау. Дійсно, 4R-Tau функціонує у придушенні динаміки мікротрубочок шляхом стабілізації взаємодій мікротрубочок та надмірної експресії 4R-Tau впливає на довжину невриту залежно від дози (Panda et al., 2003; Ishigaki et al., 2017). Таким чином, морфологічні відхилення у невритах можуть бути одними з найперших біомаркерів і, отже, можуть бути використані на терапевтичних скринінгах або як діагностичний засіб.
Регулювання аксональної функції за допомогою FUS
Деякі дослідження залучили FUS до регуляції нейрональної пресинаптичної функції з асоційованими із захворюваннями мутантами FUS, що погіршує її регуляторну роль (Sasayama et al., 2012; Armstrong and Drapeau, 2013; Schoen et al., 2015). Еррікеллі та ін. повідомили, що кругова експресія РНК, яка бере участь у наведенні аксонів, впливала на рухові нейрони мишей FUS KO (Errichelli et al., 2017). Повідомлялося про дефекти аксонального транспорту для мутацій FUS, пов’язаних з ALS/FTLD (Baldwin et al., 2016; Chen et al., 2016). Більше того, Guo et al. виявили, що на аксональний транспорт впливали мутації FUS, пов’язані із захворюваннями, в моторних нейронах, що походять від людини iPSC (Guo et al., 2017). Оскільки аксональні транспортні дефекти з'являються у мишей, які несуть мутації в SOD1, що викликає ALS, і у дрозофіли, що несуть мутації в TDP-43 та C9orf72 (Williamson and Cleveland, 1999; Baldwin et al., 2016), необхідне подальше дослідження з метою з'ясування загальноприйнятого патомеханізму.
Рідкофазний перехід FUS та його патологічні та фізіологічні функції
Нещодавні дослідження показали нову властивість білка FUS - рідинно-рідинні фазові переходи, що призводять до утворення різних білкових мембранних органел. Було продемонстровано, що FUS зазнає поділу рідина-рідина фази перед перетворенням у нерозчинну форму білка, що сприяє мутаціям, фосфорилюванню або присутності РНК (Murakami et al., 2015; Patel et al., 2015; Chong and Forman-Kay, 2016; Monahan et al., 2017). Подібно до hnRNPA2, область низької складності (РК) у С-кінцевій області FUS відповідає за поділ фази рідина – рідина (Xiang et al., 2015; Murray et al., 2017). Інші РНК-зв'язуючі білки, такі як TDP-43, TIA1, TAF15 та дипептидні білки, що повторюються, синтезовані з мутанта C9orf72, також містять РК (Boeynaems et al., 2017; Harrison and Shorter, 2017). Більше того, повідомлялося, що Тау також піддається поділу рідина-рідина у розчині з 4R-Тау, більш схильним до утворення крапель рідини, ніж 3R-Тау (Ambadipudi et al., 2017).
Ці висновки настійно свідчать про біохімічний зв’язок між РНК-зв’язуючими білками та іншими амілоїдоутворюючими білками, включаючи Тау, та його зв’язок з процесом РНК при нейродегенеративних захворюваннях. Оскільки ці висновки базувались на експериментах in vitro, необхідне подальше дослідження, щоб з'ясувати, чи/як фазові переходи рідина-рідина пов'язані з біологічною функцією, і чи використовують переходи, які відбуваються в цитоплазмі дендритних колючок та/або ядра, однакові або інший молекулярний процес.
Висновки
Функціональна втрата FUS в ядрі та цитоплазмі може спричинити дисфункцію та дегенерацію нейронів. У ядрі FUS регулює альтернативне сплайсинг та транскрипцію. Наприклад, пропуск екзону 10 MAPT, який регулюється FUS в комплексі з SFPQ, генерує дві ізоформи білка Tau, 3R-Tau і 4R-Tau. FUS також регулює транскрипцію ряду генів, включаючи Ntng1, Braf1 та сам Fus. З іншого боку, цитоплазматичний FUS стабілізує мРНК, що беруть участь у дендритному відділі хребта, таких як GluA1 та SynGAP. У сукупності функціональні порушення, спричинені дефіцитом FUS, можуть впливати на функцію та морфологію нейронів і згодом призвести до аберрантної поведінки та нейродегенерації. Крім того, FUS також був залучений до механізму транспортування аксонів, що погіршується мутаціями FUS, пов'язаними із захворюваннями.
Внески автора
SI: Концепція та дизайн, написання рукописів, редагування та дизайн малюнків. GS: Концепція та дизайн, написання рукопису та редагування.
Заява про конфлікт інтересів
Автори заявляють, що дослідження проводилось за відсутності будь-яких комерційних або фінансових відносин, які можна трактувати як потенційний конфлікт інтересів.
Подяка
Цю роботу підтримали проект Mext Grant-in-aid, Наукові дослідження в області інновацій (старіння протеїну мозку та контроль за деменцією), Mext Grant-in-Aid для наукових досліджень в інноваційних сферах (Комплексна наукова мережа мозку), Mext KAKENHI номер гранту 15K09310 та CREST від JST.
Ця робота також була підтримана проектами "Інтегровані дослідження нервово-психічних розладів" та "Комплексні дослідження депресії, деменції та розладів розвитку", що проводяться в рамках Стратегічної програми досліджень мозку та мозку/MINDS Японського агентства з медичних досліджень та розвитку.
- Медичне схуднення та управління вагою Мельбурн, Флорида; Карін Ромен APRN Функціональна інтеграція
- Як схуднути, як це, цей 24-річний інженер-програміст для схуднення GQ India
- Кето проти макросу, що є кращим планом дієти макросів для швидкого схуднення • IIFYM • Розрахуйте свої макроси
- Кето Втрата ваги Cvs Кращі відгуки Клуб дикої природи округу Пітт
- Головна Сіблі Схуднення