Трансжирне годування призводить до підвищення рівня аланінамінотрансферази в сироватці крові та підвищення резистентності до інсуліну порівняно зі стандартною дієтою з високим вмістом жиру у мишах
Анотація
Трансжири - це форма ненасичених жирів, яка порівняно рідко зустрічається в природі, але в достатку присутня у складі «фаст-фуду» та багатьох перероблених харчових продуктів, які надмірно споживаються в розвинутих країнах. Трансжири відрізняються від більшості ненасичених жирних кислот через подвійний зв’язок упереклад”Конфігурація замість стандартної“цис”Конфігурація. Ця структурна зміна призводить до вигляду жирних кислот, які випрямляються і більше нагадують структуру насичених жирних кислот. Вважається, що ця структурна зміна відіграє особливо важливу роль у токсичності трансжирів (41). Основним джерелом трансжирів у нашому раціоні є часткове гідрування рослинних олій, що є промисловим процесом, який використовується для перетворення олій у напівтверді жири для використання у хлібобулочних виробах, смажених у швидкому обсмаженні продуктах та маргаринах. Вживання лише однієї або двох порцій цих продуктів часто може перевищувати рекомендовану добову норму вживання трансжирів. Трансжири становлять –2–3% від загального споживання калорій американцями, але рекомендується, щоб споживання не перевищувало 1% від загального споживання калорій (2, 35).
Споживання трансжиру пов’язане з підвищеним ризиком розвитку ішемічної хвороби серця (5, 36, 37). Крім того, трансжири можуть погіршити діабет, як це передбачається підвищеною резистентністю до інсуліну у гризунів, які перегодовують жир, хоча дані, що пов'язують трансжири з діабетом у людей, суперечливі (16, 18, 34, 51). Інсулінорезистентність та судинні захворювання часто зустрічаються у хворих на НАЖХП, і ці захворювання мають спільні фактори ризику. Кілька недавніх досліджень продемонстрували збільшення серцево-судинних подій у пацієнтів з НАЖХП незалежно від загальноприйнятих факторів ризику (4, 13, 19, 49). Хоча споживання гризунами дієти з високим вмістом жиру призводить до розвитку експериментальної жирової хвороби печінки, особливе значення трансжирів як на експериментальній, так і на жировій хворобі печінки людини раніше не розглядалося. Тому ми прагнули порівняти ефект дієти з вмістом трансжирів, що складається переважно з транс-18: 1, n-6, видів, яких найбільше вживають у трансжирах, споживаних з промислових джерел, з калорично ідентичним стандартним вмістом жиру (транс знежирена) дієта на розвиток експериментальної жирової хвороби печінки.
Тварини та експериментальний протокол.
Самців мишей AKR/J купували в лабораторії Джексона (Бар-Харбор, Міссісіпі), а на початку кожного експерименту миші мали вік 9-10 тижнів. Тварин поселяли в кімнаті з контрольованою температурою (22 ° C) з 14-годинним освітленням: 10-годинний темний цикл і годували чау-харланом Текладом (Медісон, штат Вісконсин) перед експериментами, з вільним доступом до їжі та води. Мишам вводили або трансжирну, стандартну з високим вмістом жиру, або контрольну дієту (Research Diets, Нью-Брансвік, Нью-Джерсі) протягом 10 днів (n = 6–8 на групу), 4 тижні (n = 5–6 на групу), або 8 тижнів (n = 4–5 на групу). Для кожного експериментального моменту часу використовували окремі когорти мишей.
Таблиця 1. Дієтичні композиції
ПНЖК, поліненасичені жирні кислоти; SFA, насичені жирні кислоти.
Визначення рівня хімії та гормонів.
Рівні аланінамінотрансферази в сироватці крові (ALT) визначали за допомогою спектрофотометричного набору, придбаного у Biotron Diagnostics (Hemet, CA). Рівні тригліцеридів у сироватці та печінці визначали за допомогою набору для спектрофотометричного аналізу, придбаного у Thermo Electron (Луїсвілл, Колорадо). Концентрацію білка в гомогенаті печінки визначали за допомогою реагенту Кумассі (Пірс, Рокфорд, Іллінойс) та BSA як стандарт. Вміст тригліцеридів печінки нормалізували до вмісту білка в гомогенаті. Рівні інсуліну, лептину та печінкового інтерлейкіну-1β (IL-1β) у сироватці крові аналізували за допомогою багатолункових планшетів, придбаних у Meso Scale Discovery (MSD) (Gaithersburg, MD), використовуючи SECTOR Imager 2400 (MSD), відповідно до інструкцій виробника. Печінку гомогенізували в буфері для лізису (pH 7,4, 50 мМ Трис · HCl, 150 мМ NaCl, 25 мМ EDTA, 5 мМ EGTA, 0,25% Na-дезоксихолату, 1% Igepal-630, 0,5 мМ DTT, 1% BSA) для визначення рівня печінки IL-1β. Рівні глюкози натще визначали за допомогою відбивного глюкометра (One Touch II, Lifescan, CA). Кількісний індекс перевірки чутливості до інсуліну (QUICKI) розраховували як міру чутливості до інсуліну; QUICKI = 1/[log (інсулін натще) + log (глюкоза натще)].
Швидкобілкова рідинна хроматографія та рівень холестерину в сироватці крові.
Ліпопротеїди сироватки крові фракціонували за допомогою системи швидкої білкової рідинної хроматографії AKTA (FPLC), використовуючи рівні обсяги об'єднаної плазми з когорт мишей на тандемних колонках Superose 6 FPLC (Amersham Biosciences, Piscataway, NJ). Потім колонки елюювали 200 ммоль/л фосфату натрію (рН 7,4), 50 ммоль/л NaCl, 0,03% (мас./Об.) ЕДТА і 0,02% (мас./Об.) Азиду натрію при витраті 0,4 мл/хв. Вміст холестерину в елюйованих фракціях вимірювали методом мікропланшетного аналізу. Холестерин сироватки та елюйованих фракцій визначали за допомогою набору реактивів ферментативного аналізу (Sigma, Сент-Луїс, Міссурі). Рівні Apo B-100 в об'єднаних фракціях LDL визначали за допомогою кролячих поліклональних антитіл (1: 500), спрямованих проти мишей apoB-100 (Biodesign International, Saco, ME), як описано раніше (40).
Кількісна ПЛР в режимі реального часу.
РНК виділяли з печінки за допомогою реагенту Trizol, придбаного в Invitrogen (Карлсбад, Каліфорнія). Синтез кДНК першого ланцюга проводили шляхом зворотної транскрипції 2 мкг загальної РНК за допомогою набору синтезу кДНК iScript від Bio-Rad (Hercules, CA). ПЛР у режимі реального часу проводили, використовуючи 2 мкл загальної кДНК у 25-мкл реакції, що містить QuantiTect SYBR Green PCR Master Mix (Qiagen, Валенсія, Каліфорнія) (послідовності праймерів, наведені в таблиці 2). Ампліфікацію проводили в двох примірниках для кожного зразка в детекторі послідовностей Applied Biosystems 7300 (Фостер-Сіті, Каліфорнія), і кількість мРНК нормалізували за допомогою GAPDH, що використовується як ендогенний контроль.
Таблиця 2. Праймери для кількісної ПЛР у реальному часі
Статистичний аналіз.
Дані представлені як середні значення ± SE. Порівняння між групами проводили за допомогою одностороннього ANOVA та методу Холма-Сідака для множинних попарних порівнянь. Для обчислення результатів використовували SigmaStat 3.0, а значимість визначали як P 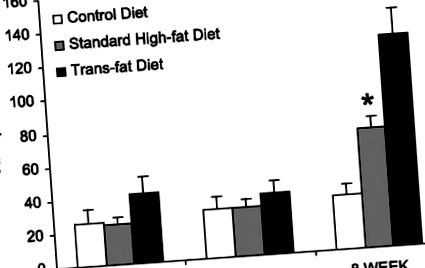
Рис. 1.Значення аланінамінотрансферази в сироватці крові (АЛТ). Через 10 днів та 4 тижні не спостерігалося значної різниці в значеннях АЛТ між групами. У 8 тижнів у групи трансжирів було більше значень АЛТ порівняно зі стандартною групою дієти з високим вмістом жиру та контрольною групою (*P
Трансжирені миші отримували меншу вагу після 8 тижнів порівняно зі стандартними мишами з високим жиром, але мали подібне збільшення стеатозу печінки.
Через 10 днів, 4 тижні та 8 тижнів за їх відповідною дієтою, у стандартних мишей з високим вмістом жиру та без жиру, збільшення кількості ваги порівняно з мишами, які отримували контрольну дієту. Однак за 8 тижнів миші з високим вмістом жиру набули більшої ваги, ніж миші, що годувались жирним жиром (рис. 2A). Через 8 тижнів у групах з високим вмістом жиру та трансжиру спостерігалося подібне збільшення вмісту печінкових тригліцеридів, і в обох групах вміст печінкових тригліцеридів був значно вищим, ніж у контрольної групи (рис. 2B).
Рис.2.Збільшення ваги та стеатоз печінки. A: через 10 днів, 4 тижні та 8 тижнів годування як трансжировими, так і стандартними групами з високим вмістом жиру мали більший приріст ваги порівняно з контрольною групою. За 8 тижнів група з підвищеним вмістом жиру набрала більше ваги, ніж група з жирною клітиною (*P
Рівень холестерину та тригліцеридів у сироватці крові у мишей, котрих годували нежирним жиром, і у стандартних мишей з високим вмістом жиру.
Рівні холестерину в сироватці крові у мишей з високим вмістом жиру були вищими, ніж у мишей, що годувались жирами через 10 днів, але статистично не відрізнялись від контрольної групи (табл. 3). Після 4 тижнів та 8 тижнів годування рівні холестерину були вищими у стандартних мишей з високим вмістом жиру порівняно з контролем, але не було значущої різниці у групі, яка годувалась трансжиром, порівняно з групою з високим вмістом жиру або контрольної групи. Аналіз ліпопротеїдів проводили за допомогою FPLC, і більшість холестерину у всіх групах складали ліпопротеїни високої щільності (ЛПВЩ). Рівні холестерину ліпопротеїдів низької щільності (ЛПНЩ) були дуже низькими і подібними у всіх групах, і, схоже, не було різниці в кількості апоВ-100 у фракції ЛПНЩ, що свідчить про суттєві зміни щільності частинок ЛПНЩ ( Додаткова рис. S1). Рівні тригліцеридів у сироватці крові були подібними між групами трансжирів та жирів у кожен момент часу (Таблиця 3).
Таблиця 3. Холестерин і тригліцериди в сироватці крові
Значення є середніми ± SE (P * трансжир проти стандартного жиру,
† стандартна дієта з високим вмістом жиру проти контролю.
Миші, які годують транс-жиром, демонструють більшу резистентність до інсуліну, ніж миші з високим вмістом жиру.
Рівень інсуліну натощак у транс-жирних мишей був вищим, ніж у контрольних мишей, яких годували дієтою, у кожен момент часу, і після 8 тижнів годування стандартні миші з високим вмістом жиру також мали значно вищі рівні інсуліну, ніж у контрольної групи. Через 4 тижні та 8 тижнів годування трансжирами призвело до значно вищих рівнів інсуліну натще у порівнянні зі стандартним годуванням з високим вмістом жиру (4 тижні: 5,3 ± 1,2 проти 1,4 ± 0,2 нг/мл, P
Рис.3.Рівні інсуліну в сироватці крові та кількісні значення індексу перевірки чутливості до інсуліну (QUICKI). A: рівні інсуліну натощак у групі транс-жирів були значно вищими, ніж у стандартної групи з високим вмістом жиру, протягом 4 тижнів та 8 тижнів. В обох групах рівень інсуліну був вищим, ніж у контрольної дієтичної групи через 10 днів та 8 тижнів (*P
Миші, яких годують трансжиром, демонструють змінений рівень лептину на рівні 8 тижнів.
Рівні лептину в сироватці крові визначали в кожен момент часу (рис. 4). Як стандартне годування з високим вмістом жиру, так і годування трансжирами призводило до підвищення рівня лептину в кожен момент часу порівняно з контрольним дієтичним годуванням; однак це досягло значущості лише через 8 тижнів. Крім того, у 8 тижнів сироватковий лептин був значно нижчим у мишей, що годувались без жиру, порівняно з мишами з високим вмістом жиру (24,8 ± 3,7 проти 41,0 ± 4,5 нг/мл, P
Рис.4.Рівень лептину в сироватці крові. Рівні лептину були вищими в групах, що містять транс-жир і в групах із високим вмістом жиру, порівняно з контролем на 8 тижнів. У 8 тижнів група трансжирів також продемонструвала нижчий рівень лептину, ніж група з високим вмістом жиру (*P
Трансжирені миші демонструють суттєво підвищену експресію гена IL-1β у печінці, а також підвищений рівень печінки IL-1β.
Експресія печінкових генів кількох про- та протизапальних цитокінів визначалася за допомогою кількісної ПЛР у реальному часі. Експресія гена IL-1β зростала з часом у кожній експериментальній групі. Через 4 тижні та 8 тижнів спостерігалося значне підвищення експресії гена IL-1β у печінці у мишей, що годувались трансжировим жиром, порівняно як з мишами, що харчувались високим вмістом жиру, так і з мишами, які годували контрольну дієту (рис. 5A). Експресія гена IL-1β у печінці у мишей, яких годували транс-жиром, була в 3,6 рази вищою за 4 тижні (P
Рис.5.Експресія та рівні гена IL-1β печінки. A: Експресія гена IL-1β зростала у кожній групі з часом. Через 4 тижні та 8 тижнів експресія IL-1β була значно вищою у групі трансжирів (**P
Таблиця 4. Експресія гена цитокінів печінки
Значення складають середні значення ± SE (P - пережирена жир проти стандартної високої жирності,
b трансжир проти контрольної дієти,
c стандартна дієта з високим вмістом жиру проти контролю,
d 4 тижні проти 10 днів,
e 8 тижнів проти 10 днів,
Хоча трансжири пов'язані з ішемічною хворобою серця, дисліпідемією та резистентністю до інсуліну, специфічний вплив трансжирів на печінку недостатньо вивчений (5, 16, 18, 34, 36, 37, 51). Ці експерименти демонструють, що миші, які харчуються з дієтою з перетворенням жиру, мають підвищену резистентність до інсуліну та вищі рівні АЛТ порівняно з мишами, які харчуються стандартною експериментальною дієтою з високим вмістом жиру. Це відбувається, незважаючи на розвиток подібного ступеня ожиріння та стеатозу печінки. Ці спостереження супроводжуються значним збільшенням експресії гена IL-1β та рівня цитокінів IL-1β у печінці. Підвищена резистентність до інсуліну та більш різке підвищення рівня АЛТ, що спостерігається у мишей, що годувались жирними кормами, свідчить про те, що ця модель може перекласти на жирову хворобу печінки людини, ніж звичайна дієта з високим вмістом жиру.
Інсулінорезистентність є критично важливою для розвитку НАЖХП, а тяжкість інсулінорезистентності корелює з більш розвиненими захворюваннями печінки (12, 15, 47). Дієта з високим вмістом насичених жирів і низьким вмістом поліненасичених жирів була пов’язана з підвищенням резистентності до інсуліну. Однак існують суперечливі докази щодо впливу харчових трансжирів на розвиток інсулінорезистентності та того, чи призводять вони до більшої інсулінорезистентності порівняно з насиченими жирами (16, 17). Ібрагім та ін. (18) продемонстрували, що заміна 2% енергії насиченими жирними кислотами та 1% енергії цис-мононенасичені жирні кислоти з 3% трансжирами призводили до ∼17% вищих рівнів інсуліну натще і знижували чутливість адипоцитів до щурів. Вони також показали, що трансжири зменшують текучість мембрани адипоцитів, і запропонували це як можливий механізм підвищеної резистентності до інсуліну в їх моделі. Альструп та ін. (3) також показав, що переклад-конформації жирних кислот 18: 1дельта-9 та 18: 1дельта-11 призвели до значно вищого виходу інсуліну з ізольованих клітин острівців миші порівняно з їх цис-конфігурації.
Добре описані взаємозв'язки між запальними цитокінами IL-1β, IL-6, TNF-α та IL-10 та SOCS-1 та SOCS-3 з резистентністю до інсуліну (9, 21, 22, 24, 44, 45, 50 ). Показано, що системно введений IL-1β посилює печінковий глюконеогенез; однак зв'язок між IL-1β та резистентністю до інсуліну в основному характеризується адипоцитами та бета-клітинами панкреатичних острівців (20, 23, 26, 30). У наших експериментах помітне збільшення експресії гена IL-1β в печінці через 4 тижні та 8 тижнів, на додаток до значно вищих рівнів печінкового IL-1β у 8 тижнів у групі, що годує трансжир, свідчить про роль IL-1β при вищій АЛТ та підвищеній резистентності до інсуліну. Як повідомляється, у людей генетичні поліморфізми в IL-1β пов'язані з підвищеним ризиком діабету 2 типу у північних індіанців, а також з підвищеним ризиком метаболічного синдрому у тих, хто споживає низьку кількість поліненасичених жирів (1, 46). TNF-α, IL-6, IL-10, SOCS-1 та SOCS-3 також були залучені як зв'язки між запаленням та резистентністю до інсуліну, але не спостерігалося значних відмінностей у мишей, які годувались з дієтою з переживанням жиру.
Відмінності в рівні холестерину в сироватці крові, мабуть, пов'язані з підвищеною часткою ЛПВЩ у групі, що годує з високим вмістом жиру, порівняно з групами, що містять жири та контрольну дієту. Хоча можливо, що годування трансжирами призводить до зниження рівня ЛПВЩ порівняно зі стандартним годуванням з високим вмістом жиру, невелика різниця у вмісті холестерину в раціонах обмежує висновки, які можна зробити з цього висновку. Вміст холестерину був низьким у всіх дієтах, і в раціони не додавали додаткового холестерину, однак у стандартній дієті з високим вмістом жиру було трохи більше холестерину порівняно з дієтами, що містять жири та контроль. Ця різниця була пов’язана з джерелом жиру, що використовується при дієтах: сало (тобто тваринне) з високим вмістом жиру в порівнянні з рослинним для трансжиру.
Одним із відомих обмежень стандартної моделі дієти з високим вмістом жиру НАЖХП є відсутність гістологічних ознак запалення або фіброзу у мишей, незважаючи на розвиток стеатозу та резистентності до інсуліну. Ми також провели експеримент з годуванням мишей трансжирами та стандартну дієту з високим вмістом жиру протягом 6 місяців, що не призвело до фіброзу печінки. Метою нашого експерименту було порівняти дію трансжирів з ефектом насичених жирів на печінку. Незважаючи на те, що годування мишей дієтою з перетворенням жиру протягом 8 тижнів не викликає прогресуючого стеатогепатиту, це призводить до більш вираженого підвищення рівня АЛТ та резистентності до інсуліну, синус-квандів жирової хвороби печінки людини.
NAFLD є незалежним предиктором серцево-судинних захворювань, навіть після контролю за іншими ознаками метаболічного синдрому (13, 48, 49). Кілька досліджень співвідносять споживання трансжиру з серцево-судинними подіями, і трансжири також були залучені як незалежний фактор ризику ендотеліальної дисфункції, системного запалення та дисліпідемії, що часто супроводжується захворюваннями на НАЖХП (11, 27, 33, 35). Жодних дієтичних досліджень щодо споживання трансжиру та НАЖХП не проводилось, і існує лише декілька досліджень, у яких брало участь невелика кількість пацієнтів, які вивчали б споживання жиру з дієтою, оскільки це стосується НАЖХП (32). Ці дані вказують на те, що миші, які харчуються дієтою з переживанням жирів, демонструють більш високі показники АЛТ у сироватці крові, підвищену резистентність до інсуліну та підвищений рівень IL-1β порівняно з мишами, які харчуються стандартною дієтою з високим вмістом жиру, незважаючи на подібну кількість стеатозу печінки. Потрібна додаткова робота, щоб зрозуміти молекулярні механізми, за допомогою яких трансжири можуть бути більш гепатотоксичними.
Дослідження, підтримані Американською гастроентерологічною асоціацією (AGA) Науково-дослідницькою премією (S. W. P. Koppe) та Національним інститутом діабету та хвороб органів травлення та нирок, RO1DK059580 (R. M. Green).
- Дієта людини - перевірений посібник з підвищення енергії, підвищеної життєздатності та вищих рівнів тестостерону
- Дуже довголанцюговий церамід С24 1 збільшується в позаклітинних везикулах сироватки зі старінням та консервами
- Коли Цукор; не так солодко - Як природно вилікувати резистентність до інсуліну - Genesis Gold
- Сприятливий вплив екстракту гарбуза на атерогенні ліпіди, інсулінорезистентність та окислювач
- Тригліцериди тканин, резистентність до інсуліну та наслідки виробництва інсуліну для гіперінсулінемії