Транскриптомічний аналіз між нормальними та високими споживаннями гусей забезпечує розуміння жирового відкладення та сприйнятливості до жирової печінки у перелітних птахів
Анотація
Передумови
Порушення регуляції адипогенезу викликає метаболічні захворювання, такі як ожиріння та жирова печінка. Такі мігруючі птахи, як гуси, мають високу толерантність до масового споживання енергії і мають незначний патологічний розвиток. Одомашнені породи гусей, похідні дикої грейлегської гуски (Ансер ансер) або лебідь гусак (Anser cygnoides), мають високу толерантність до споживання енергії, що нагадує їх предки. Таким чином, гуска потенційно є зразком виду для вивчення механізмів, пов’язаних з адипогенезом.
Результати
Висновки
Наші дослідження показують, що гуска використовує печінку як основну тканину для регулювання чіткого потоку синтезу та деградації ліпідів, а аналіз мережі динамічної експресії показав численні шари позитивної реакції як на масове споживання енергії, так і на можливий патологічний розвиток. Наші результати дають уявлення про адипогенез гусей і дають нову перспективу для досліджень порушення людської метаболічної дисрегуляції.
Передумови
Баланс накопичення енергії та витрат енергії є критичним для нормального жирового відкладення та ліпідного обміну. Жирова тканина була визнана головним ендокринним органом і виступає господарем адипогенезу у ссавців [1]. Надмірне споживання енергії призводить до збільшення обсягу та маси адипоцитів та спричиняє порушення регуляції ліпідного обміну в організмі [2]. Така дисрегуляція відображається змінним відкладенням ліпідів у різних жирових тканинах, і це, як правило, пов’язано з аномальним накопиченням ліпідів у печінці, що може призвести до стеатозу та ожиріння [3]. На відміну від ссавців, перелітні птахи демонструють чіткий характер відкладення ліпідів і використовують печінку замість жирової тканини як головний орган ліпідного обміну [4,5,6].
Результати
Фенотипічні зміни печінки та жирової тканини після годування з високим споживанням
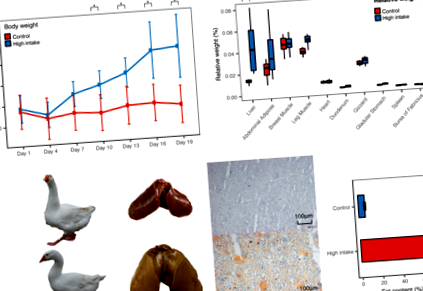
До кінця процесу відгодівлі маса тіла зросла на 32,3% (стор-значення = 8,30 * 10 - 4, згин = 1,32), а група з високим споживанням була значно важчою, починаючи з 10-го дня періоду відгодівлі (рис. 1а, додатковий файл 7). Тканини, пов’язані з метаболізмом ліпідів, були важчими після відгодівлі, причому печінка найбільше зросла у відносній вазі в 3,35 рази (стор-значення = 0,0011, рис. 1б, додатковий файл 8), порівняно з жировою тканиною живота, збільшеною в 1,65 рази. Більше того, після того, як ми оцінили вміст ліпідів у печінці, ми виявили, що він різко збільшився з 6,22 ± 0,83% до 73,56 ± 1,14% (рис. 1в), що значною мірою сприяло збільшенню ваги жирної печінки. Червоне масляне фарбування з наступною інтегральною оптичною щільністю (IOD) також підтвердило значне відкладення ліпідів у печінці (рис. 1в, додатковий файл 1).
Фенотипові відмінності між нормальними та гусями, що харчуються з високим споживанням. a Послідовні зміни ваги. b Абсолютна вага та відносна вага тканин. Відносна вага = абсолютна вага/маса тіла. c Збільшені фотографії печінки, відповідне заморожене фарбування червоною олією та екстракція Сокслета вмісту ліпідів у печінці. Фотографії гусей та печінки були зроблені у гусей, використаних у цьому дослідженні
Транскриптомічна різниця печінки та жирової тканини після годування з високим споживанням
Щоб дослідити зміни динамічної експресії, спричинені харчуванням з великим споживанням, ми створили середнє значення
11.50 Гб високоякісних даних про РНК-послідовності. Ми ідентифікували в середньому 77,44% кодуючих білок генів з FPKM ≥0,1 та 1702 передбачуваних lncRNA (більшість lncRNA були чутливими міжгенними lncRNA (44,6%), за якими йдуть розбіжні lncRNA та інші 3 категорії, додатковий файл 2). Ці lncRNA показали схожі характеристики експресії з іншими дослідженнями [13].
Існували суттєві відмінності між тканинами як в профілях мРНК, так і в профілях lncRNA (середньозважена дисперсія пропорції = 0,47 та 0,55 відповідно), з подальшою взаємодією між лікуванням та тканиною (середньозважена дисперсія частки = 0,16 у профілях мРНК) або лікування (середньозважена) дисперсія пропорції = 0,16 у профілях lncRNA), що вказує на те, що основним фактором відмінності експресії є тканина, а ефект лікування на моделі експресії lncRNA більший, ніж структури експресії mRNA (Додатковий файл 3).
Неконтрольована кластеризація також повторила чітку картину експресії між печінкою та жировою тканиною (рис. 2а). Структури кластеризації, в яких домінують тканини, та чіткі моделі кластеризації печінки між групами виявляють переважні відмінності між тканинами, і лікування печінки більше зачіпається. Внутрішньогрупова кореляція між тканинами також підтвердила нижчу кореляцію між жировою тканиною та печінкою, ніж між двома жировими тканинами (рис. 2б). Зразок контрольної групи C2-SA показав нижчу кореляцію з жировою тканиною загалом, ми припускаємо, що ця проба частково забруднена тканинами, такими як шкіра.
Транскриптомічні зміни для кожної тканини та кожної групи. a Матриця кореляції Пірсона для профілів мРНК та профілів lncRNA. b Внутрішньогрупова кореляція кожної пари тканин. c Діаграма Венна за кількістю диференційовано виражених генів між нормально вигодованими гусями та гусями з високим споживанням. АА - черевна жирова, СА - підшкірна жирова. Т - група з високим споживанням, С - контрольна група
Гени, що кодують білок, що беруть участь у динамічному метаболізмі ліпідів
Ми виявили понад 6000 DEG між печінкою та жировою тканиною (як в нормальному, так і в режимі харчування), порівняно з лише
400 градусів між двома жировими тканинами. Ми виявили 1930 DEG у печінці (13,97% з 13 815 експресуючих генів з FPKM> 0,1) порівняно з 1045 (6,60% з 15 829 генів з FPKM> 0,1) та 891 DEG (4,73% з 18 839 генів з FPKM> 0,1) у черевній жировій клітковині та підшкірної жирової клітини після годування з високим споживанням, відповідно (рис. 2в). Виявлення більш ніж подвоєної кількості DEG в печінці порівняно з жировою, і велика кількість печінково-специфічних DEG підтверджує гіпотезу про те, що печінка відіграє роль у метаболізмі ліпідів під час годування з великим споживанням.
Як і очікувалося від змін, що спостерігаються у фенотипі, ДЕГ, виявлені в печінці, брали значну участь у метаболічних шляхах, таких як метаболізм амінокислот, метаболізм вуглецю та імунна відповідь. Ці гени, як правило, функціонують у зв'язуванні АТФ, зв'язуванні з білками, процесі окисного відновлення та глюконеогенезі (рис. 3а). Подібне збагачення ДЕГ, виявлених у жировій і підшкірній жировій клітковини, спостерігалось, і більшість збагачених шляхів та термінів ГО були пов'язані з метаболізмом, як очікувалося. Зміни в метаболічних процесах були пов’язані з підвищенням регуляції експресії в печінці при надмірному споживанні енергії (додатковий файл 4). Ми також помітили, що ДЕГ, що регулюються вниз, більше беруть участь в імунній відповіді, особливо шляхи, пов'язані з раком (Додатковий файл 4). Потрібно додатково досліджувати зв'язок між змінами експресії та незначним або відсутністю патологічного розвитку у гусака.
Ми виявили експресію 14 із 20 раніше виявлених мітохондрій гусей та важливих генів, пов'язаних з ядерними мітохондріями [14]. Гени мітохондрій не виявляли значної реакції на годування з високим споживанням, і більшість із них не виявляли значних змін у експресії в 3 досліджених нами тканинах (додатковий файл 5). Аналіз збагачення генів показав, що ядерні гени, пов'язані з мітохондріальними функціями окислення-відновлення (скориговано стор-значення = 3,96 * 10 - 4) та мітохондріальна матриця (скоригована стор-значення = 8,54 * 10 - 10) суттєво регулювались (додатковий файл 6). Такі гени, як малатдегідрогеназа 2 (MDH2) регулювався вгору після того, як годування з високим споживанням з печінкою показало найбільшу зміну (зміна складок = 2,01, 0,92 та 0,94 у печінці, жировій тканині живота та підшкірній жировій клітковині відповідно). Підвищена інтенсивність метаболізму мітохондрій свідчить про підвищене виробництво та споживання енергії, що очікується від фенотипових змін та лікування.
Тривалі некодирующие РНК пов'язані з утворенням жирової печінки
Прогнозування функцій lncRNA. a Збагачення висококорельованих мРНК різних типів lncRNA. LncRNA були розділені на 5 панелей залежно від їх типу та позначені з чітким кольором на круговій діаграмі. Секторні діаграми показують відсоток диференційовано експресованих генів (DEG) серед корельованих генів. b Виставка можливої cnc-діючої lncRNA XLOC_292762 яка знаходить 5700 bp нижче за течією. Шкала вираження XLOC_292762 відрізняється від FERMT2
Обговорення
Накопичення ліпідів, переважно триацилгліцерину (ТАГ), у гепатоцитах є ключовою передумовою розвитку неалкогольної жирової хвороби печінки (НАЖХП) у людини. Неестерифіковані жирні кислоти в сироватці крові (NEFA) є найбільш домінуючим джерелом накопичення ліпідів у печінці [3]. Основними джерелами, що сприяють рівню сироваткової NEFA, є NEFA, отримана з потоку жирних кислот у жировій тканині та з хіломікронів через переливання ліпопротеїнів [18]. Потік жирних кислот у жировій тканині використовує шлях de novo lipogenesis для синтезу жирних кислот з 2-вуглецевих попередників, виготовлених з харчової глюкози. Дослідження показали, що у пацієнтів з неалкогольною жировою хворобою печінки підвищений маси вісцеральної та підшкірної жирової тканини. Сучасні терапевтичні стратегії для хворих на НАЖХП зосереджені на зменшенні потоку жирних кислот жирової тканини [19], вказуючи на важливу роль жирових тканин у регуляції ліпідного обміну.
Досліджуючи закономірності експресії генів, що кодують білок, фенотипічна різниця також відображалася на загальноприйнятих шаблонах транскриптома. Чітка сегрегація профілів експресії печінки в генах, що кодують білки, та відсутність домінуючої моделі експресії серед жирових профілів показали, що існує чітка різниця між гусячою печінкою, але не жировою тканиною після нормального годування та годування з великим споживанням (рис. 2а). Більш високі середні коефіцієнти кореляції між двома жировими тканинами також показали високу схожість між гусями з двох груп годівлі (рис. 2б). Подібні результати спостерігалися у курей, які виявили більші зміни в печінці, ніж жирові тканини [25].
Під час процесу зненасичення, опосередкованого SCD, двовуглецевий ацетил-КоА вступає в цикл лимонної кислоти для утворення АТФ. Останні кілька реакцій циклу лимонної кислоти відбуваються в мітохондріях, а не в цитоплазмі, і ці етапи є останніми етапами бета-окислення жирних кислот. Незважаючи на те, що наші результати показали, що гени мітохондріального геному не були диференційовано виражені, гени, пов'язані з ядерними мітохондріями, були регульованими. Ці гени включають MDH2, який кодує розташовану в мітохондріях малатдегідрогеназу 2 та відіграє центральну роль у човнові малат-аспартат [27]. Наші результати узгоджуються з попередніми дослідженнями, які виявили, що п'ять генів, пов'язаних з ядерними мітохондріями, були регульовані в жировій печінці гусей [28], і знову ж таки, різниця в рівнях експресії цих генів у печінці, жировій тканині черевної порожнини та підшкірній жировій тканині Підтвердьте наше спостереження, що печінка відігравала ключову роль у процесі регуляції.
Зазвичай неконтрольована НАЖХП перетворюється на неалкогольний стеатогепатит, який є більш важким захворюванням із запаленням клітин печінки та пошкодженням клітин [29]. Безалкогольний стеатогепатит також є попередником раку печінки. У наших результатах ми виявили цікаву регуляцію зниження деяких важливих шляхів раку, таких як сигнальні шляхи PI3K-Akt та cGMP-PKG. Ці шляхи значною мірою беруть участь у таких процесах, як пухлиноутворення [30, 31]. Наші результати показали ключові гени цих шляхів, такі як PI3K і ПКГ були регульовані вниз. Незважаючи на те, що ще рано робити висновок про значення регулювання цих шляхів, ми вважаємо, що наші результати свідчать про те, що гусак мало розвиває патологічний розвиток жирової печінки.
Ортологічне співвідношення 1519 генів ожиріння ссавців. a Ортологічний взаємозв'язок генів ожиріння між гуском та куркою або гусі та людиною. b Частка DEG у кожній категорії відносин. Цифри, позначені на смужці, показують загальну кількість сімейств генів у цій категорії. Більшість із цих генів мали ортологічне відношення 1: 1 до людини (74,66%), а більше генів було 1: 1 ортологічно генам курей (80,53%). Деякі сімейства генів продемонстрували або скорочення (7,16 та 5,34% для людини та курки відповідно) або розширення (1,96 та 8,08% для людини та курки відповідно). Диференціально експресовані гени, виявлені в печінці, також показали сильне збагачення серед цих генів ожиріння (хі-квадрат стор-значення = 4,42 * 10 - 4). Більшість ДЕГ мали спільні ортологічні стосунки з людиною (або куркою) у співвідношенні 1: 1 і становили 18% усіх генів ожиріння 1: 1 (або 18,49% генів ожиріння 1: 1).
Враховуючи, що ми знайшли
80% генів ожиріння були ортологами 1: 1 у курей та людей, і той факт, що у одомашненої гуски не розвивається патологічний стеатоз печінки при високому споживанні, ми вважаємо, що повне розуміння генетичного механізму формування гусячої жирної печінки допоможе роз’єднати наслідки ожиріння та безалкогольної жирової печінки людини.
Висновки
У цьому дослідженні ми виявили, що гуска використовує печінку як основну тканину для регулювання чіткого синтезу ліпідів і потоку деградації. Для переробки додаткової енергії регуляція експресії генів сильніша в гусячій печінці, ніж у жировій тканині. Це відрізняється від профілів експресії у ссавців. Ми продемонстрували за допомогою динамічного аналізу мереж експресії, що існує чимало шарів позитивних реакцій як на масове споживання енергії, так і на можливий патологічний розвиток. Здатність депонувати велику кількість жирних кислот у печінці замість жирових тканин та регуляція багатьох метаболічних генів потребують подальшого аналізу, щоб виявити генетичний механізм, що стоїть позаду. Наші результати дають уявлення про адипогенез гусей і дають нову перспективу для досліджень порушення людської метаболічної дисрегуляції.
Методи
Тварини та їх лікування
Збір зразків та загальна РНК-секв
Ми збирали печінку, жирову клітку живота, підшкірну жирову клітковину, серце, м’язи молочної залози, м’язи ніг, дванадцятипалу кишку, шлунок, залозистий шлунок, селезінку та бурсу фабрикуса від кожної гуски. Тканинні ваги збирали і зразки тканин перекладали в рідкий азот відразу після вилучення з тіла.
Для загальної послідовності РНК ми випадковим чином відібрали 3 особи як біологічні копії як з нормальної, так і з групи споживання з високим споживанням. Загальну РНК із печінки, черевної жирової та підшкірної жирової тканини для кожної особини (загалом 18 зразків) витягували за допомогою RNeasy Mini Kit (QIAGEN, Німеччина), дотримуючись інструкцій виробника. Цілісність РНК перевіряли Agilent Bioanalyzer 2100 (Agilent Technologies, CA, USA). Потім зразки із середнім значенням RIN = 7,59 (від 7 до 8,6) були направлені в Novogene (Тяньцзінь, Китай) для створення парних бібліотек. Усі бібліотеки були послідовно описані Illumina Hiseq X 10 згідно протоколів Illumina від Novogene з тривалістю зчитування 150 bp. Стандартний контроль якості та фільтрація низькоякісних показань був проведений Novogene, а чисті показники були надані для подальшого аналізу.
Вирівнювання та складання транскриптома
Чисті зчитування були зіставлені з референтним геномом гусака, який включає мітохондріальний геном (AnsCyg_PRJNA183603_v1.0), використовуючи Bowtie2 [37] та сплайсинг зчитування, Tophat2 [38] із аргументами за замовчуванням. Tophat2 використовує сплайсинг інформації з довідкового файлу анотацій (файл GTF) для керівництва відображенням зчитувань RNA-seq. Потім файли BAM для кожної бібліотеки збиралися запонками (V2.1.1) [39] за допомогою –Г аргумент, який викликає збірку стенограм на основі посилань на анотації, de novo складання стенограм з використанням імовірнісної моделі та кількісно визначає вираз зібраних стенограм одночасно. Відносний вираз повідомлявся як фрагменти на кілобазу стенограм на мільйон відображених читань (FPKM). Запонки генерували зібрані розшифровки у форматі файлу GTF для всіх людей, і згодом вони були об'єднані тканиною за допомогою Cuffmerge. Для всіх анотованих генів коефіцієнти експресії Пірсона вираховували для 18 зразків. Аналіз принципових дисперсійних компонентів (PVCA) проводився за допомогою пакету R pvca (https://www.bioconductor.org/packages/release/bioc/html/pvca.html).
Ідентифікація довгих некодуючих РНК
- МЕТОД СУХОГО ВАГОВОГО РАНГУ ДЛЯ БОТАНІЧНОГО АНАЛІЗУ ПАСИЩ - Mannetje - 1963 - Трава та
- Підхід DIR до дитячого годування 27-28 вересня в Грінвуд-Віллідж, штат Колорадо, PCDA
- Вплив сезонних змін у селективному годуванні мідіями зебри (Dreissena polymorpha) на
- Ультраперероблена їжа пов’язана з ожирінням та хворобами - то чому ми годуємо нею своїх дітей
- Чому більше власників домашніх тварин годують своїх собак як вовків Chattanooga Times Free Press