Трансекція передньої хрестоподібної зв’язки змінює баланс жирних кислот n-3/n-6 в інтрапателлярній жировій подушці лапіни
Анотація
Передумови
Інфрапателлярна жирова подушечка (ІФП) колінного суглоба останнім часом приділяється багато уваги завдяки її зростаючій ролі в патогенезі остеоартриту (ОА), де вона проявляє запальний фенотип. Метою цього дослідження було вивчення складу інфрапателлярної жирної кислоти (ФК) у кролика (Oryctolagus cuniculus) модель раннього ОА, створеного перерізом передньої хрестоподібної зв’язки (ACLT).
Методи
ОА індукували випадково в лівому або правому колінному суглобі скелетно зрілих новозеландських білих кроликів за допомогою ACLT, тоді як контралатеральне коліно залишали цілим. Окремою групою неоперованих кроликів служили контролі. IFP ACLT, контралатерального та контрольного колін збирали після евтаназії через 2 або 8 тижнів після ACLT і їх склад FA визначали за допомогою газової хроматографії – мас-спектрометрії.
Результати
Коефіцієнт поліненасичених FA (PUFA) n-3/n-6 змістився у протизапальний напрямок після ACLT, що спостерігалося вже через 2 тижні після операції (0,20 ± 0,008 проти 0,18 ± 0,009). Через 8 тижнів профіль FA групи ACLT характеризувався підвищеними відсотками 20: 4n-6 (0,44 ± 0,064 проти 0,98 ± 0,339 моль.%) І 22: 6n-3 (0,03 ± 0,014 проти 0,07 ± 0,015 моль-%) та зі зменшеними сумами мононенасичених FA (MUFA) (37,19 ± 1,586 проти 33,20 ± 1,068 моль-%) та співвідношеннями PUFA n-3/n-6 (0,20 ± 0,008 проти 0,17 ± 0,008). Підпис ФА контралатеральних колін у більшості аспектів нагадував підпис неоперованого контролю, але мав збільшені пропорції загальної кількості ПНЖК n-3 і зменшену суму MUFA.
Висновки
Ці висновки дають нову інформацію про вплив раннього ОА на інфрапателлярний профіль ФА в моделі кролика ACLT. Зниження співвідношення ПНЖК n-3/n-6 IFP відповідає запаленню та деградації хряща на ранніх стадіях ОА та може сприяти патогенезу захворювання.
Передумови
Артроз (ОА) є дегенеративним захворюванням суглобів та основною причиною болю та інвалідності у людей похилого віку [1]. Характеризується прогресуючою деградацією суглобового хряща, реконструкцією субхондральної кістки та синовітом. Основними факторами ризику розвитку ОА є вік, стать жінок, ожиріння, травматична травма суглоба та професійне навантаження на суглоби [2]. Вважається, що ожиріння є фактором, що схильний до ОА через механічні перевантаження, але інфільтрація жирової тканини та імунних клітин також може сприяти патогенезу ОА, виробляючи адипокіни та цитокіни [3, 4]. Як правило, ожиріння характеризується системним запальним станом та незбалансованим профілем поліненасичених жирних кислот (ПНЖК) в організмі [5, 6]. Крім того, збільшення співвідношення n-6/n-3 PUFA у плазмі пов'язане із посиленням болю в коліні та зниженням функції [7], що свідчить про потенційні наслідки для ОА. З іншого боку, переріз передньої хрестоподібної зв’язки (ACL) - це добре встановлена хірургічна модель ОА [8]. Пошкодження ACL може призвести до утворення медіаторів запалення через ненормальне, травматичне навантаження на хрящ, що сприяє прогресуванню ОА [9].
Жирова подушечка Гоффи, або інфрапателлярна жирова подушечка (ІФП), нещодавно з’явилася як джерело запалення в ОА коліна [4]. Це внутрішньокапсульна, але екстрасиновіальна структура жирової тканини колінного суглоба, де 98% жиру складається з нейтральних ліпідів (переважно триацилгліцеринів, ТАГ) та 1% фосфоліпідів (PL) [10]. Раніше вважалося, що ІФП є переважно структурною жировою тканиною, необхідною для належної роботи коліна, але останні дані вказують на те, що це метаболічно активна ділянка суглоба, яка може впливати на цілісність сусідніх тканин [4]. IFP може взаємодіяти з синовіоцитами та хрящами та викликати як захисну, так і активізуючу діяльність при ОА. Як ендокринний орган, він виділяє адипокіни, цитокіни, жирні кислоти (FA) та ліпідні медіатори, отримані з PUFA (LM). ІФП пацієнтів з ОА має запальний фенотип, що характеризується секрецією адипокінів та цитокінів, а також складом імунних клітин [3].
Оскільки ФА виявляє імуномодулюючі властивості, було висловлено гіпотезу про те, що їх профілі в циркуляції та синовіальній рідині можуть змінюватися при ОА, що сприяє прогресуванню захворювання [11]. N-3 та n-6 PUFA є важливими гравцями багатьох захворювань, оскільки вони перетворюються в різні серії ейкозаноїдів за допомогою циклооксигеназ (COX), ліпоксигеназ та монооксигеназ цитохрому P450 [12]. N-6 PUFA є попередниками прозапальної LM, тоді як n-3 PUFA виробляє менше запальної або розсмоктуючої LM. N-3 PUFA також частково замінює 20: 4n-6 з мембрани PL і конкурує з n-6 PUFA для десатураз, елонгаз та COX [13]. Збільшення кількості дієтичного n-3 PUFA може зрушити баланс продукованих ейкозаноїдів у більш корисний напрямок [5]. N-3 PUFA також може пригнічувати запалення, регулюючи експресію генів шляхом взаємодії з ядерними рецепторами та факторами транскрипції. Риб’ячий жир, що містить довголанцюговий ПНЖК n-3, можна вважати нутрицевтиками з потенційно сприятливим впливом на циркулюючі ліпідні профілі [14].
Методи
Усі експериментальні процедури були затверджені Комітетом з догляду за тваринами в Університеті Калгарі (№ AC11–0035) та проводились відповідно до рекомендацій Канадської ради з догляду за тваринами. Скелетно зрілі новозеландські білі кролики (штам 052 CR, n = 22 жінки, вік 12 місяців, 4,8 ± 0,08 кг) були отримані від Charles River Laboratories Inc. (Saint-Constant, QC, Канада). Кроликів транспортували до Університету Калгарі, де їх розміщували в окремих клітках (76 × 64 × 41 см) при 12 L: 12D і ≈ 23 ° C протягом 4 тижнів до експерименту. Кролики мали вільний доступ до води та гранульовану підтримуючу дієту (5326 * Laboratory Rabbit Diet HF, LabDiet, St. Louis, MO, USA; http://www.labsupplytx.com/wp-content/uploads/2013/07/ 5326-Laboratory-Rabbit-Diet-HF.pdf).
Через 2 або 8 тижнів тваринам знеболювали ізофлуран, як описано вище, згодом евтаназували внутрішньосерцевою ін’єкцією пентобарбіталу натрію (200 мг/кг; Euthanyl, Bimeda-MTC Animal Health Inc., Cambridge, ON) та відбирали проби в 07.00–12.00 год. Коліна розсікали на 2–3 см вище і нижче колінного суглоба, а м’язи видаляли, дозволяючи чітко візуалізувати всі зв’язки. IFP розсікали ножицями за зв'язкою надколінка, поміщали в пробірку для зразків об'ємом 1,5 мл, заморожували в рідкому азоті та зберігали при -80 ° C. Кількість контрольних, ACLT та контралатеральних зразків становила 6, 8 та 8 через 2 тижні та 8, 7 та 7 через 8 тижнів після ACLT, відповідно. Зразки транспортували на сухому льоду до Фінляндії для подальшої переробки. Раніше повідомлялося, що у тих самих експериментальних тварин виявляються ознаки раннього ОА [22].
Для аналізів FA підпроби IFP трансметилювали в метанольній H2SO4 в атмосфері азоту [23], а утворені метилові ефіри FA (FAME) екстрагували гексаном та аналізували газовим хроматографом Shimadzu GC-2010 Plus (Shimadzu, Кіото, Японія ) оснащений автоматичним інжектором, детектором полум'яної іонізації (FID) та ZB-восковими капілярними колонками (Phenomenex, Torrance, CA, USA). Ідентичність структур FAME була підтверджена за допомогою електронних мас-спектрів удару, записаних Shimadzu GCMS-QP2010 Ultra з селективним детектором мас. Отримані хроматографічні піки від FID інтегрували вручну із програмним забезпеченням GCsolution (v2.41.00) Шимадзу. Результати представлені у вигляді складу FA (мовляв.%) Загальних ліпідів IFP. Співвідношення продукт/попередник n-3 та n-6 PUFA розраховувались наступним чином: (20: 5n-3 + 22: 6n-3)/18: 3n-3 та 20: 4n-6/18: 2n-6.
Статистичне порівняння профілів FA між досліджуваними групами проводили з використанням узагальненої лінійної моделі (IBM SPSS vПрограмне забезпечення 21.0, IBM, Armonk, NY, США). Модель проводили з нормальним розподілом ймовірностей залишків. Досліджуваний параметр обрано як залежну змінну, експериментальну групу - як фактор моделі, а час - як коваріату. Модель включала як експериментальну групу, так і час як основні ефекти, а також взаємодію часу × групи. Зміни маси тіла перевіряли за допомогою парних зразків т-тести. стор значення
Результати
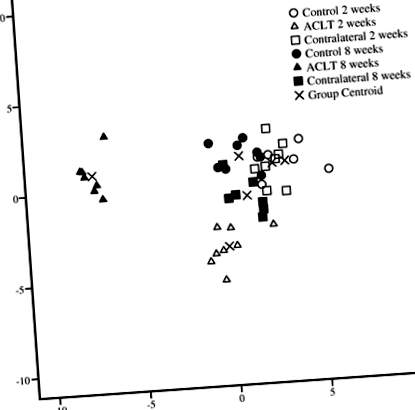
У дискримінантному аналізі 2- та 8-тижневі групи ACLT класифікувались окремо одна від одної та окремо від відповідних контрольних та контралатеральних колін, останні з яких були згруповані на основі складу IFP FA (рис. 1) . Первинні ФА, що розділяють групи, включали 16: 1n-9, 22: 6n-3, 22: 5n-3, 20: 4n-6, 20: 3n-6 та 20: 5n-3 (для функції 1) та 18: 2n-6 (для функції 2). Аналіз класифікував 100% зразків правильно на основі досліджуваної групи.
Дискримінантний аналіз, що демонструє класифікацію підписів жирних кислот інфрапателлярної жирової подушки кролика в різних досліджуваних групах на основі дискримінантних функцій 1 і 2. Переріз передньої хрестоподібної зв’язки ACLT
Щодо окремих ФА через 2 тижні після ACLT, ІФП групи ACLT мав вищі пропорції 16: 1n-9, C20-22 насичений FA (SFA) і 24: 1n-9, нижчий відсоток 17: 1n-8, і нижчий коефіцієнт PU-n-3/n-6, ніж контроль (рис. 2 і 3; додатковий файл 1: таблиця S1). Профілі FA у контралатеральних колінах були подібними до тих, що були отримані для колін контрольної групи, але відрізнялися від групи ACLT наступним чином: пропорції 17: 1n-8 та співвідношення PU-n-3/n-6 PUFA були нижчими в ACLT група та відсотки 18: 3n-6, C20–24 SFA, 20: 1n-9, 22: 1n-7, 22: 4n-6 та 24: 1n-9 були вищими.
Відносні зміни (%) пропорцій виділених жирних кислот (FA) в інфрапателлярній жировій подушці кроликів через 2 та 8 тижнів після перерізу передньої хрестоподібної зв’язки (ACLT) порівняно з контролем у той самий момент часу. Негативні значення вказують на те, що ФА зменшився пропорційно через ACLT, а позитивні - на його збільшення, значення, розраховані як (середній моль-% у ACLT - середній моль-% у контролі)/середній моль-% у контролі
Через 8 тижнів IFP групи ACLT мав вищі пропорції 15: 0, 16: 1n-9, 17: 0i, 17: 0ai, 18: 3n-6, C20–24 SFA, 20: 4n-6, 20: 4n-3, 22: 1n-9, 22: 4n-6, 22: 5n-3, 22: 6n-3 та 24: 1n-9, ніж контролі, і нижчий відсоток загального мононенасиченого FA (MUFA) і нижчий коефіцієнт PUFA n-3/n-6 (рис. 2 і 3; Додатковий файл 1: Таблиця S1). Відсотки були вищими для 18: 3n-3 та загального n-3 PUFA та нижчими для 17: 1n-8, 20: 1n-7 та загального MUFA у контралатеральних колінах, ніж у контрольних групах. Коліна ACLT показали вищі пропорції 15: 0, 16: 1n-9, 17: 0i, 17: 0ai, C20–24 SFA, 20: 1n-9, 20: 4n-6, 20: 4n-3, 22: 4n-6, 22: 5n-3, 22: 6n-3, і більшість C22–24 MUFA і вище n Співвідношення продукту/попередника PUFA -3 та n-6 у порівнянні з контралатеральною групою, тоді як відсотки 18: 3n-3 та загального n-3 PUFA, а також співвідношення n-3/n-6 PUFA були нижчими.
Порівнюючи 2-тижневих та 8-тижневих тварин, спостерігалося збільшення пропорцій IFP на 16: 1n-9, 18: 1n-9, 19: 1n-8, 20: 0, 20: 4n-3, 24: 0, 22: 6n-3 та співвідношення продукт/попередник для n-3 PUFA та зменшення для 18: 2n-6, 18: 3n-3, n-6 PUFA, n-3 PUFA та загальний PUFA від 2 тижнів до 8 тижнів, переважно щодо груп ACLT (рис. 2; додатковий файл 1: таблиця S1). Значне взаємодія часу × групи спостерігалось для 16: 1n-9, 17: 0i, 17: 1n-8 та 24: 0 (додатковий файл 1: таблиця S1).
Оперовані кролики мали дещо негативний енергетичний баланс і через 2 тижні після операції втратили 8,7 ± 1,30% маси свого тіла та 8,0 ± 2,71% через 8 тижнів порівняно з початковою масою тіла (в парі т-тест, стор
Обговорення
Вплив ОА на ранніх стадіях на ФА-склад ІФП досліджували на кроликовій моделі ACLT через 2 та 8 тижнів після хірургічного втручання. Основними висновками цього дослідження були такі i) ACLT змінив інфрапателлярне співвідношення n-3/n-6 PUFA у напрямку до запального фенотипу, ii) профіль FA IFP був змінений вже через 2 тижні після ACLT, iii) індуковані ACLT зміни пропорцій певного ФА стали більш вираженими через 8 тижнів, і iv) підпис ФА контралатерального коліна у більшості аспектів нагадував підпис неоперованого контролю, але за деякими вартими уваги винятками.
Спостережуване зниження співвідношення n-3/n-6 PUFA IFP може сприяти запаленню та деградації хряща на початку ОА. Це також узгоджується з нашими даними, що свідчать про підвищену експресію мРНК запальних та погіршуючих хрящову тканину факторів інтерлейкіну IL-6, матриксної металопротеїнази MMP-3 та MMP-13 у суглобовому хрящі кролів, які отримували подібне лікування, через 2 тижні після ACLT [24 ]. Як екстрасиновіальний орган, ІФП безпосередньо не взаємодіє з хрящем, проте пропонується бути джерелом адипокінів, цитокінів, ФА та ЛМ, які можуть сприяти патофізіологічним процесам при ОА [3, 15]. Інші проблеми зі здоров’ям, пов’язані з ОА, включають ожиріння та системне запалення низького ступеня [2, 25]. Ожиріння також пов’язане зі зміною дієтичного, а отже, і балансу PU-3/n-6 в організмі, що має потенційні наслідки для ОА [6, 7]. Співвідношення n-3/n-6 PUFA є важливим, оскільки n-6 PUFA підвищує рівень білка COX-2 та продукцію PGE2 у хондроцитах [11, 26]. Збільшення частки 20: 4n-6 в ІФП групи ACLT відповідає попереднім висновкам Гірмана та співавт., Які відзначали, що секреція 20: 4n-6 була вищою від ІФП пацієнтів з ОА порівняно з пост -донорські донори без ОА [15].
Навпаки, n-3 PUFA метаболізуються в менш запальний або про-розсмоктуючий LM [12, 27] і мають антидеструктивну дію на хрящі [16, 17]. У хондроцитах n-3 PUFA, причому 20: 5n-3 є найбільш ефективним, зменшують експресію COX-2, IL-1α та ІЛ-1β, фактор некрозу пухлини-α, агреганази ADAMTS4–5, MMP-3 та MMP-13 [16]. Крім того, n-3 PUFA може брати участь у реконструкції кісток, сприяючи остеобластогенезу [28]. Підвищений відсоток 22: 6n-3 в колінах ACLT у кроликів схожий на попередні дані пацієнтів з ОА [15]. Оскільки було показано, що ІФП викликає як захисну, так і посилюючу хворобу активність в ОА [4], розщеплюючі ЛМ, такі як резольвіни, протеїни та марезини, отримані з 22: 6n-3, можуть потенційно сприяти шляхам розв’язання, активуються в OA [27, 29]. На додаток до здоров’я суглобів, довголанцюговий ПНЖК n-3 може благотворно впливати на дисліпідемію та серцево-судинну систему [14].
Профіль FA IFP вже був змінений через 2 тижні після ACLT. Зазвичай уражені ФА мали незначні пропорції, і найцікавішою зміною було зменшення співвідношення ПНЖК n-3/n-6. Згідно з попередніми висновками у кролячої моделі, перші ознаки ОА зазвичай документуються через 4 тижні після ACLT [21, 30,31,32]. Сюди входять знижений вміст протеоглікану (ПГ), фібриляція та знижена біомеханічна жорсткість [20, 33]. Встановлено, що мінеральна щільність кісткової тканини знижується, а кровотік у навколосуглобовій кістці збільшується через 2 тижні після ACLT [34]. Оянен та ін. повідомляли про втрату фіксованої щільності заряду із суглобового хряща через 2 тижні після ACLT [22]. Відомо, що підпис ФА у жировій тканині/плазмі швидко змінюється у відповідь на різні подразники, наприклад, натще і зміни дієти [35, 36]. На цьому тлі очікувалося, що змінені профілі ФА через 2 тижні втручання можуть представляти ранні реакції на запалення та пошкодження тканин. Це також може бути пов'язано зі зменшеною фіксованою щільністю заряду ПГ, про яку повідомлялося раніше [22].
Частка загальної кількості MUFA також була зменшена в колінах ACLT через 8 тижнів після ACLT. Можлива роль MUFA в ОА незрозуміла, але 18: 1n-9 чинив антидеструктивну та протизапальну дію на хондроцити та хрящі in vitro [11]. Нинішні висновки відповідають цьому поняттю, оскільки частка загальної кількості MUFA була зменшена після ACLT, хоча тенденція до зменшення в 18: 1n-9, найпоширеніша окрема MUFA, не досягла значущості. Раніше 18: 1n-9 було визначено як важливий метаболіт для розрізнення ОА на ранніх та пізніх стадіях із збільшенням рівня синовіальної рідини під час прогресування захворювання [18]. Що стосується SFA, було задокументовано 16: 0, що інгібує руйнування хряща in vitro [11], але в цьому дослідженні не виявлено жодних ефектів ACLT на пропорції основних SFA.
Прогресування ОА у кролячої моделі ACLT відбувається швидко [8]. Ранні стадії вторинної ОА можуть розвиватися протягом тижнів, і, отже, обрана модель слугувала для досягнення цілей цього дослідження. У дрібних видів, таких як щури та миші, поверхні колінних суглобів занадто малі, щоб проводити експерименти з деформації клітин, проведені на цих тваринах. Наш вибір кроликів дозволяє порівняти попередні дослідження з тим самим хірургічним протоколом. У цьому дослідженні представлена нова інформація про роль ІФП у запаленні, яка має значення у прогресуванні ОА [4]. Вивчення нормального та аномального навантаження на колінний суглоб, підколінно-стегновий та гомілково-стегновий суглоби неможливе в культурах клітин та експлантатах. Коліно кролика відрізняється анатомією та розмірами внутрішньосуглобових структур, а також діапазоном рухів від коліна людини [42]. Ці відмінності слід враховувати при перекладі нинішніх результатів у контекст раннього ОА у людей. Тим не менше, основні кісткові, зв’язочні та м’язові структури подібні [42, 43], а розвиток ОА, хоча і набагато швидший у кроликів, ніж у людей, включає подібний набір патологічних подій [8]. Отже, описані тут феномени ФА можуть мати значення у розвитку ОА людини.
Висновки
IFP мав більш прозапальний ліпідний профіль у кроликів ACLT порівняно з контролем вже через 2 тижні після ACLT. Змінений баланс PU-n-3/n-6 PUFA свідчить про участь IFP у запальних процесах ОА в коліні. Крім того, розбіжність контралатерального коліна з профілем контролю контрольного коліна вказує на те, що воно саме по собі є цікавою метою дослідження. Незважаючи на те, що підпис ФА контралатерального коліна в більшості аспектів залишався подібним до підпису неоперованого контрольного суглоба, його використання як незахищеного контролю в межах тварини для вивчення профілів ФА ІФП не можна рекомендувати без обережності. Індуковане ACLT зниження співвідношення n-3/n-6 PUFA IFP відповідає запаленню та деградації хряща на початку ОА. Це може бути новим фактором, що сприяє, а отже, можливою терапевтичною мішенню при вивченні та лікуванні патогенезу захворювання.
- Оцінка необхідної потреби в жирній кислоті в піщанках за співвідношенням поліненасичених жирних кислот
- 40-30-30 Баланс принципу харчування
- Блог - Сторінка 2 з 6 - Харчування з правильним балансом
- Кислотний рефлюкс у немовлят, які найкращі формули
- Кислотний рефлюкс проти печії проти ГЕРХ У чому різниця Евенс