Точність автоматичного підрахунку вуглеводів, білків, жирів і калорій на основі голосових описів страв у людей з діабетом 1 типу
Петро Ладижинський
1 Інститут біокібернетики та біомедичної інженерії Налеча Польської академії наук, вул. Тройдена, 4, 02-109, Варшава, Польща; [email protected]
Януш Кшимен
2 Кафедра діабетології та внутрішніх хвороб Варшавського медичного університету, вул. Банача, 1А, 02-097, Варшава, Польща; [email protected] (J.K.); [email protected] (M.R.); lp.ude.muw@baidnilk (B.B.)
Петро Фолтинський
1 Інститут біокібернетики та біомедичної інженерії Налеча Польської академії наук, вул. Тройдена, 4, 02-109, Варшава, Польща; [email protected]
Моніка Рачута
2 Кафедра діабетології та внутрішніх хвороб Варшавського медичного університету, вул. Банача, 1А, 02-097, Варшава, Польща; [email protected] (J.K.); [email protected] (M.R.); lp.ude.muw@baidnilk (B.B.)
Барбара Бональська
2 Кафедра діабетології та внутрішніх хвороб Варшавського медичного університету, вул. Банача, 1А, 02-097, Варшава, Польща; [email protected] (J.K.); [email protected] (M.R.); lp.ude.muw@baidnilk (B.B.)
Пов’язані дані
Анотація
1. Вступ
Цукровий діабет є одним із хронічних захворювань, що вимагає великої уваги як пацієнта, так і медичної команди. Незалежно від типу діабету, пацієнти потребують повної інформації про хворобу через постійну освіту та пропаганду поведінки, спрямованої на охорону здоров’я, а також регулярний контроль рівня глюкози, індивідуальні плани лікування та ранню діагностику для запобігання загрозам здоров’ю, пов’язаним із ускладненнями діабету. Телемедицина пропонує ряд інструментів, які можуть бути корисними у виборі правильного плану лікування, підтримуючи дії щодо зміни способу життя пацієнта, посилюючи мотивацію щодо діяльності, пов’язаної зі здоров’ям, полегшуючи здатність пацієнта самостійно контролювати та контролювати свій стан та досягнення запланованого терапевтична мета.
Автоматичні або напівавтоматичні системи аналізу зображень продуктів харчування для оцінки дієти постійно розробляються. Вони досягають точності розпізнавання нижче 90% при тестуванні на базах даних, що складаються з декількох сотень зображень страв/страв [15]. В останні роки були розроблені перетворювачі зображень, які роблять серійні фотографії, документуючи послідовні етапи прийому їжі та дозволяючи оцінити кількість залишків з'їденої їжі [16]. Деякі з цих пристроїв для реєстрації життя, такі як камера Microsoft SenseCam, разом із даними, отриманими із звичайного щоденника їжі, дозволяють підвищити точність розрахунків споживання калорій [17]. Також повідомлялося про альтернативні підходи, які базуються на голосовому описі їжі [18,19] або моніторингу діяльності, пов’язаної із споживанням їжі, наприклад, жування або ковтання [20,21].
Усі суб'єкти дали свою поінформовану згоду на включення до участі у дослідженні. Дослідження було проведено відповідно до Гельсінської декларації, а протокол затверджено Комітетом з етики Варшавського медичного університету (KB/16/2014).
Для кожного учасника була зібрана уніфікована історія хвороби щодо дієти та харчових звичок, фізичної активності, інсулінотерапії (з особливим акцентом на болюсах інсуліну та базальної інфузії), кількості щоденних аналізів глюкози в крові, частоті та тяжкості гіпоглікемічних епізодів, та інформація про інші діагностовані захворювання, використовувану медитацію, звички куріння та зловживання алкоголем та наркотиками. Лікар проаналізував ці дані, щоб виявити фактори, які можуть вплинути на глікемічний контроль учасників дослідження.
2.2. Дизайн голосової системи
Система складалася з керованого Android смартфона з клієнтським додатком, що бездротово спілкувався із серверами для виконання наступних завдань: (1) автоматичне розпізнавання мови (ASR) та перетворення голосового опису їжі в текст; (2) аналіз текстового опису для визначення складу страви; (3) розрахунок дози інсуліну, що компенсує їжу, за алгоритмом, беручи до уваги або лише вміст СНО, або вміст СНО, білка та жиру в їжі. Детальний опис системи можна знайти деінде [29]. Примітно, що база даних системи містить характеристики 900 унікальних харчових продуктів та 5000 термінів, що сприяє ефективному перетворенню мови в текст, включаючи продукти, які були в меню лікарні. Однак ні кількість калорій, кількість СНО, білка та жиру, що характеризують кожен продукт, ні будь-які інші дані, що зберігаються в базі даних системи, не були адаптовані до характеристик лікарняного меню.
2.3. Використання голосової системи та вбудований болюсний калькулятор
Кожен учасник дослідження використовував систему наступним чином. Перед початком прийому їжі учасник словесно описав його склад, вказавши назву та розмір (або в одиницях, таких як грами, унції або літри, або в звичайних одиницях виміру, таких як ложки, чашки або порції) кожного харчового продукту, присутнього в їжа. Опис було передано на сервер, і після перетворення мови в текст кожен харчовий продукт був ідентифікований та відображений на екрані смартфона для перевірки учасником. Якщо ідентифікація не вдалася, попереджувальне повідомлення свідчило про те, що розпізнавання не вдалося через збій ASR або відсутність необхідної інформації в описі їжі, наприклад, коли пацієнт вказав харчовий продукт, якого немає в базі даних система. У разі відмови ASR пацієнт повторював опис харчового продукту, який не був належним чином ідентифікований. Для кожного визнаного продукту система обчислювала вміст калорій та вміст СНО, білка та жиру в грамах.
Після активації болюсний калькулятор підсумовував загальну калорійність, одиниці обміну вуглеводів (КО) та одиниці обміну білка та жиру (ПФУ) у цілому під час їжі, нарешті, дозу інсуліну, необхідну для компенсації їжі. PFU розраховували за наступним рівнянням:
Якщо ПФУ перевищує 1,0, рекомендується двохвильовий болюс, що складається з простого болюсу та квадратно-хвильового болюсу тривалістю від 4 до 8 год залежно від величини ПФУ. Загальну дозу прандіального інсуліну визначали, виходячи з наступного рівняння [30]:
Перша частина суми у рівнянні (2) позначає кількість інсуліну, що вводиться в простому болюсному введенні, а друга частина позначає інсулін, що вводиться в інфузії квадратної хвилі змінної тривалості. Якщо PFU менше 1,0, то система знижує його до нуля і, отже, рекомендує дозу інсуліну у вигляді простого болюсу [30].
2.4. Вплив методу підрахунку макроелементів на контроль глікемії
Щоб оцінити, чи можна використовувати автоматичну оцінку вмісту їжі на основі голосового опису їжі для контролю глікемії, дослідну групу було випадковим чином розділено на дві підгрупи. У першому, що складався з 14 суб’єктів, віком 23,5 ± 3,8 року з вмістом HbA1c, рівним 8,6 ± 1,8% (70 ± 20 ммоль/моль), болюс інсуліну визначався лікарем на основі даних контрольного вмісту їжі. У другому, у якому брали участь особи у віці 23,7 ± 5,4 року з вмістом HbA1c, рівним 8,5 ± 1,3% (69 ± 14 ммоль/моль), лікар мав доступ лише до даних, наданих системою при визначенні дозування інсуліну. Кожного учасника дослідження контролювали за допомогою системи безперервного контролю глюкози.
Наступні параметри порівнювали між підгрупами: середня концентрація глюкози в плазмі (PG), відсоток часу, коли концентрація глюкози була нормоглікемічною, тобто вище 3,9 ммоль/л (70 мг/дл) і нижче 10,0 ммоль/л ( 180 мг/дл) (PNPG), середнє максимальне збільшення ПГ після основних прийомів їжі та кількість та тривалість епізодів гіпоглікемії (тобто концентрація глюкози, що дорівнює або менша ніж 3,9 ммоль/л або 70 мг/дл).
2.5. Статистичний аналіз
Таблиця 1
Вміст калорій, оцінений дієтологом та системою VoiceDiab.
| Сніданок | 110 | 388 ± 85 166–602 | 381 ± 84 159–586 | 1 SD, стандартне відхилення. |
Середній вміст калорій в обох закусках, розрахований системою, не відрізнявся від показників, розрахованих дієтологом. Що стосується основних прийомів їжі, відмінності були статистично значущими. Загалом, система, як правило, недооцінювала кількість калорій, але середні відмінності були відносно невеликими і дорівнювали -7,2 ± 24,4 ккал (-1,7 ± 6,2%), -55,6 ± 54,8 ккал (-10,8 ± 10,4%) та -6,5 ± 26,0 ккал (-1,2 ± 5,4%) на сніданок, обід та вечерю відповідно.
У випадку кожного прийому їжі, крім обіду, система оцінювала значення МО, які були вищими, ніж ті, що розраховував дієтолог (табл. 2). Середні відмінності дорівнювали 0,3 ± 0,3 CU (8,8 ± 6,4%), 0,0 ± 0,6 CU (0,6 ± 12,4%) та 0,3 ± 0,2 CU (9,2 ± 5,9%) для основних основних прийомів їжі, починаючи зі сніданку. Загалом, для трьох основних прийомів їжі різниця між вмістом СНО, оціненим системою та дієтологом, була нижчою або дорівнює ± 1 МО (тобто ± 10 г СНО) у 96,3% випадків.
Таблиця 2
Одиниця обміну вуглеводів (КО) та одиниця білково-жирового обміну (ПФУ), підрахована дієтологом та системою VoiceDiab.
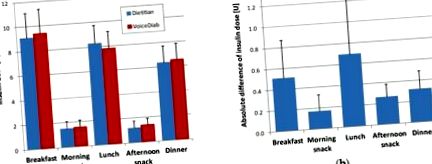
| Сніданок | 110 | 3,8 ± 0,8 2,2–6,0 | 4,1 ± 0,9 2,4–6,5 | На рис. 1а показано порівняння між болюсами інсуліну, розрахованими на основі складу їжі, наданого дієтологом, у порівнянні із системою, тоді як на малюнку 1 b показано абсолютні відмінності між цими дозами інсуліну. |
(a) Порівняння доз інсуліну та (b) абсолютні різниці доз інсуліну, розрахованих на основі вуглеводів (СНО), вмісту білка та жиру, наданих дієтологом та системою VoiceDiab.
У випадку з усіма прийомами їжі, крім ранкових перекусів, відмінності між болюсом інсуліну були статистично значущими (p Рисунок 2 a показує, для кожного прийому їжі та для всіх прийомів їжі разом, відсоток доз індійського прийому їжі, розрахований на основі оцінок їжі зроблені системою, які дорівнювали своїм опорним значенням, ті, що знаходились в діапазоні 0,0–0,5 U, 0,5–1,0 U, 1,0–2,0 U, і ті, що відрізнялися більш ніж на 2 U від еталонних значень. дози інсуліну (78,7%) відрізнялися на ± 0,5 U щонайбільше від еталонних значень і лише 1,3% виходили за межі ± 2 U. Коли ми використовували значення CU для розрахунку простих болюсів інсуліну (Рисунок 2 b), нехтуючи вміст білка та жиру в їжі, результати були подібними, тобто 81,7% болюсів відрізнялися від своїх референтних значень на 0,5 Од або менше, і лише 1,1% відрізнялися більш ніж на 2 ОД (з них 0,9% стосувалися доз інсуліну, компенсуючих сніданок ).
Середні відносні абсолютні різниці доз інсуліну, розраховані згідно з рівнянням (2), на основі оцінок одиниць обміну вуглеводів (КО) та одиниць обміну білка та жиру (ПФУ), наданих дієтологом та системою VoiceDiab для (a) двохвильові болюси; (b) прості болюси. Прийнято вважати, що співвідношення інсуліну до вуглеводів (ICR) становить 1,5 од/од для сніданку та 1,0 од/од для всіх інших страв.
3.3. Вплив методу підрахунку макроелементів на контроль глікемії
Середні PG і PNPG були однаковими для обох підгруп, тобто 7,3 ± 0,8 ммоль/л (131 ± 15 мг/дл) проти 7,5 ± 0,9 ммоль/л (135 ± 16 мг/дл) і 76 ± 7% ( p = 0,42) проти 75 ± 7% (p = 0,79) відповідно. Максимальний приріст PG дорівнював 4,3 ± 1,4 ммоль/л (77 ± 25 мг/дл) проти 4,7 ± 1,8 ммоль/л (85 ± 33 мг/дл) (р = 0,37) після сніданку, 3,7 ± 1,7 ммоль/Л (67 ± 30 мг/дл) проти 4,0 ± 1,7 ммоль/л (72 ± 30 мг/дл) (р = 0,55) після обіду і 3,9 ± 1,3 ммоль/л (71 ± 24 мг/дл) проти 4,3 ± 0,9 ммоль/л (77 ± 17 мг/дл) (р = 0,11) після обіду відповідно у першій та другій підгрупах. У першій підгрупі епізоди гіпоглікемії виникали 2,1 ± 0,8 рази на день, тоді як у другій підгрупі вони мали місце 2,0 ± 1,3 на день (p = 0,77). Добова тривалість гіпоглікемічних епізодів дорівнювала 120 ± 70 хв у першій підгрупі та 95 ± 74 хв у другій підгрупі (p = 0,35).
4. Обговорення та висновки
Проаналізувавши та узагальнивши вплив різниці в розрахунках CU та PFU на отримані дози інсуліну, оцінені відповідно до алгоритму, реалізованого в системі VoiceDiab, ми продемонстрували, що у понад 91% прийомів їжі абсолютна різниця в дозах інсуліну була меншою ніж 1 U Найбільші розбіжності були зафіксовані при розрахунку дообідніх доз інсуліну, де 26% відмінностей були більшими за 1 ОД.
Підводячи підсумок, люди з діабетом 1 типу, незважаючи на освіту, стикаються з деякими труднощами у регулюванні дозування інсуліну на основі власних оцінок вмісту СНО в їжі. Ці труднощі можуть бути ще більш вираженими, коли складний болюсний інсулін визначений для компенсації не тільки СНО, але також вмісту білка та жиру. Розроблена система, яка використовує інтуїтивно зрозумілий користувальницький інтерфейс, проста у використанні та швидко надає інформацію про склад їжі, яка може бути використана для автоматичного розрахунку дози інсуліну. Отримані результати та літературні дані вказують на те, що точність розрахунків CU та PFU, розрахованих системою, є достатньою для розрахунку доз інсуліну або автоматично, використовуючи алгоритм, реалізований в системі VoiceDiab, або вручну, використовуючи алгоритм, заснований на знаннях та досвіді терапевт; також було доведено, що ці дози близькі до тих, що розраховуються на основі референтних значень КО та ПФУ, встановлених дієтологом.
Подяка
Це дослідження, включаючи витрати на публікацію у відкритому доступі, профінансував Національний центр досліджень та розробок (грант № PBS1/B9/13/2012).
- Технологія підрахунку калорій та відстеження фітнесу Асоціації із симптоматикою розладів харчової поведінки
- Загадка про калорії розбиває світ “підрахунку калорій”; ПА їсть
- Підрахунок калорій та афера калорій 2000 року Кріс М Біл
- Додаток для підрахунку калорій використовує маячки Bluetooth у холодильниках, щоб допомогти користувачам схуднути; NFCW
- Підрахунок калорій 101 Не рахуйте калорій!