CD8 + Т-клітини індукують кахексію під час хронічної вірусної інфекції
Предмети
Анотація
Кахексія є основною причиною захворюваності та смертності при різних видах раку, хронічному запаленні та інфекціях. Розуміння механізмів, що обумовлюють кахексію, залишається обмеженим, особливо щодо асоційованої з інфекцією кахексії (IAC). У цій роботі ми описуємо модель оборотної кахексії у мишей з хронічною вірусною інфекцією та визначаємо важливу роль CD8 + Т-клітин в IAC. Цитокіни, пов’язані з асоційованою з раком кахексією, не сприяли ВМК. Натомість специфічні для вірусу CD8 + Т-клітини спричиняли морфологічні та молекулярні зміни в жировій тканині, що призвело до виснаження запасів ліпідів. Ці зміни відбулися в момент часу, що передував піку відповіді CD8 + Т-клітин і вимагав внутрішньої сигналізації інтерферону типу I та антиген-специфічного грунтування. Наші результати пов'язують системні противірусні імунні відповіді з ремоделюванням жирової тканини та виявляють недооцінену роль CD8 + Т-клітин в IAC.
Параметри доступу
Підпишіться на журнал
Отримайте повний доступ до журналу протягом 1 року
лише 4,60 € за випуск
Усі ціни вказані у нетто-цінах.
ПДВ буде додано пізніше під час оплати.
Оренда або купівля статті
Отримайте обмежений за часом або повний доступ до статей на ReadCube.
Усі ціни вказані у нетто-цінах.
Наявність даних
Номер доступу для вихідних даних RNA-seq - GSE118819.
Список літератури
Фон Гелінг, С. та Анкер, С. Д. Лікування кахексії: огляд останніх подій. Міжнародний Дж. Кардіол. 184, 726–742 (2014).
Baracos, V.E., Martin, L., Korc, M., Guttridge, D. C. & Fearon, K. C. H. Кахексія, пов'язана з раком. Нат. Преподобний Діс. Грунтовки 4, 1–18 (2018).
Ферон, К. та співавт. Визначення та класифікація кахексії раку: міжнародний консенсус. Ланцет Онкол. 12, 489–495 (2011).
Котлер, Д. Виклики діагностиці втрати, пов’язаної з ВІЛ. Дж. Аквір. Імунодефіцит. Синдр. 37, S280 – S283 (2004).
Тісдейл, М. Дж. Кахексія у онкологічних хворих. Нат. Преподобний Рак 2, 862–871 (2002).
Порпорато, П. Е. Розуміння кахексії як синдрому метаболізму раку. Онкогенез 5, 200 (2016).
Морлі, Дж. Е., Томас, Д. Р. і Вілсон, М.-М. Г. Кахексія: патофізіологія та клінічне значення. Am. J. Clin. Nutr. 83, 735–743 (2006).
Fearon, K. C. H., Glass, D. J. & Guttridge, D. C. Кахексія раку: медіатори, сигнальні та метаболічні шляхи. Cell Metab. 16, 153–166 (2012).
Vaitkus, J. A. & Celi, F. S. Роль жирової тканини в асоційованій з раком кахексії. Досвід. Біол. Мед. 242, 473–481 (2017).
Петруццеллі, М. та Вагнер, Е. Ф. Механізми метаболічної дисфункції при раковій асоційованій кахексії. Genes Dev. 30, 489–501 (2016).
Flint, T. R., Fearon, D. T. & Janowitz, T. Підключення метаболічної та імунної реакцій на рак. Тенденції Мол. Мед. 23, 451–464 (2017).
Bergthaler, A. та співавт. Реплікативна здатність вірусу є основною детермінантою стійкості та імуносупресії вірусу лімфоцитарного хоріоменінгіту. Proc. Natl Акад. Наук. США 107, 21641–21646 (2010).
Stamm, A., Valentine, L., Potts, R. & Premenko-Lanier, M. Проміжна доза клону LCMV 13 викликає тривалу захворюваність, яку підтримують CD4 + Т-клітини. Вірусологія 425, 122–132 (2012).
Zechner, R. та співавт. ТИЛОВІ СИГНАЛИ - ліпази та ліполіз в ліпідному обміні та передачі сигналів. Cell Metab. 15, 279–291 (2012).
Цолі, М. та співавт. Виснаження білої жирової тканини при синдромі кахексії раку пов'язане із запальною сигналізацією та порушенням циркадної регуляції. PLOS ONE 9, e92966 (2014).
Дас, С. К. та ін. Жирова тригліцерид-ліпаза сприяє кахексії, пов'язаній з раком. Наука 333, 233–238 (2011).
Ruud, J. & Brüning, J. C. Метаболізм: світло на зв'язок лептину з ліполізом. Природа 527, 43–44 (2015).
Baatar, D., Patel, K. & Taub, D. D. Вплив греліну на запалення та імунну систему. Мол. Клітинний ендокринол. 340, 44–58 (2011).
Kandarian, S. C. та співавт. Інгібуючий фактор лейкозу, що походить від пухлини, є головним фактором кахексії та захворюваності на рак у мишей, що несуть пухлину С26. J. Кахексія Саркопенія М'язи 9, 1–12 (2018).
Patel, H. J. & Patel, B. M. TNF-α та кахексія раку: молекулярні уявлення та клінічні наслідки. Life Sci. 170, 56–63 (2016).
Бхаттачар'я, А. та ін. Супероксиддисмутаза 1 захищає гепатоцити від окисного пошкодження, спричиненого інтерфероном типу I. Імунітет 43, 974–986 (2015).
Curtsinger, J.M., Valenzuela, J.O., Agarwal, P., Lins, D. & Mescher, M.F. Передовий край: тип I IFNS забезпечує третій сигнал для Т-клітин CD8 для стимулювання розширення та диференціації клонів. J. Імунол. 174, 4465–4469 (2005).
Kolumam, G. A., Thomas, S., Thompson, L. J., Sprent, J. & Murali-Krishna, K. Інтерферони типу I діють безпосередньо на Т-клітини CD8, щоб забезпечити клональне розширення та формування пам'яті у відповідь на вірусну інфекцію. J. Exp. Мед. 202, 637–650 (2005).
Xu, C. та співавт. Прямий вплив глюкокортикоїдів на ліполіз в адипоцитах. Мол. Ендокринол. 23, 1161–1170 (2009).
Піншевер, Д. Д. та ін. Імуносупресія FTY720 погіршує периферійне самонаведення ефекторних Т-клітин, не впливаючи на індукцію, розширення та пам'ять. J. Імунол. 164, 5761–5770 (2000).
Петруццеллі, М. та співавт. Перехід від білого до коричневого жиру збільшує витрати енергії при кахексії, пов’язаній з раком. Cell Metab. 20, 433–447 (2014).
Кір, С. та ін. Рецептор PTH/PTHrP опосередковує кахексію на моделях ниркової недостатності та раку. Cell Metab. 23, 315–323 (2016).
Цао, Ю. Ангіогенез та судинні функції в модуляції ожиріння, жирового обміну та чутливості до інсуліну. Cell Metab. 18, 478–489 (2013).
Vegiopoulos, A., Rohm, M. & Herzig, S. Жирова тканина: між крайнощами. EMBO J. 36, 1999–2017 (2017).
Кватріні, Л. та співавт. Ендогенні глюкокортикоїди контролюють стійкість господаря до вірусної інфекції за допомогою тканиноспецифічної регуляції експресії PD-1 на NK-клітинах. Нат. Імунол. 19, 954–962 (2018).
Міллер, А. Х. та співавт. Вплив вірусної інфекції на секрецію кортикостерону та зв'язування глюкокортикоїдних рецепторів в імунних тканинах. Психонейроендокринологія 22, 455–474 (1997).
Jamieson, A. M., Yu, S., Annicelli, C. H. & Medzhitov, R. Індуковані вірусом грипу глюкокортикоїди компрометують вроджений захист господаря від вторинної бактеріальної інфекції. Клітинний мікроб 7, 103–114 (2010).
Doherty, P. C., Hou, S. & Southern, P. J. Вірус лімфоцитарного хоріоменінгіту викликає хронічну хворобу марнотравлення у мишей, які не мають основного комплексу гістосумісності глікопротеїдів класу I. J. Нейроімунол. 46, 11–17 (1993).
Hildeman, D. & Muller, D. Імунопатологічна втрата ваги при внутрішньочерепній LCMV-інфекції, ініційованій анорексигенними ефектами IL-1β. Вірусний Імунол. 13, 273–285 (2000).
Kamperschroer, C. & Quinn, D. G. Роль прозапальних цитокінів у виснаженні хвороби під час зараження лімфоцитарним хоріоменінгітом. J. Імунол. 169, 340–349 (2002).
Ванг, А. та ін. Протилежні наслідки метаболізму натще на толерантність тканин при бактеріальному та вірусному запаленні. Клітинка 166, 1512–1525.e12 (2016).
П'єтрокола, Ф. та співавт. Міметики з обмеженням калорій посилюють протипухлинний імунологічний нагляд. Ракова клітина 30, 147–160 (2016).
Ненціоні, А., Каффа, І., Кортелліно, С. та Лонго, В. Д. Голодування та рак: молекулярні механізми та клінічне застосування. Нат. Преподобний Рак 18, 707–719 (2018).
Лонго, В. Д. та Маттсон, М. П. Голодування: молекулярні механізми та клінічне застосування. Cell Metab. 19, 181–192 (2014).
Rouse, B. T. & Sehrawat, S. Імунітет та імунопатологія до вірусів: що визначає результат? Нат. Преподобний Імунол. 10, 514–526 (2010).
Virgin, H. W., Wherry, E. J. & Ahmed, R. Перевизначення хронічної вірусної інфекції. Клітинка 138, 30–50 (2009).
Салліван, Б. М., Тейжаро, Дж. Р., Де Ла Торре, Дж. С. і Олдстоун, М. Б. А. Ранні взаємодії вірус-господар диктують перебіг стійкої інфекції. PLoS Pathog. 11, 1004588 (2015).
Данай, Л. В. та ін. Змінена екзокринна функція може спричинити втрату жиру при ранньому раку підшлункової залози. Природа 558, 600–604 (2018).
Wherry, E. J. & Kurachi, M. Молекулярне та клітинне розуміння виснаження Т-клітин. Нат. Преподобний Імунол. 15, 486–499 (2015).
Перрі, Р. Дж. Та ін. Печінковий ацетил-КоА пов’язує запалення жирової тканини з печінковою резистентністю до інсуліну та діабетом 2 типу. Клітинка 160, 745–758 (2015).
Нората, Г. Д. та ін. Клітинна та молекулярна основа трансляційного імунометаболізму. Імунітет 43, P421 – P434 (2015).
Бак, М. Д., Соуелл, Р. Т., Ках, С. М. і Пірс, Е. Л. Інструкція про метаболізм імунітету. Клітинка 169, 570–586 (2017).
Хуанг, С. та ін. Імунна відповідь у мишей, у яких відсутній рецептор інтерферону-гамма. Наука 259, 1742–1745 (1993).
Паспаракіс, М., Алексопулу, Л., Епіскопу, В. та Колліас, Г. Імунна та запальна реакція у мишей з дефіцитом TNF альфа: критична вимога до TNF альфа у формуванні первинних фолікулів В-клітин, фолікулярних дендритних клітинних мереж та зародкові центри, а також у процесі дозрівання гуморальної імунної відповіді. J. Exp. Мед. 184, 1397–1411 (1996).
Peschon, J. J. et al. Миші з дефіцитом рецептора TNF виявляють різні ролі для p55 та p75 у кількох моделях запалення. J. Імунол. 160, 943–952 (1998).
Мюллер, У. та ін. Функціональна роль інтерферонів типу I та II у противірусному захисті. Наука 264, 1918–1921 (1994).
Prigge, J. R. et al. ІФН типу I діють на гемопоетичних родоначальників для захисту та підтримки кровотворення під час пневмоцистної легеневої інфекції у мишей. J. Імунол. 195, 5347–5357 (2015).
Сітнік, М. Т. та співавт. Гідроліз триацилгліцерину скелетних м’язів не впливає на метаболічні ускладнення ожиріння. Діабет 62, 3350–3361 (2013).
Eguchi, J. та співавт. Транскрипційний контроль обробки жирових ліпідів за допомогою IRF4. Cell Metab. 13, 249–259 (2011).
Sawada, S., Scarborough, J. D., Killeen, N. & Littman, D. R. Спеціальний транскрипційний глушник, що регулює родовід, регулює експресію гена CD4 під час розвитку Т-лімфоцитів. Клітинка 77, 917–929 (1994).
Coleman, D. L. & Hummel, K. Вплив генетичного фону на експресію гена ожиріння (Ob) у миші. Діабетологія 9, 287–293 (1973).
Комуро, К., Ітакура, К., Бойзе, Е. А. та Джон, М. Ly-5: нова антигенна система Т-лімфоцитів. Імуногенетика 1, 452–456 (1974).
Fung-Leung, W. та співавт. CD8 необхідний для розвитку цитотоксичних Т, але не хелперних Т-клітин. Клітинка 65, 443–449 (1991).
Шинкай, Ю. та ін. Мишам з дефіцитом RAG-2 не вистачає зрілих лімфоцитів через неможливість ініціювати перегрупування V (D) J. Клітинка 68, 855–867 (1992).
Хогкіст, К. А. та ін. Пептиди-антагоністи рецепторів Т-клітин індукують позитивний відбір. Клітинка 76, 17–27 (1994).
Mombaerts, P. et al. RAG-l-дефіцитні миші не мають зрілих В і Т-лімфоцитів. Клітинка 68, 869–877 (1992).
Kägi, D. та ін. Цитотоксичність, опосередкована Т-клітинами та клітинами-природними кілерами, сильно погіршується у мишей із дефіцитом перфорину. Природа 369, 31–37 (1994).
Сміт, Г. К. Лінійні моделі та емпіричні методи Баєса для оцінки диференціальної експресії в експериментах з мікрочипами. Стат. Заяв. Genet. Мол. Біол. 3, 1–25 (2004).
Подяка
Ми вдячні С. Ніггемайеру, С. Юнгвірту та Дж. Ріде за тваринництво. Автори висловлюють подяку Л. Бакірі, В. Баракосу, Ю. Белкайду, Р. Меджитову, Г. Суперті-Фурга, Е. Вагнеру та Р. М. Цінкернагелю за цінні відгуки та обговорення. Цей проект отримав фінансування від Європейської дослідницької ради в рамках Сьомої рамкової програми Європейського Союзу та програми досліджень та інновацій "Горизонт 2020" (угода про надання гранту № 677006, "CMIL" до AB, № 340896 та "LipoCheX" до RZ) від німецької Дослідницька рада (грантові номери SFB974, KFO217, LA-2558/5-1 та Вища школа Юргена Манчо МОІ III до PAL), від Австрійського наукового фонду (грант No FWF P26766 для TS) та від Національного інституту охорони здоров’я США (грантові номери R01AI032972, U19AI100627 А.Адерему). A.L. та M.Smyth підтримуються стипендіями DOC Австрійської академії наук.
Інформація про автора
Ці автори внесли однаковий внесок: Мартіна Швайгер, Майкл Мошингер.
Приналежності
Дослідницький центр молекулярної медицини CeMM Австрійської академії наук, Відень, Австрія
Хатун Баазім, Майкл Мошингер, Олександра Попа, Ксенія Хаміна, Ліндсей Косак, Боян Вілагос, Марк Сміт, Олександр Лерхер та Андреас Бергталер
Інститут молекулярних біологічних наук, Університет Граца, Грац, Австрія
Мартіна Швайгер та Рудольф Цяхнер
Кафедра молекулярної медицини II, Університет Генріха Гейне, Дюссельдорф, Німеччина
Хайфен Сю і Філіп А. Ланг
Відділ ендокринології та метаболізму, кафедра медицини III, Віденський медичний університет, Відень, Австрія
Відділ хронічного запалення та раку, Німецький центр дослідження раку, Гейдельберг, Німеччина
Сучіра Галладж, Аднан Алі та Матіас Хайкенвальдер
Відділ біомедичної візуалізації та терапії зображеннями, керований зображеннями, Відділ гендерної та молекулярної візуалізації, доклінічна лабораторія візуалізації, Віденський медичний університет, Відень, Австрія
Йоахім Фріске та Томас Хелбіх
Кафедра патології та імунології, Женевський університет, Женева, Швейцарія
Центр глобальних досліджень інфекційних хвороб, Дитячий дослідницький інститут у Сіетлі, Сіетл, Вашингтон, США
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Внески
Х.Б. задумав проект, розробив та виконав експерименти, проаналізував дані та написав рукопис. М. Швайгер, Т.С., Б.В., А.Адерем та Р.З. сприяли розробці експерименту, спільним використанням реагентів та/або сприяли інтерпретації даних. М.М., Х.К., К.К., Л.К., М. Сміт, А.Л. та П.А.Л. розроблені, проведені та/або проаналізовані експерименти. А.П. проводив аналіз біоінформаційних даних. С.Г., А.Алі та М.Х. проводили вимірювання метаболічної клітини. J.F. та T.H.H. виконана МРТ. Д.М. забезпечували гістологічне та імуногістохімічне фарбування. А.Б. задумав проект, розробив експерименти, проаналізував дані, написав рукопис і керував проектом.
Відповідний автор
Декларації про етику
Конкуруючі інтереси
Автори декларують відсутність конкуруючих інтересів.
Додаткова інформація
Примітка видавця: Springer Nature залишається нейтральним щодо юрисдикційних вимог в опублікованих картах та інституційних приналежностей.
Інтегрована додаткова інформація
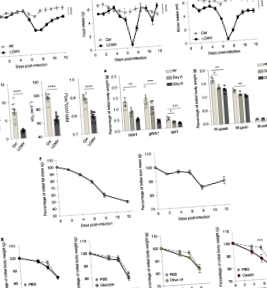
Додаткова Рис. 1 Характеристика патофізіологічних змін, викликаних ІАК.
Додаткова Рис. 3 Роль провокаційних прозапальних цитокінів та Т-клітин у опосередкуванні втрати ваги під час клонування 13 LCMV та грипозної інфекції.
6 Неопрацьовані зображення всіх вестерн-плям.
(ліворуч) необроблене зображення, отримане для зазначених антитіл. (праворуч) зображення злиття показують зображення хемолюмінесценції, що автоматично зливається із зображенням сходів, отримане за допомогою системи Bio-Rad ChemiDoc TM XRS +.
- Аналіз ініціації вірусної інфекції в умовах потоку із застосуванням до
- Історія прийому препаратів у ваговому списку Nature Medicine
- Гострий безрахувальний холецистит як рідкісний прояв хронічної мезентеріальної ішемії
- Настоянка календули 8 унцій Цілитель зцілення зцілює світ природою
- Анотація MP27 Вплив здорового способу життя на пожиттєвий ризик смертності від хронічних захворювань