Цукор sIRVed: Сортування Glut4 та його попутники
Кафедра біохімії Медичного факультету Бостонського університету, 72 E. Concord Street, Бостон, Массачусетс 02118, США
Кафедра біохімії Медичного факультету Бостонського університету, 72 E. Concord Street, Бостон, Массачусетс 02118, США
Медичний факультет, Медичний факультет Бостонського університету, вулиця Е. Конкорд, 72, Бостон, Массачусетс 02118, США
Кафедра біохімії, Медичний факультет Бостонського університету, 72 E. Concord Street, Бостон, Массачусетс 02118, США
Кафедра біохімії, Медичний факультет Бостонського університету, 72 E. Concord Street, Бостон, Массачусетс 02118, США
Медичний факультет, Медичний факультет Бостонського університету, вулиця Е. Конкорд, 72, Бостон, Массачусетс 02118, США
Анотація
Транслокація Glut4 до плазматичної мембрани жирових клітин та клітин скелетних м’язів опосередковується спеціалізованими міхурами, що реагують на інсулін (IRV), чий білковий склад складається в основному з транспортера глюкози ізоформа 4 (Glut4), амінопептидази, що реагує на інсулін (IRAP), сортилін, пов'язаний з ліпопротеїновим рецептором білок 1 (LRP1) та v-SNARE. Як ці білки можуть знаходити один одного в клітині і утворювати функціональні пухирці після ендоцитозу з плазматичної мембрани? Ми пропонуємо модель, згідно з якою білки компонента IRV інтерналізуються в сортувальні ендосоми і доставляються в донорські відділення IRV, рециркулюючі ендосоми та/або перекладМережа Гольджі (TGN) за допомогою целюгірин-позитивних транспортних пухирців. Цитоплазматичні хвости Glut4, IRAP, LRP1 та сортиліну відіграють важливу цільову роль у цьому процесі. Як тільки ці білки надходять у донорський відділ, вони взаємодіють між собою через свої просвітні домени. Це полегшує кластеризацію білків IRV в олігомерний комплекс, який потім можна розподілити від донорських мембран до IRV як єдине ціле за допомогою адаптерів, таких як локалізований за Гольджі, гамма-адаптин, що містить вухо, ARF-зв'язуючий (GGA).
Регулювання рівня глюкози в крові у ссавців досягається шляхом інсулінозалежної транслокації транспортера глюкози ізоформи 4 (Glut4) до плазматичної мембрани жирових клітин та клітин скелетних м’язів. Кілька рядків незалежних доказів, таких як трансгенні та нокаутовані моделі миші (розглянуті в 1) та дослідження ядерного магнітного резонансу людини в природних умовах (розглянуто в 2), демонструють, що Glut4-опосередковане поглинання глюкози являє собою обмежувальну швидкість кроку утилізації стимульованої інсуліном глюкози. Отже, нездатність нормальних доз інсуліну стимулювати транслокацію Glut4, тобто резистентність до інсуліну, може представляти собою основний дефект у розвитку цукрового діабету 2 типу. Отже, розшифровка механістичних етапів регуляції Glut4 буде вирішальною для нашого розуміння молекулярної природи інсулінорезистентності та цукрового діабету та для можливих способів лікування. Крім того, торгівля Glut4 представляє важливу парадигму для клітинних біологів у багатьох аспектах.
Резистентність до інсуліну в жировій тканині та тканинах скелетних м’язів може бути спричинена дефектною сигналізацією інсуліну, аберантною переробкою Glut4 або тим і іншим. Нещодавно більшість дослідницьких зусиль, спрямованих на розуміння резистентності до інсуліну, були зосереджені на потенційних дефектах сигнального шляху до інсуліну, що складається з рецептора інсуліну, його субстратів (IRS), фосфатидилінозитол-3-кінази (PI-3-кінази), PI-3 Кіназа, залежна від кінази (PDK) та серин/треонінкіназа, Akt 4, 5. Зокрема, зустрічне регуляторне фосфорилювання IRS1 на залишках ser/thr, що призводить до притуплення сигналізації інсуліну, спостерігалось у численних експериментальних контекстах, загальний ефект призвів до більшої плутанини, ніж освітлення механізмів інсулінорезистентності 6. Більше того, ці випадки фосфорилювання IRS вище за течією не обов'язково корелюють із зменшенням споживання глюкози, що можна продемонструвати в пробірці і у трансгенних тварин в природних умовах незалежно від інсуліну 7. Ці висновки вказують на клітинну біологію рециркуляції Glut4 як потенційного місця первинних аномалій, пов'язаних з діабетом, і підкреслюють необхідність опису багатьох аспектів трафіку Glut4, які залишаються невідомими.
Незважаючи на те, що були досягнуті значні успіхи у визначенні шляху передачі сигналу про інсулін вище, ці біохімічні події, близькі до мобілізації ІРВ та злиття з плазматичною мембраною, залишаються незрозумілими. Активація Akt є критичною для загальної торгівлі Glut4, і таким чином цілі/субстрати цього білка, такі як Rab GAP (активуючий GTPase білок), AS160/TBC1D4, стали важливими гравцями мобільності IRV (оглянуто в 8). Однак незрозуміло, на якому етапі торгівлі Glut4 бере участь AS160/TBC1D4, оскільки його нокдаун не повністю імітує інсулінозалежну транслокацію Glut4. Тому можливо, що AS160/TBC1D4 не тільки впливає на транслокацію попередньо сформованих IRV, але він також може брати участь у їх біогенезі. Нещодавно було розглянуто процес біогенезу 9 та диференційоване формування везикул 10 Glut4. Далі ми розглянемо цікаву проблему того, як клітина сортує ряд основних вантажних білків IRV з дуже різними біохімічними функціями та властивостями.
Маленькі попередньо сформовані везикули являють собою основну форму зберігання Glut4 у клітині
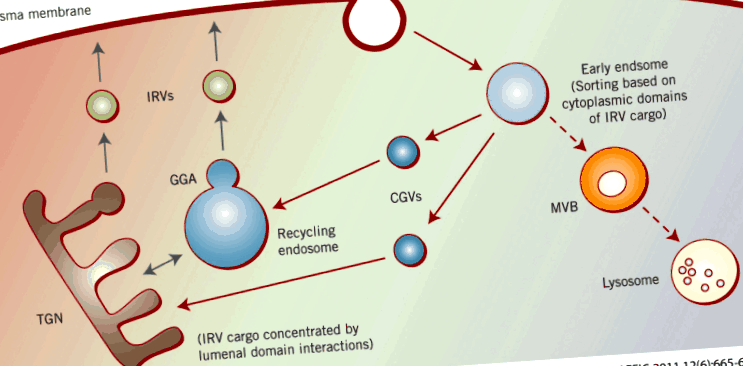
На шляху до і з поверхні клітини Glut4 проходить через кілька окремих внутрішньоклітинних компартментів (рис. 1). Сюди входять ранні ендосоми, проміжні транспортні везикули, ендосоми, що переробляються, та/або перекладМережа Гольджі (TGN) та міхури, що реагують на інсулін (IRV) (також звані GSV для везикул для зберігання транспортера глюкози), які, на думку багатьох дослідників, є метою регуляції інсуліну, що призводить до доставки Glut4 до плазматичної мембрани.
Сортування вмісту білка IRV. Починаючи з плазматичної мембрани, основні вантажні білки IRV зазнають ендоцитозу на основі їх різних мотивів інтерналізації (табл. 1). Вони транспортуються від ранніх ендосом до рециркулюючих ендосом та/або TGN через целюгіринові пухирці (зображені синім кольором), також на основі цих сортувальних мотивів. В останніх відділеннях вантаж IRV концентрується на основі взаємодії доменного просвіту та зародків IRV з використанням GGA (зображено чорним кольором).
Імуноелектронна мікроскопія показала, що фізична природа основних компонентів, що містять Glut4, у повністю диференційованих клітинах жирової та скелетної м’язів складається переважно з невеликих (діаметром 70–100 нм) бульбашок та коротких канальців 11; біохімічне фракціонування показує, що 60–75% від загальної кількості пулу Glut4 присутній у невеликих (приблизно 80–100 S) везикулах, які легко виявити центрифугуванням із градієнтом сахарози та іншими біохімічними методами 12. Решта транспортера присутня у великих швидко осідаючих внутрішньоклітинних мембранах, які, ймовірно, представляють рециркулюючі ендосоми та, можливо, структури TGN 11 .
У культивованих жирових клітинах більшість мембран, що містять Glut4, включаючи дрібні везикули, ендосоми, що переробляють та TGN, зосереджені в перинуклеарній області, що ускладнює аналіз природи `` шляху Glut4 '' за допомогою звичайної імунофлюоресценції. Зокрема, існують неповні та навіть суперечливі докази щодо того, чи здійснюється трафік Glut4 через переробку ендосом 13, TGN 14 або обох відсіків. Останні публікації демонструють, що «класичні» білки Гольджі, такі як p115 15 та Golgin ‐ 160 16, беруть участь у сортуванні та переміщенні Glut4. Це свідчить про те, що апарат Гольджі (включаючи TGN) може бути більш тісно залучений у «шлях Glut4», ніж раніше оцінювали. Ця ідея узгоджується з недавніми результатами, які показують, що втягнення Glut4 з ендосом у TGN може бути важливим кроком на шляху "Glut4" людських міоцитів 17, 18 .
Розмір пузирного пулу Glut4 зменшується за рахунок інсуліну приблизно. двократне супутнє з еквівалентним збільшенням вмісту Glut4 у плазматичній мембрані, що припускає, що міхури, що містять Glut4, зливаються з плазматичною мембраною. Регуляція інсуліну вмісту Glut4 в ендосомах та TGN систематично не вивчалась і в основному невідома. Наявні морфологічні дані свідчать про те, що інсулін не спричиняє великих змін у присутності Glut4 у великих „вакуолях” та „канальцях” 19. Однак це можна пояснити швидким поповненням ендосомного пулу Glut4 новим інтерналізованим транспортером 20. У будь-якому випадку невеликі мембранні бульбашки та короткі трубочки з коефіцієнтом седиментації приблизно Здається, 80–100S представляють основну форму зберігання Glut4 у базальних адипоцитах та міоцитах.
Процес біогенезу малих пухирців Glut4 з великих донорських мембран може бути відновлений в пробірці при інкубації донорських мембран з АТФ і цитозолем при 37 ° С 21, 22. Чи стимулює інсулін утворення маленьких пухирців Glut4, а також викликає транслокацію вже існуючих везикул? Деякі дані свідчать, що інсулін дійсно може позитивно впливати на утворення пухирців Glut4 20, 21, 23, 24. Однак у диференційованих адипоцитах цей ефект, швидше за все, не пояснює масове збільшення вмісту Glut4 у плазматичній мембрані у відповідь на стимуляцію інсуліном 21, що свідчить про те, що основним ефектом інсуліну є транслокація попередньо сформованих везикул.
Неоднорідність маленьких везикул Glut4
Невеликі пухирці Glut4 не є однорідними за структурою чи функціональною здатністю, а загальні препарати цих везикул представляють собою перекриваючу суміш принаймні двох везикулярних популяцій, яку можна частково вирішити градієнтним центрифугуванням. Одна популяція менших везикул відзначається наявністю білка, який називається целюгірином, тоді як інша популяція більших везикул не містить цього білка 25-27. Целюгірин має чотири трансмембранні спіралі з поки що невідомою фізіологічною функцією, і це повсюдно виражений гомолог синаптогірину, головного компонента синаптичних пухирців 28. Целюгірин присутній лише в популяції везикул Glut4, яка не рекрутується до плазматичної мембрани інсуліном і, таким чином, постійно зберігає свою внутрішньоклітинну локалізацію. Навпаки, негативні до целюгірину везикули Glut4 транслокуються до плазматичної мембрани з фактично 100% ефективністю 25-27. Оскільки позитивно-целюгіринові та негативно-целюгіринові пухирці діляться приблизно на рівні Glut4 25, 27, виснаження загального пухирчатого пулу транспортера інсуліном становить не більше 50% за відсутності інших збурень.
Існує припущення, що позитивні целюгіринові везикули представляють всюдисущий везикулярний відділ 29, який транспортує білки між ранніми та рециркулюючими ендосомами/TGN. Таких транспортних везикул досить багато в різних типах клітин 22, 30 і може вмістити значну кількість рециркулюючих білків. З іншого боку, негативні до целюгірину міхури, швидше за все, представляють спеціалізований відділ, що реагує на інсулін, IRV, який, як вважають, є мішенню сигналізації інсуліну 31. Таким чином, ми будемо використовувати термін «IRV», коли ми говоримо конкретно про везикулярний Glut4-вмісний відділ, який переміщується в плазматичну мембрану у відповідь на стимуляцію інсуліном. Загальний пухирчастий пул Glut4, що включає як чутливі до інсуліну, так і нечутливі везикули різної біологічної природи клітин, буде називатися „пухирцями Glut4“.
Основні вантажні білки везикул Glut4 та IRV
На додаток до LRP1, IRV вміщують невелику (приблизно 10% їх загального мікросомного пулу) частину рецепторів для трансферину (TfR) і маннози-6-фосфату (M6PR), а також безліч інших відомих білків, що переробляють мембрану 27, 35, які представляють незначні везикулярні компоненти, поведінка яких не була широко описана. Наявність TfR та M6PR у IRV може пояснити їх давно відому інсулінозалежну транслокацію до плазматичної мембрани в адипоцитах 36, а їх наявність у IRV пояснюється в розділі сортування. Нарешті, IRV можуть містити більше одного з функціонально надлишкових v-SNARE 37, про які вже деякий час відомо, що вони беруть участь у торгівлі Glut4 38 .
IRAP, ймовірно, є найпоширенішим компонентом IRV і, в основному, якщо не повністю локалізований з Glut4 26. Фізіологічна роль інсулінозалежної активності амінопептидази в жирі та м’язах залишається незрозумілою, але присутність IRAP у IRV може сприяти їх чутливості до інсуліну через зв'язування Rab GAP, TBC1D4 35, 39 та/або вона може функціонувати при сортуванні білків пухирців. Ці можливі ролі будуть розглянуті далі.
Сортилін є гомологом дріжджового вакуолярного рецептора сортування, Vps10p, і представляє мультилігандовий білковий рецептор дуже широкої специфічності в клітинах ссавців і виконує різні функції у сортуванні білків та передачі особливої уваги, крім м'язів та жиру, в нейрональних клітинах 40. У колишніх клітинах сортилін збагачується IRVs і відіграє важливу роль у біогенезі цього відділу, ймовірно, взаємодією білок-білок у його просвітному домені [див. Нижче та посилання 41-43]. Таким чином, його можна сприймати як рецептор для супутніх білків IRV, Glut4 та IRAP.
Цікавим, хоча і дещо телеологічним питанням, є те, чому клітина використовує цю функціонально гетерогенну суміш білків, щоб створити механізм транспортування глюкози, що реагує на інсулін? Одне припущення полягає в наступному. Просвітній домен сортиліну дуже гомологічний домену дріжджового сортувального рецептора Vps10p, який відповідає за внутрішньоклітинний рух амінопептидази Y, карбоксипептидаз Y та протеїнази A у Saccharomyces cerevisiae 44, 45. Таким чином, може не дивно, що IRAP, амінопептидаза, ко-локалізується з сортиліном в тих же везикулах у клітинах ссавців. Крім того, можливо, що в процесі еволюції Glut4 розвинув спорідненість до вже існуючого сортуючого рецептора, сортиліну, і таким чином захопив древній тип везикулярного носія, який використовувався для внутрішньоклітинного обігу комплексів Vps10p/пептидази у дріжджах. Однак інші гіпотези цілком можливі.
Переробка білків IRV у клітині
| IRAP | 71 ‐ ESSAKLLGM ‐ 79 ‐ Tm | 64 ‐ DEDEEDYE ‐ 71 ‐ Tm | |
| 47 ‐ EPRGSRLLVR ‐ 57 ‐ Tm | |||
| LRP1 | Tm ‐ 4470 ‐ NPTY‐4473 | Tm ‐ 4483 ‐ DVGGLLDA ‐ 4490 | |
| Tm ‐ 4504 ‐ NPVY‐4507 | |||
| Сортилін | Tm ‐ 820 ‐ DEDLLE ‐ 825 | Пальмітоїляція | |
| Насичення4 | 5‐FQQI ‐ 9 ‐ Tm | Tm ‐ 485 ‐ RTPSLLEQ ‐ 492 | Tm ‐ 498 ‐ TELEYL ‐ 505 |
| Tm ‐ 500 ‐ LxxLxPDExD ‐ 509 | |||
| Убіквітин |
- Вищевказані амінокислотні послідовності, можливо, крім останньої колонки, всі пов'язують білки-адаптери клатрину (AP), а саме AP ‐ 1‐3, GGA та ACAP1 46. Ці послідовності були залучені в ендоцитоз з клітинної поверхні, а також інші етапи бутонізації внутрішньоклітинних везикул, але вважається, що послідовність зв'язування GX DXXLL, унікальна для сортиліну, є виключною для TGN для сортування ендосом. Таким чином, ми пропонуємо, як зазначено в тексті та на малюнку 1, що формування IRV опосередковується GGA та сортиліном, останній у комплексі з рештою вантажу IRV.
Таким же чином, цитоплазматичний хвіст IRAP націлений на цей білок, головним чином, до мембран донорів IRV, але не до IRV 52. Тим не менше, цитоплазматичний хвіст IRAP 53, а також С-кінець Glut4 51 можуть надавати певний ступінь реагування на інсулін молекулам-репортерам, що, однак, менше, ніж чутливість до інсуліну дикого типу Glut4 та IRAP 51, 52, 54. Одне з пояснень цього явища полягає в тому, що як тільки білок потрапляє в донорне відділення (и) IRV, він може бути захоплений брунькуючими пухирцями, наприклад, масовою дією 10. Це стосується білків, таких як TfR, M6PR, синтаксини 6/16 та Vti1a. Ці білки демонструють значну ко-локалізацію з Glut4 на рівні світлової мікроскопії, але вони не сортуються активно в IRV і набувають меншої чутливості до інсуліну, ніж основні вантажні білки IRV. Однак більшість мембранних білків не утримуються в донорському відділенні IRV через відсутність інформації про націлювання в їх цитоплазматичних хвостах, і, природно, вони мають невеликі шанси потрапити в IRV.
Дослідження спрямованості на сортилін також показали, що білок-репортер, що складається з цитоплазматичного хвоста сортиліну та EGFP, не націлений на IRV і не реагує на інсулін 55. Навпаки, мічений просвітній домен Vps10p сортиліну демонструє часткову ко-локалізацію з Glut4 і, певною мірою, орієнтований на IRV в адипоцитах 3T3-L1. Цікаво, що внутрішньоклітинний обіг сортиліну вимагає пальмітоїлювання 56, хоча досі не зрозуміло, чи потрібно і в якому обсязі пальмітоїлювання для біогенезу IRV.
Взаємозв'язок IRV із подібними, реагуючими на стимул відділеннями в інших типах клітин
Існує мало сумнівів у тому, що в жирових клітинах і клітинах скелетних м’язів співіснують різні типи везикулярних носіїв. Однак висока чутливість до інсуліну є унікальною властивістю IRV, що відрізняє їх від інших внутрішньоклітинних везикул. Як уже згадувалося вище, пояснення чутливості IRV до інсуліну в кінцевому підсумку повинно зводитися до особливостей вмісту їх білка. Навіть у тому ймовірному випадку, що реакція на інсулін реагує на IRV через білок (и) периферичної мембрани, цей передбачуваний компонент (компоненти) все ще повинен якось розпізнати один або кілька основних компонентів IRV, таких як Glut4, IRAP, сортилін або LRP1. Майбутні експерименти повинні визначити білки IRV, які відповідають за їх реакцію на інсулін, і пов’язати ці везикули із сигнальним шляхом інсуліну.
Подяка
Цю роботу підтримали Національні інститути охорони здоров’я, DK30425 до PFP та DK52057 до KVK.
- Полуниця дика; Скраб для тіла із цукру із зеленого чаю; Інтернет-магазин "Сибірський оздоровчий"
- Чи допоможуть замінники цукру схуднути
- Дивіться Епізоди екстремального схуднення в Інтернеті 1 сезон (2011) Телегід
- Лоза; - січень 2011 р. Чіно взяв інтерв’ю у DeftonesWorld - Все про Deftones
- Документація про значення скипидарної олії MAK, 2017 - Хартвіг - Основні довідкові роботи - Wiley Online