Термодинаміка ідеального газу: специфічні нагрівання, ізотерми, адіабати
Вступ: ідеальна газова модель, тепло, робота та термодинаміка
Картину кінетичної теорії газу (викладену в попередній лекції) часто називають моделлю ідеального газу.В Він ігнорує взаємодію між молекулами та кінцевий розмір молекул. Насправді, це стає важливим лише тоді, коли газ дуже близький до температури, при якій він стає рідким, або під надзвичайно високим тиском. В цій лекції ми будемо аналізувати поведінку газів у діапазоні тиску та температур, що відповідає для обігріву двигунів, і в цьому діапазоні ідеальна газова модель є чудовим наближенням. В По суті, наша програма полягає в тому, щоб дізнатися, як гази поглинають тепло і перетворювати його на роботу, і навпаки. В Ця взаємодія теплової роботи називається термодинамікою.
Джуліус Роберт Майєр першим зрозумів, що існує еквівалентність між нагріванням та механічною роботою. Звивистий шлях, який привів його до цього висновку, описаний у попередній лекції, але, опинившись там, він зрозумів, що насправді чисельну еквівалентність - скільки Джоулів в одній калорії в сучасній термінології - можна легко зрозуміти з результатів деяких вимірювань питомого тепла газу французькими вченими. Ключовим було те, що вони вимірювали питомі нагрівання як при постійному обсязі і при постійному тиску.Майер зрозумів, що в останньому випадку нагрівання газу неодмінно збільшувало його об'єм, і тому газ дійсно працював над розширенням контейнера. Впевнившись, що механічна робота та тепло рівноцінні, очевидно, додаткове тепло, необхідне для Температура газу при постійному тиску була точно такою ж роботою, яку виконував газ на контейнері. В (Історична примітка: хоча він виконав роботу в 1842 р., він видавав до 1845 р. і спочатку прорахувався, але потім дав цифру в межах 1% від правильної величини 4,2 джоуля на калорію.)
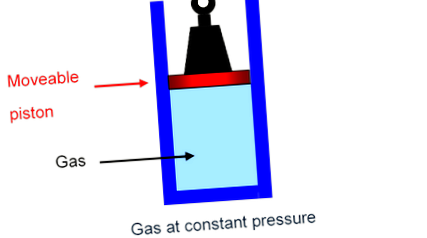
Найпростіший спосіб побачити, що відбувається, - уявити, як газ у балоні, утримуваний поршнем, несе фіксовану вагу, здатний плавно рухатися вгору-вниз по циліндру з незначним тертям. В Тиск на газ - це лише загальна вага, що натискає вниз, поділена на площу поршня, і ця загальна вага, звичайно, не зміниться, коли поршень повільно рухається вгору або вниз: газ знаходиться під постійним тиском.
Газоспецифічні опалення CV та CP
Розглянемо тепер дві специфічні теплоти цього самого зразка газу, скажімо, один моль:
Питома теплоємність при постійному обсязі, C V В (поршень приклеєний на місце),
Питома теплоємність при постійному тиску, C P В (поршень вільно піднімається, без тертя).
Насправді ми вже розробляли CV В у лекції з кінетичної теорії: при температурі T, В нагадаємо, середня кінетична енергія на молекулу становить 3 2 k BT, так що один моль газу - кількість молекул Авогадро - матиме загальну кількість кінетична енергія, яку ми позначимо як внутрішню енергію,
E int = 3 2 k B T ⋅ N A = 3 2 R T .
(У цьому найпростішому випадку ми ігноруємо можливість наявності молекул власними силами внутрішня енергія: вони можуть обертатися або вібрувати - ми скоро це включимо)
Те, що внутрішня енергія становить 3 2 R T В на моль, одразу дає нам питому теплоту моля газу у фіксованому обсязі,
це тепло, яке потрібно подавати для підвищення температури на один градус.
Однак якщо газ замість того, щоб знаходитись у нерухомій коробці, утримується в балоні під постійним тиском, експеримент підтверджує це більше повинно подаватися тепло для підвищення температури газу на один градус.
Як зрозумів Майер, загальна теплова енергія, яка повинна подаватися для підвищення температури газу на один градус при постійному тиску становить 3 2 k B В на молекулу плюс енергія, необхідна для підняття ваги.
Робота, яку газ повинен зробити, щоб підняти вагу, - це сила, яку газ чинить на поршень, помножена на відстань, яку рухає поршень.
Якщо площа поршня A, В, тоді газ під тиском P В чинить силу P A. В В
Якщо при нагріванні на один градус поршень піднімається на відстань Δ h В, газ справді працює
P A ⋅ Δ h = P Δ V .
Тепер для одного моля газу P V = R T, В при постійній P В
Отже, робота, яку виконує газ для підняття ваги, становить лише R Δ T, В питома теплоємність при постійному тиску, загальна теплова енергія, необхідна для підвищення температури одного моля на один градус,
Насправді ця залежність відповідає дійсності, незалежно від того, чи мають молекули обертальну чи вібраційну внутрішню енергію. (Це відоме як відношення Майєра.) Наприклад, питома теплоємність кисню при постійному об’ємі
C V (O 2) = 5 2 R
і це розуміється як внесок 3 2 R В від кінетичної енергії, і R В від двох режимів обертання молекули гантелі (тільки чому відсутній внесок у форму обертання навколо третьої осі можна зрозуміти лише за допомогою квантової механіки). В Питома теплоємність кисню при постійному тиску
C P (O 2) = 7 2 R .
Варто мати стандартний символ для співвідношення з конкретних нагрівань:
Відстеження газу в (P, V) Площина: Ізотерми та адіабати
Ідеальний газ у коробці має три термодинамічні змінні: P, V, T. В В Але якщо є фіксована маса газу, фіксація двох із цих змінних фіксує третю з P V = n R T В (для n В молей). У тепловій машині тепло може потрапляти в газ, а потім виходити на іншій стадії. Газ може розширюватися, виконуючи роботи, або стискатися в міру того, як виконується робота на ньому. Для відстеження того, що відбувається, коли газовий двигун передає тепло працюючи, скажімо, ми повинні стежити за різним станом газу. В Ми робимо це, простежуючи криву в площині (P, V) В.
Подача тепла до газу, який, отже, розширюється і виконує механічну роботу, є ключовим фактором теплової машини. Але знання того, що газ розширюється і виконує роботу, недостатньо інформації, щоб простежити його шлях у площині (P, V) В. В маршрут, яким він рухатиметься, буде залежати від того, подається (або відводиться) тепло одночасно. Однак існують два конкретні способи, як газ може оборотно поширюватися - це означає, що крихітна зміна зовнішніх умов достатньо, щоб газ пройшов шлях у площині (P, V) В назад. Важливо зосередитись на оборотних шляхах, тому що, як довів Карно, і ми обговоримо пізніше, вони відповідають найбільш ефективним двигунам. Два набори оборотних шляхів є ізотермами і адіабати.
Ізотермічна поведінка:В В газ підтримується при постійній температурі дозволяючи тепловому потоку туди і назад дуже великим предметом ("тепловим резервуаром") при температурі T. В В З PV = n RT, В видно, що для фіксованої маси газу, що утримується при постійній Т В, але під впливом (повільно) змінюваного тиску, змінні P, V В простежуватимуть гіперболічний шлях у (P, V) В площина.В
Цей шлях, P V = n R T 1, В кажуть, називається ізотермою при температурі T 1. В В В Ось два приклади ізотерм:
Адіабатична поведінка: В "адіабатичний" означає "нічого не проникає", в цьому випадку тепло не потрапляє і не виходить газу через стінки. Таким чином, вся робота, що виконується при стисненні газу, повинна йти у внутрішню енергію E int .
Коли газ стискається, він має криву в площині (P, V) В, яка називається адіабатою.В Щоб побачити, чим адіабата відрізняється від ізотерми, уявіть, що ми починаємо з якоїсь точки на синій ізотермі 273K на наведеному графіку та застосовуємо тиск, щоб газ рухався до більш високого тиску та нижчого об’єму. Оскільки внутрішня енергія газу зростає, але число молекул залишається незмінним, його температура обов'язково зростає, він рухатиметься до червоної кривої, а потім над нею. Це означає, що адіабати завжди крутіші за ізотерми.В
На діаграмі нижче ми додали пару адіабат до ізотерм:
Рівняння для адіабата
Яке рівняння для адіабати відповідає P V = n R T 1 В для ізотерми? В
При підвищенні температури газу на Δ T, В відбувається зміна внутрішньої енергії - сума молекулярної кінетичної енергії, енергії обертання та енергії коливань (якщо такі є),
Δ E int = C V Δ T .
Це завжди справедливо: незалежно від того, чи газ змінює об’єм, це не має значення, все, що враховується в E int В, - це сума енергій окремих молекул (припускаючи, як ми це робимо, що сили притягання чи відштовхування між молекулами незначні).
При адіабатичному стисненні вся робота, яку робить зовнішній тиск, надходить у цю внутрішню енергію, отже
(Стиснення газу, звичайно, дає від’ємний Δ V, В позитивний Δ E внутрішній В)
Щоб знайти рівняння адіабати, візьмемо нескінченно малу межу
розділіть ліву частину на P V, В праву частину на n R T В (оскільки P V = n R T,
В це нормально) знайти
- R C V d V V = d T n T .
- R C V d V V = d T n T .
Згадаймо тепер, що C P = C V + n R, В і C P/C V = γ. В Звідси випливає, що
n R C V = C P - C V C V = γ - 1.
- (γ - 1) ∫ d V V = ∫ d T T
ln T + (γ - 1) ln V = const .
з якого виходить рівняння адіабати
T V γ - 1 = конст .
З P V = n R T, рівняння P, V В для адіабати можна знайти, помноживши ліву частину цього рівняння на константу P V/T, В В
P V γ = конст. В для адіабати,
де γ = 5 3 В для одноатомного газу, 7 5 В для двоатомного газу.
- Практики охорони здоров’я в Стародавній Греції Гіппократовий ідеал
- Рівняння Закону про ідеальний газ; Виведення формули Priyamstudycentre
- Ідеальний відсоток жиру для футболістів - кондиціонування матчу
- Ідеальне споживання калорій. Запитайте Алісу!
- Ідеальна студія - знижка до 45% - Лінвуд, Вашингтон, Групон