Сульфат при вагітності
Пол А. Доусон
1 Дослідницький інститут Mater, рівень 4, Інститут трансляційних досліджень, Квінслендський університет, вул. Кент, 37, TRI, Вуллунгабба, QLD 4102, Австралія; Електронні листи: ua.gro.retam.irmm@ttoillea (A.E.); [email protected] (F.G.B.)
Аойфе Елліот
1 Дослідницький інститут Mater, рівень 4, Інститут трансляційних досліджень, Квінслендський університет, вул. Кент, 37, TRI, Вуллунгабба, QLD 4102, Австралія; Електронні листи: ua.gro.retam.irmm@ttoillea (A.E.); [email protected] (F.G.B.)
2 Mater Children's Hospital, Mater Health Services, Південний Брісбен, QLD 4101, Австралія
Френсіс Г. Боулінг
1 Дослідницький інститут Mater, рівень 4, Інститут трансляційних досліджень, Квінслендський університет, вул. Кент, 37, TRI, Вуллунгабба, QLD 4102, Австралія; Електронні листи: ua.gro.retam.irmm@ttoillea (A.E.); [email protected] (F.G.B.)
2 Mater Children's Hospital, Mater Health Services, Південний Брісбен, QLD 4101, Австралія
Анотація
1. Вступ
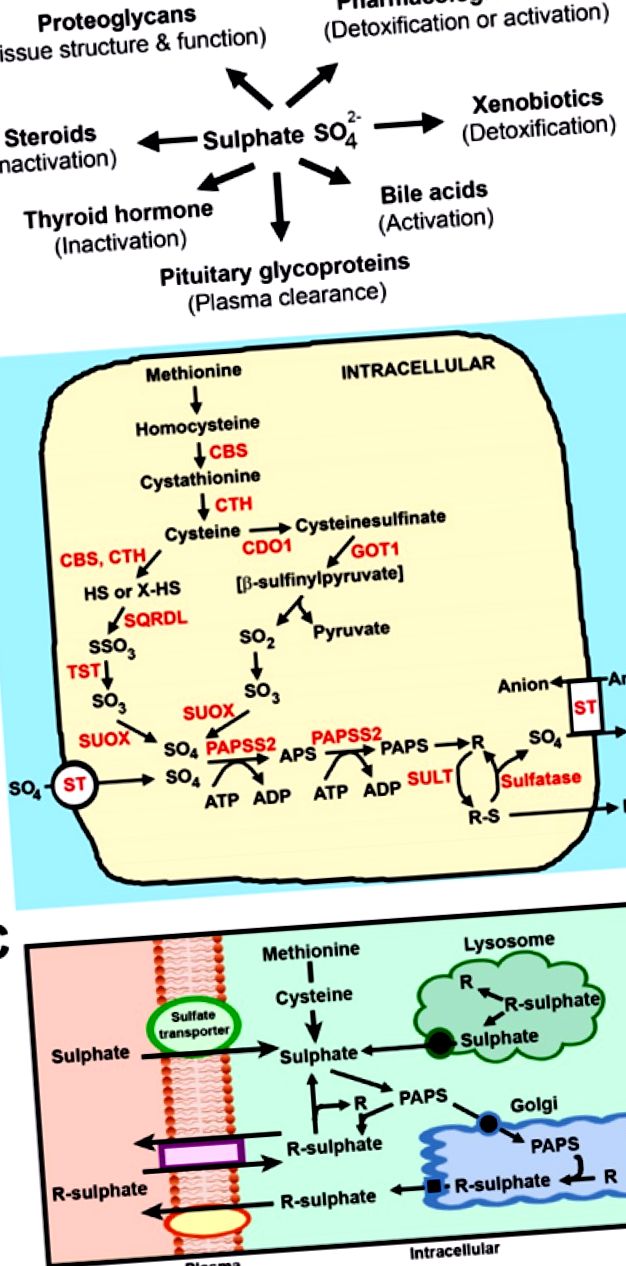
Біологічна роль сульфату та шляхи сульфатного гомеостазу. (A) Сульфонізація сприяє численним клітинним і метаболічним функціям у фізіології людини; (B) Шляхи внутрішньоклітинного утворення та сульфатування сульфату. Метіонін перетворюється в цистеїн шляхом транссульфурації за участю β-синтази цистатіоніну (CBS) та γ-ліази цистатіоніну (CTH). Цистеїн перетворюється в сульфат двома шляхами: незначний шлях, що включає CBS, CTH, сульфідхінонредуктазоподібний (SQRDL), тіосульфатсульфуртрансферазу (TST) і сульфітоксидазу (SUOX); і основний шлях, що включає цистеїндіоксигеназу (CDO), глутаміно-оксалооцтову трансаміназу 1 (GOT1) та SUOX. ST, сульфатні транспортери; PAPSS2, PAPS-синтетаза; СУЛТ, сульфотрансферази; R являє собою ті підкладки, показані в (А); (C.) Потік внутрішньоклітинних сульфатів та сульфованих молекул. У дорослих та дітей сульфат отримують із: (i) позаклітинних джерел через сульфатні транспортери; (ii) катаболізм метіоніну та цистеїну; (iii) гідроліз протеогліканів у лізосомі; та (iv) опосередковане сульфатазою видалення сульфату із субстратів у цитозолі.
2. Сульфат отримують із дієти
Сульфонування залежить від достатнього надходження сульфату, який отримують із раціону у вигляді вільного неорганічного сульфату (SO4 2−) або генерують із сульфованих сполук та сірковмісних амінокислот, метіоніну та цистеїну [5,12]. Добре збалансована дієта сприяє приблизно третій від розрахункової середньої потреби в сульфаті в організмі (0,2-1,5 г SO4 2−/день) [13,14,15,16]. Деякі харчові продукти, включаючи овочі міді та комерційний хліб, містять високий вміст сульфатів (> 0,9 мг/г), тоді як низький рівень сульфатів (500 мг/л у воді з джерельних джерел та дамб) [13,14,15]. перевищення 500 мг/л питної води може призвести до неприємного смаку, хоча деякі особи більш чутливі до менших концентрацій [16]. За оцінками, вдихання сульфату в повітрі вносить незначні кількості (0,01–0,04 мг SO4 2−/день) для дорослих [17]. Крім того, певні допологові полівітаміно-мультимінеральні добавки містять сульфат, переважно у вигляді безводного сульфату міді, сульфату цинку та сульфату марганцю, приблизно з 25–40 мг SO4 2−/таблетка.
Харчова цінність сульфату для сприяння зростанню лабораторних гризунів вперше була повідомлена майже століття тому [28]. Більш пізні дослідження на тваринах показали, що обмеження сульфату як у їжі, так і у воді може призвести до дефіциту сульфату та зменшення росту, що може бути скасовано за допомогою добавок сульфатів [29,30,31,32]. Крім того, високе споживання сульфатів з дією та введення сульфатних солей (MgSO4, Na2SO4 та ZnSO4) може призвести до збільшення циркулюючої сульфатемії та посилення сульфонової здатності [33,34,35,36,37,38,39]. Однак в даний час не рекомендується споживання дієти для неорганічного сульфату у людей, головним чином тому, що сульфат може утворюватися із сірковмісних амінокислот.
3. Вироблення сульфату з внутрішньоклітинного метаболізму
Білок складається приблизно з 4% сірковмісних амінокислот метіоніну та цистеїну [40]. Враховуючи, що рекомендована добова норма споживання білка для 19–50-річних під час вагітності становить 0,8–1,0 г/кг [41], то передбачувана кількість сульфату, що утворюється з білка, становить приблизно 1,7 г/добу. Як дорослі, так і діти здатні метаболізувати метіонін та цистеїн до сульфату [1]. Метіонін перетворюється в цистеїн шляхом транссульфурації, а цистеїн додатково окислюється до сульфату двома шляхами: Незначний шлях утворення сульфатів за допомогою цистатіонінової γ-ліази (CTH) та цистатіонін β-синтази (CBS); і основний шлях через цистеїндіоксигеназу (CDO) (рис. 1 В) [42]. Раніше дослідження повідомляли про відсутність CTH та CDO у печінці плода людини та гризунів, вказуючи на те, що плід, що розвивається, має обмежену здатність генерувати сульфат із сірковмісних амінокислот [43,44]. Це піднімає питання, які джерела забезпечують високі потреби плоду в сульфаті під час вагітності?
У дорослих та дітей на рівень циркулюючого сульфату впливає всмоктування в тонкому кишечнику, реабсорбція в нирках та поглинання їх у клітини по всьому тілу (рис. 2 А) [1]. Циркулюючий сульфат є основним джерелом сульфату для забезпечення внутрішньоклітинного сульфонування субстратів у цитоплазмі (стероїди, гормони, ксенобіотики та білки) або апараті Гольджі (протеоглікани) [45,46]. Однак загальний потік внутрішньоклітинного сульфату підтримується чотирма шляхами (рис. 1 С): (i) позаклітинний сульфат із циркуляції транспортується через плазматичну мембрану клітин через сульфатні транспортери; (ii) метіонін та цистеїн катаболізуються до сульфату; (iii) Сульфат видаляється з протеогліканів за допомогою ферментів сульфатази в лізосомі, а потім транспортується в цитоплазму; та (iv) цитозольні сульфатази видаляють сульфат із сульфованих молекул. Останні три джерела мають незначний або низький внесок у внутрішньоклітинний сульфатний пул плоду, який, отже, залежить від позаклітинних джерел сульфату [1]. Крім того, плід, що розвивається, має незрілу здатність до реабсорбції нирок та кишечника, що підкреслює обов’язкові вимоги щодо надходження сульфату від матері до плоду через плаценту протягом усього терміну вагітності.
Потоки сульфату між тканинами. (A) Внесок тонкої кишки, нирок та клітин у сульфатний гомеостаз (B) Материнський, фетальний та постнатальний внесок у сульфатацію хондроїтину. Порушення шляхів, що забезпечують достатнє надходження сульфату для хондроцитів (етапи 1–3) або внутрішньоклітинне сульфонування хондроїтину (етапи 4–5), призводять до хондродисплазії.
4. Сульфат постачається від матері до плоду
Під час вагітності у людей та гризунів рівень циркулюючого сульфату у матері збільшується більш ніж удвічі для задоволення гестаційних потреб зростаючого плода [47,48], і це примітно, оскільки більшість концентрацій іонів у плазмі крові зазвичай незначно знижуються під час вагітності через геморозведення [49] і говорить про його вирішальну роль у розвитку плода. Підвищений рівень сульфату крові у матері виникає внаслідок збільшення реабсорбції сульфатів у нирках матері (Рисунок 2 B) [47,48], що опосередковується підвищеною нирковою експресією гена SLC13A1 (він же NaS1, транспортер сульфату натрію 1) [50]. Порушення SLC13A1 у людей та мишей спричиняє втрату сульфату в сечі [51,52], і це значно знижує рівень сульфатів у крові (гіпосульфатемія). У мишей втрата гена Slc13a1 призводить до поведінкових відхилень (зниження пам'яті та нюхової функції та підвищення тривожності), зниження рівня серотоніну в мозку, затримка росту, порушення сульфонізації муцину в шлунково-кишковому тракті та посилення токсичності печінки, спричиненої ацетамінофеном [33,51,52, 53,54,55,56,57,58]. Крім того, вагітні самки нульових мишей Slc13a1 демонструють гіпосульфатемію протягом гестації, що призводить до дефіциту сульфату плода та викидня в середині гестації [48].
Нещодавно було виявлено, що споріднений ген SLC13A4 (він же NaS2, транспортер сульфату натрію 2) є найпоширенішим сульфатним транспортером у плаценті людини та миші [50,59]. SLC13A4 локалізований у синцитіотрофобластному шарі плаценти, місці обміну поживними речовинами матері та плода, де пропонується постачати сульфат від матері до плоду [59]. Втрата плацентарного SLC13A4 у мишей призводить до серйозних відхилень у розвитку плода та пізньої гестаційної загибелі плода, підкреслюючи обов'язкову потребу сульфату для здорового росту та розвитку плода [60].
За останнє десятиліття інтерес до ролі та регулювання сульфату під час вагітності зріс після характеристики обмеження росту та загибелі плоду на тваринних моделях зі зниженою здатністю до сульфонізації [11]. Наприклад, миші, у яких відсутня естрогенсульфотрансфераза естрогену Sult1e1, демонструють втрату плода в середині гестації [61]. Сульт1е1 експресується в плаценті, де він необхідний для утворення сульфованих форм естронсульфату, естрадіолу-3-сульфату та естріолсульфату. Втрата плода та порушення росту плода також пов’язані з деякими іншими сульфотрансферазами та сульфатазами, які підтримують необхідне біологічне співвідношення сульфованих до некон’югованих білків та протеогліканів [11]. Незважаючи на дані досліджень на тваринах, які показують фізіологічне значення сульфату під час вагітності, в клінічних умовах не проводиться рутинних вимірювань сульфату.
У людини вільний неорганічний сульфат (SO4 2−) є четвертим найбільш поширеним аніоном в циркуляції (приблизно 300 мкмоль/л) [62]. Ранні дослідження повідомляли про двократне збільшення рівня сульфату у плазмі крові у вагітних [35,63,64,65]. Пізніші дослідження використовували перевірений метод іонної хроматографії для встановлення референтних діапазонів рівня сульфату плазми у матері на ранніх (10–20 тижнів) та пізніх (30–37 тижнів) гестації, а також рівня сульфату плазми у шнурі при здорових вагітностях на терміні [47] . Тепер ці дані дозволять проводити клінічні дослідження результатів низьких рівнів сульфату плазми у матері та дитини, і, швидше за все, розширять наші сучасні знання щодо наслідків дефіциту сульфатів, особливо розвитку скелета, який чутливий до дефіциту сульфатів.
5. Знижена здатність до сульфонізації стримує ріст та розвиток скелета
У ссавців сульфовані протеоглікани є важливим компонентом позаклітинних матриксів у всьому тілі, особливо в сполучних тканинах [66,67]. Вміст сульфатів протеогліканів впливає на сигнальну функцію клітин та структурну цілісність тканин [5]. Високосульфовані глікопротеїни, включаючи хондроїтин протеоглікан (CSPG), відіграють важливу роль у скелеті, що розвивається, з посиланнями на модуляцію сигнального шляху індійського їжака [68]. Важливо зазначити, що сульфонування CSPG в хондроцитах має важливе значення для нормального росту та розвитку скелета, а деякі скелетні розлади пов’язані з генетичними дефектами, що призводять до зниження сульфонової здатності [11].
Хондроцити покладаються на рясний запас позаклітинного сульфату, щоб задовольнити внутрішньоклітинні потреби в сульфатуванні CSPG (рис. 2 Б). Сульфат транспортується в хондроцити через сульфатний транспортер SLC26A2 (етап 3 на малюнку 2 B) [69]. Понад 30 мутацій людського гена SLC26A2 були пов'язані з хондродисплазіями [70], при цьому основним метаболічним дефектом є зменшення сульфонізації хондроїтину в хондроцитах [71]. Мутантні миші Slc26a2 також виявляють хондродисплазії, що імітують біохімічні та морфологічні фенотипи, виявлені у людей [71,72,73]. Обробка мутантних мишей Slc26a2 дієтичним N-ацетилцистеїном показала підвищену сульфонізацію протеоглікану та поліпшення скелетних фенотипів [31], вказуючи на те, що тіолвмісні сполуки можуть підвищити рівень внутрішньоклітинного сульфату, необхідного для сульфонування CSPG.
Втрата PAPS (3′-фосфоаденозин 5′-фосфосульфату) синтетази також пов’язана з порушенням сульфонізації CSPG та скелетними дисплазіями [74]. ПАПС є універсальним донором сульфонату для всіх реакцій сульфонування, і його утворення залежить від достатнього внутрішньоклітинного надходження сульфату (етап 4 на малюнку 2 Б) [75]. Геноми ссавців містять два гени PAPS-синтетази, PAPSS1 та PAPSS2 [76,77,78]. PAPSS2 був пов’язаний з патофізіологією людини з подібними скелетними фенотипами, виявленими у мишей-мутантів Papss2 [76,78]. Крім того, порушення гена-транспортера PAPS у даніо (PAPST1, він же пінчер) призводить до дефектів хряща [79]. Скелетні фенотипи також виявляються у пацієнтів з мутаціями гена хондроїтин 6-О-сульфотрансферази (етап 5 на малюнку 2 B) [80], показуючи, що сульфонізація хондроїтину важлива для підтримки здорового розвитку скелета. Ці висновки підкреслюють важливість шляхів, що ведуть до сульфатації хондроїтину для здорового розвитку, росту та підтримки скелета.
В даний час не існує ліків від найважчих форм скелетної дисплазії, ателостеогенезу типу II та ахондрогенезу типу IB, які призводять до недорозвинення скелета та смерті внутрішньоутробно або в період новонародженості [70]. Легка (множинна епіфізарна) та середня (діастрофічна дисплазія) форми захворювання лікуються за допомогою ортопедичного та болючого лікування, але ці пацієнти стикаються з інвалідністю протягом усього життя. Інші гени, включаючи PAPSS2, беруть участь у патологічному рості та розвитку скелета у людини [76], а клінічний спектр, асоційований з PAPSS2 та SLC26A2, додатково розширився, включаючи остеоартроз колінного суглоба [81], що припускає, що розлади сульфатації, швидше за все, будуть більш поширеними, ніж за оцінками 2% всіх скелетних дисплазій, що базується на живонародженні [82]. Це також стосується нещодавніх досліджень, які зв’язали нирковий ген транспортера сульфату Slc13a1, який є важливим для підтримання рівня циркулюючого сульфату, із скелетними дисплазіями у тварин [83,84]. Ці висновки, ймовірно, будуть актуальними для росту та розвитку скелета людини. У сукупності відсутність лікувальних методів лікування сульфофункції скелета призводить до значного навантаження на сім'ї та громаду [85].
6. Висновок
Сульфат - обов’язкова поживна речовина для здорового росту та розвитку. Незважаючи на те, що це має важливе значення для численних клітинних та метаболічних процесів у розвитку плода, його значення в значній мірі недооцінено в клінічних умовах. Моделі на тваринах показали руйнівні фізіологічні наслідки зниження сульфонової здатності на ріст та розвиток плода, що має відношення до встановленого зв'язку з хондродисплазіями людини. Достатній запас сульфату, або з раціону, або з сірковмісних амінокислот, повинен надходити від матері до плоду, особливо в кінці вагітності, коли потреба плода в сульфаті висока. Розробка затвердженого методу кількісного визначення сульфатів, разом із останніми даними для материнської плазми сульфатів плазми крові, тепер вимагає подальших досліджень наслідків дефіциту поживних речовин сульфатів у матері та дитини.
Подяка
Ця робота була підтримана Інститутом медичних досліджень Mater, Фондом Mater та Дослідницьким фондом Mater Foundation до PAD.
Внески автора
PAD задумав тему, взяв участь у розробці та координації та склав рукопис. AE та FGB брали участь у розробці статті та допомагали скласти рукопис. Усі автори прочитали та схвалили остаточний рукопис.
Конфлікт інтересів
Автори не заявляють конфлікту інтересів.
- Метод витягування запобігає вагітності
- Немає безпечного рівня пиття кави для вагітних, зазначає дослідження "Вагітність The Guardian"
- Безалкогольні напої для вагітності - BabyCentre UK
- Тазовий біль під час вагітності (SPD) - BabyCentre UK
- Стелазин - побічні ефекти, застосування, дозування, передозування, вагітність, алкоголь RxWiki